脊髓损伤患者大脑中央前回的代谢改变
李雅静,李建军,高峰,郭韵,刘俊,徐珮珮
1.首都医科大学康复医学院,北京市 100068;2.中国康复研究中心北京博爱医院脊柱脊髓神经功能重建科,北京市 100068;3.中国康复科学所,北京市 100068;4.北京脑重大疾病研究院神经损伤与修复研究所,北京市 100068;5.北京市神经损伤与康复重点实验室,北京市 100068;6.北京清华长庚医院,北京市 102218
脊髓损伤是一种严重的中枢神经系统(central nervous system,CNS)疾病,可导致损伤水平以下感觉、运动和自主神经功能障碍,具有高致死率、高致残率、高花费的特点。理解并掌握发病机制对于疾病的治疗具有重要意义[1]。脊髓损伤发生后,大脑也继发生物化学和病理改变[2],如萎缩、神经元凋亡、灰质体积减小、白质脱髓鞘、皮质结构和功能重塑等[3-7]。Freund等[8]发现,颈段脊髓损伤患者皮质脊髓束发生脱髓鞘和萎缩;磁共振成像(magnetic resonance imaging,MRⅠ)显示,脊髓损伤患者在损伤后1个月内,皮质脊髓束和感觉运动皮质发生萎缩和微结构改变[9]。进一步研究显示,创伤后轴索退变和脱髓鞘与大脑皮质重组有关,轴索完整性可以预测皮质重组[10]。Hou等[11]发现,脊髓损伤患者早期初级运动皮质(primary motor cortex,M1)和初级感觉皮质(primary sensor cortex,S1)萎缩,萎缩程度与脊髓损伤严重程度正相关。脑MRⅠ显示[12],脊髓损伤患者躯体感觉皮质萎缩。Hains等[13]发现,脊髓损伤患者M1神经元凋亡。Lee等[14]认为,脊髓损伤后的功能障碍不仅源于直接的机械伤害,还有继发脊髓和大脑的生物化学和病理改变,皮质细胞凋亡可能与急性脊髓损伤后大脑运动皮质的病理生理改变有关,并促进患者功能恶化。Choe等[15]对1例颈段脊髓损伤患者进行17年随访,患者从最初的卧床状态恢复到独立行走,静息态功能磁共振成 像(functional magnetic resonance imaging,fMRⅠ)显示,患者枕叶皮质代偿性增大,患者行走更多依靠视觉反馈,反映脊髓损伤患者大脑皮质重塑。Crawley等[16]观察M1的形态学改变,但并无明显统计学差异,可能脊髓损伤后皮质重组主要是功能性重组,结构重组不明显。Henderson等[17]发现,脊髓损伤患者大脑皮质功能重组包括脑中休眠突触重新活跃和新突触形成。Kim等[18]发现,脊髓损伤后皮质运动区突触结构重塑。脑的功能重组既可能促进运动感觉功能恢复,也会产生神经痛、幻觉、痉挛等并发症[19-20]。Peng等[21]发现,脊髓型颈椎病患者右侧丘脑和中央前回的功能连接下降。Matsubayashi等[22]对慢性完全性脊髓损伤小鼠行fMRⅠ,发现M1与S1的功能连接降低,M1和S1体积减少。
少量研究表明,脊髓损伤后大脑发生代偿性修复。Xu等[23]认为,脊髓损伤后皮质脊髓束运动系统皮质有代偿性改变,如突触重组、脑纤维束数量增加等。神经元轴突损伤后,修复能力取决于神经元胞体的活性和功能完整性。大脑中央前回M1的大锥体细胞发出轴突,下行形成皮质脊髓束;促进皮质脊髓束再生和修复的重要前提是防止大脑运动皮质神经元损伤。本研究利用磁共振波谱(magnetic resonance spectroscopy,MRS)技术探索脊髓损伤后大脑M1的改变,并分析其临床意义。
MRS是目前唯一可以无创性检测活体组织代谢物浓度、生化改变的定量分析方法,能反映能量代谢、髓鞘形成、神经元密度和功能、神经胶质损伤或细胞膜改变,可提供神经组织生化过程信息,具有早期发现、无创、可重复等特点[24-25]。目前使用MRS可以检测18种代谢物浓度,包括氮-乙酰天门冬氨酸(N-acetylaspartate,NAA)、胆碱(choline,Cho)、肌酸(creatine,Cr)、肌 醇(myo-Ⅰnositol,MⅠ)、乳 酸(Lactate,Lac)等。NAA是神经元活性和完整性的标志物;Cho是髓鞘代谢产物,是髓鞘完整性的标志;Cr是能量代谢的标志;MⅠ是神经胶质细胞的标志物,与其增殖、损伤等有关,还参与调节渗透压、抗氧化等过程;Lac的出现代表细胞出现无氧呼吸,是组织细胞缺氧的表现[26]。MRS已用于脑卒中、多发性硬化、帕金森病、肿瘤、肌萎缩脊髓侧索硬化症、遗传性共济失调等疾病的诊断、治疗、病情评估和预后评估中[27]。Bellenberg等[28]对弥漫性和局灶性颈髓多发性硬化患者行脊髓MRS,发现弥漫性病变患者颈髓萎缩更明显,NAA水平更低,Cr水平更高。Ellingson等[29]对脊髓型颈椎病患者行脊髓MRS,发现Cho/NAA与改良日本骨科学会评分相关,可作为神经损伤的预测指标。Hock等[30]发现,室管膜瘤NAA/Cr降低,Cho/Cr和MⅠ/Cr轻微增高;2例高级别肿瘤中,NAA/Cr降低,Cho/Cr轻度增加;1例髓外肿瘤代谢物浓度无明显变化;这些脊髓肿瘤代谢物浓度的变化与脑肿瘤代谢物浓度的变化一致,提示MRS有可能鉴别恶性肿瘤。Ⅰltis等[31]发现,遗传性共济失调患者小脑蚓部和小脑半球NAA浓度降低,MⅠ、谷氨酸浓度升高,提示神经元丢失,神经胶质细胞增生,谷氨酸能神经传递系统改变。
1 资料与方法
1.1 一般资料
选取北京博爱医院脊柱脊髓神经功能重建科2018年12月至2019年10月期间住院患者。
纳入标准:①年龄18~65岁;②右利手;③认知功能正常,未服用影响认知功能的药物;④自愿配合完成MRS检查。
排除标准:①并发其他神经系统疾病;②患有焦虑、抑郁等精神疾病;③MRS检查禁忌症;④幽闭恐惧症、不能依从或不能配合完成测试;⑤特殊职业,如运动员、音乐家等。
共纳入患者20例,其中男性17例,女性3例;年龄19~60岁,平均(34.2±11.1)岁;病程1~17个月,平均(7.7±4.4)个月;创伤性脊髓损伤17例,非创伤性脊髓损伤3例;颈髓损伤7例,胸髓损伤12例,腰髓损伤1例;根据美国脊髓损伤协会脊髓损伤分级,A级9例,B级4例,C级2例,D级5例。选取年龄、教 育背景匹配,右利手的健康人15例,均既往体健,无基础疾病或慢性病史,其中男性9例,女性6例;年龄24~51岁,平均(38.7±11.9)岁。两组性别(χ2=1.648,P=0.199)和年龄(t=1.147,P=0.260)无显著性差异。
本研究由中国康复研究中心医学伦理委员会审核通过(No.2018-085-1)。所有受试者均知情同意,并在入组前签署知情同意书。
1.2 MRS数据采集
采用飞利浦(荷兰PHⅠLⅠPS公司)3.0 T多源发射磁共振机,感兴趣区10×10×10 mm,置于左侧大脑M1区(图1);单体素氢质子波谱点分辨自旋回波波谱序列(SV-PRESS-144),扫描参数:TR/TE 2000/144 ms,扫描时间836 s,激励水抑制法采集信号。自带软件分析NAA、Cho、MⅠ、Cr波谱峰值,波谱线下面积分析NAA/Cr、Cho/Cr、Cho/NAA比。
1.3 统计学分析
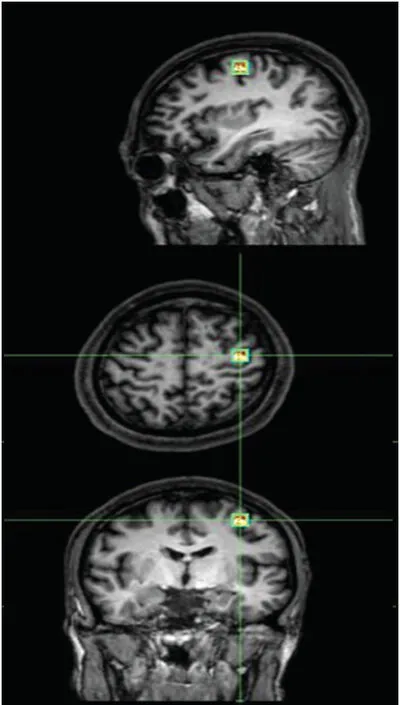
图1 大脑M1区矢状面、横断面、冠状面定位
2 结果
患者组MⅠ浓度较对照组明显升高(P<0.01),两组间NAA、Cho、Cr、NAA/Cr、Cho/Cr、Cho/NAA无显著性差异(P>0.05)。见表1。
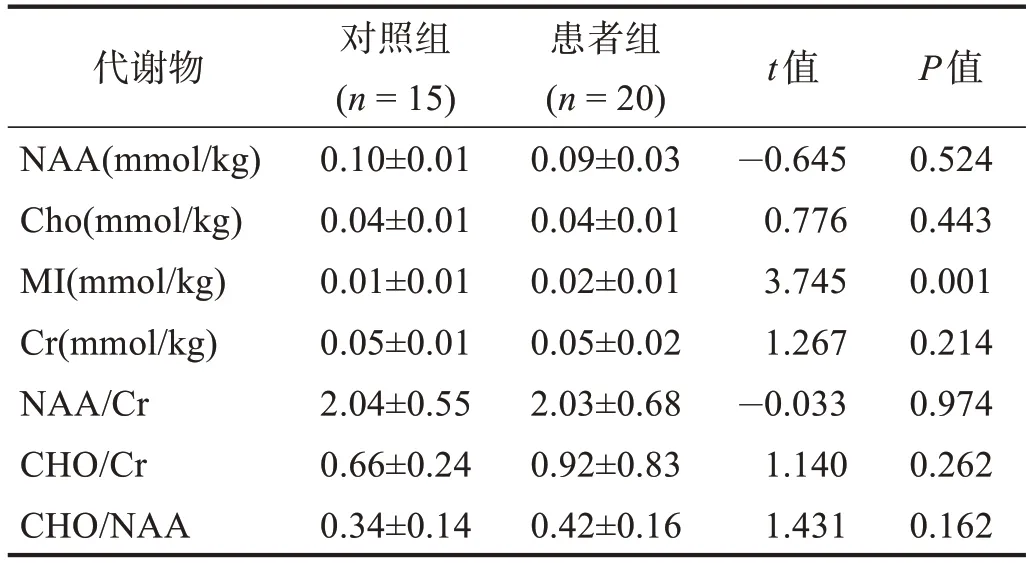
表1 两组左侧M1区代谢物比较
3 讨论
脊髓损伤常见的创伤性病因有高处坠落、车祸、重物砸伤等,非创伤性病因包括椎间盘突出、脊柱转移性疾病和椎管狭窄[32]。在世界范围内,脊髓损伤发病率约(3.6~195)/100万[33]。目前治疗主要是手术减压预防继发性损伤;药物缓解神经痛、痉挛等并发症;康复训练促进功能恢复;弹力袜、气压泵等的预防并发症。
脊髓损伤不仅造成脊髓局部神经元坏死/凋亡、脊髓萎缩,以及纤维传导束破坏,大脑也发生一系列改变。以往的研究多忽视脊髓损伤与大脑之间的影响。脊髓损伤后,感觉运动传导束恢复和再生缓慢,而轴突的修复主要取决于神经元胞体活性和完整性。由于感觉运动传导束的神经元胞体位于大脑皮质,推测脊髓损伤后大脑皮质也受损,导致轴突再生和修复无法完成。静息态fMRⅠ研究发现,完全性颈脊髓损伤患者中央前回和中央后回功能连接下降[34];慢性完全性颈脊髓损伤患者脑网络连通性降低[35]。脊髓损伤后,感觉运动和自主神经通路传入和传出分离,导致大脑结构和功能改变,包括脑网络重组[36]。脊髓损伤患者脊髓面积减少,前扣带皮质灰质体积减少,左侧岛叶、左侧次级体感皮质、双侧丘脑、皮质脊髓束白质减少,左侧内囊白质体积减少[37];导致脑白质跨神经元变性[5];M1发生神经元和纤维束凋亡、皮质萎缩和皮质结构和功能重组[18,38-39]。同时,脊髓发生白质脱髓鞘、萎缩等一系列改变,以及代偿性胶质增生,甚至形成胶质瘢痕[40]。
对于损伤后胶质增生的作用,部分研究认为可促进神经轴突再生,部分研究认为阻碍轴突再生。Haggerty等[41]认为,脊髓损伤后,胶质瘢痕含有反应性星形胶质细胞,它们是细胞外基质的主要来源;而细胞外基质在神经元和非神经元细胞的生存和功能中起信号调节作用,能促进内在修复。Okada等[42]发现,脊髓损伤后,周围星形胶质细胞肥大,向中心迁移,帮助组织修复;但它们最终会变成瘢痕状星形胶质细胞,产生轴突生长抑制剂,阻止轴突再生。Orr等[43]认为,星形胶质细胞、小胶质细胞、周细胞、内皮细胞、施万细胞、成纤维细胞、脑膜细胞等胶质细胞可以促进内源性修复;在胶质瘢痕内和周围,存在影响轴突生长的细胞外基质蛋白,如硫酸软骨素蛋白多糖、层黏连蛋白、胶原蛋白和纤维连接蛋白;纤维性瘢痕是内源性修复障碍,激活的胶质细胞和神经元之间的联系是内源性修复的基础。Wang等[44]发现,血小板活化因子信号参与小鼠脊髓损伤后反应性胶质增生,阻断这种信号可以增强功能恢复,促进轴突再生。
本研究显示,脊髓损伤后M1区发生代偿性胶质增生。MRS可以在MRⅠ产生变化之前,观察到代谢物的异常变化[45]。NAA在正常人脑MRS中是最高峰,位于2.0×10-6,全部存在于神经元胞体和突触中,由神经元线粒体产生,是神经元的标志物,与神经元的完整性、功能、损伤、活性、生存能力有关,是最重要的代谢物[46]。Cho在正常人脑MRS中是第二高峰,位于3.2×10-6,是乙酰胆碱和磷脂酰胆碱的前体物质,前者是重要的神经递质,后者参与细胞膜构成;Cho作为髓鞘的降解产物,是髓鞘完整性的标志。Cr在正常人脑MRS中是第三高峰,位于3.0×10-6,是高能磷酸盐的储备形式,被认为是能量代谢的标志。同一个体不同代谢状态下,Cr总量不变,因此可作为内标物,与其他代谢物进行比较分析。MⅠ为神经胶质细胞的标志物,与其增殖、损伤等有关,还参与调节渗透压、抗氧化等过程。正常人脑中测不到Lac峰,只有在组织缺氧时才能测到,是脑卒中、新生儿缺氧缺血病的敏感检测指标[27]。
本研究显示,脊髓损伤患者左侧M1区MⅠ浓度升高,提示脊髓损伤后M1区发生代偿性增生,主要是胶质细胞增生,可能反映损伤后大脑重塑。CNS中,90%的细胞为神经胶质细胞,包括小胶质细胞、星形胶质细胞、少突胶质细胞、施万细胞和卫星细胞等。Pfrieger等[47]发现,胶质细胞可促进神经元间的突触交流。目前认识到,胶质细胞可支持修复再生,促进突触形成,调节突触传递、物质代谢和营养作用,调节神经细胞离子浓度和传递第二信使,参与神经元间信息交流,抗氧化作用,促进神经元分化和神经生长,参与中枢免疫调节和炎症反应,绝缘和屏蔽作用等[48]。参与多种疾病的病理生理过程。CNS损伤后常见反应性胶质增生,表现为星形胶质细胞数增加,细胞出现更多胶质丝和突起,代谢增强。星形胶质细胞及其突起能够缠绕损伤的神经元,最终导致胶质瘢痕形成[49]。胶质细胞过度增生形成微血管套,压迫微血管,影响血液供应;活化的星形胶质细胞突起增多、变粗、变长,紧密交织形成致密结构,构成物理屏障,使再生的神经轴突很难穿越;同时胶质细胞分泌多种蛋白多糖,形成化学屏障;阻碍神经轴突再生[50-53]。胶质细胞还参与脊髓损伤后并发症的发生,如神经痛[54]。Anderson等[55]发现,适当的胶质增生和胶质瘢痕形成可促进轴突再生。星形胶质细胞可以产生和分泌多种神经因子,维持神经元的生长、发育和分化。反应性星形胶质细胞上调一些促进突触形成的基因,帮助修复大脑[56]。本研究只发现MⅠ浓度两组间有显著性差异,NAA浓度无显著性差异,与以往脊髓损伤导致大脑皮质萎缩、神经元凋亡、结构和功能重组的研究结论不符,可能由于选定的感兴趣区过小或样本量过小。与其他研究相比[57],本研究选定的感兴趣区严格控制在M1,不受周围脑组织、脑积液、颅骨等结构的干扰。未来可扩大探测范围,增加样本量,关注胶质增生的程度与功能恢复的关系。
利益冲突声明:所有作者声明不存在利益冲突。

