大麻素受体1型基因多态性对利拉鲁肽治疗早期2型糖尿病患者临床疗效的影响研究
任丽君,王军杰,马豪莉,侯会娟,司马盼盼,宋瑞捧
糖尿病传统上被称为“无症状疾病”,直到进展到靶器官严重损伤时才表现出症状[1]。作为成年人发病最普遍的糖尿病—2型糖尿病(T2DM),是一种由环境、遗传因素、生活方式共同相互作用而产生的内分泌代谢紊乱性疾病[2]。同时T2DM能够对诸多,如:心血管疾病、神经性疾病、脑卒中、肾病、视力障碍、溃疡性疾病、消化系统疾病和抑郁症等代谢并发症起到潜在的贡献作用[3]。
利拉鲁肽与人体内源性酰化胰高血糖素样肽1(GLP-1)氨基酸序列组成高度相似,既保持了天然GLP-1的功效,又增加了其代谢稳定性[4]。在利拉鲁肽的Ⅲ期临床试验中,无论是单药治疗还是联合其他药物治疗,利拉鲁肽均能有效降低患者血糖水平,目前已经成为临床上常用的肠促胰岛素激素药物[5]。但临床应用过程中尚存在较大的个体差异,研究发现某些候选基因的多态性可能影响T2DM患者对疾病进展的易感性或风险,因此对于T2DM的基因多态性研究具有重要意义。
通过候选基因和全基因组关联性分析研究至少发现了近100个遗传变异对T2DM有贡献作用的相关位点[6]。目前发现位于6Q14-Q15位置的内源性大麻素受体1型基因(CNR1)在糖尿病及其并发症中发挥重要作用[7],全基因包括了8个外显子,在不同人群中具有较大的差异。其中CNR1基因密码子435的沉默基因的多态性位点1260G>A与肥胖、T2DM以及代谢综合征等多种疾病有关[8]。因此CNR1基因1260G>A的单核苷酸多态性被认为是T2DM的重要关联易感基因,由于不同个体基因组的差异既影响T2DM发生、发展的风险,也影响个体对于相同治疗药物的不同反应。目前在中国人群中尚未见关于CNR1基因1260G>A位点和利拉鲁肽治疗T2DM疗效的关联研究。因此本研究旨在探讨真实世界中利拉鲁肽治疗早期T2DM患者的临床疗效及CNR1基因多态性分析,以期找到可以影响利拉鲁肽降糖疗效个体差异的基因多态性。
1 对象与方法
1.1 研究对象 本研究设计为回顾性分析,选取2016年3月—2018年10月河南省直第三人民医院内分泌科收治的早期T2DM患者作为研究对象。纳入标准:(1)确诊T2DM病程≤2年,且单用二甲双胍不能达到有效的血糖控制,使用利拉鲁肽进行糖尿病治疗;(2)体质指数(BMI)为23.0~32.0 kg/m2;(3)空腹血糖(FPG)≥7.0 mmol/L,或餐后2 h血糖(2 hPG)≥11.1 mmol/L,糖化血红蛋白(HbA1c)≥6.5%[9]。排除标准:(1)既往接受GLP-1类药物治疗;(2)使用利拉鲁肽进行治疗的同时合并其他降糖药物治疗;(3)经临床诊断的其他类型糖尿病、肝肾疾病、心肌梗死或脑卒中等心脑血管疾病及恶性肿瘤。根据纳入与排除标准最终纳入230例患者。选取同期本院健康受试者200例,未服用影响糖脂代谢的药物,排除有糖尿病家族史者。本研究经河南省直第三人民医院伦理委员会审核通过,患者或家属均知晓本研究计划并签署知情同意书。
1.2 治疗方式 患者均皮下注射利拉鲁肽〔诺和诺德(中国)制药有限公司分包装,国药准字:J20160037,规格:3 ml:18 mg〕进行治疗,初始剂量0.6 mg/d,随后调整剂量为1.2 mg/d,治疗期间可根据患者的血糖水平以及耐受情况进行调整,但最大剂量<1.8 mg/d。
1.3 疗效评定 治疗16周后评估患者治疗前后的BMI、FPG、2 hPG和HbA1c水平。其中身高为患者入院时的身高,体质量为患者治疗前和治疗16周后空腹状态下的体质量。治疗前及治疗16周后抽取患者静脉血2 ml,送至医院检验科进行测定,其中,FPG和2 hPG采用己糖激酶法测定,HbA1c采用低压液相色谱法测定。
1.4 DNA提取及基因分型 抽取研究对象外周静脉 血 5 ml, 采 用 Chelex-100(Bio-Rad,Hercules,CA)从全血中提取基因组DNA,于-20 ℃冰箱保存,用于聚合酶链反应(PCR)扩增。设计1260G>A位点(rs1049353)的上下游PCR引物,对该位点及附近的DNA片段进行扩增,上游引物序列5'-GAAAGCTGCATCAAGAGCCC-3',下游引物序列5'-TTTTCCTGTGCTGCCAGGG-3',扩增条件:95 ℃初始变性6 min,随后35个94 ℃循环30 s,60 ℃退火30 s,72 ℃延伸 1 min,72 ℃延伸 7 min。37 ℃用 5 U MSP Ⅰ限制性核酸内切酶(德国圣莱昂罗特酵素股份有限公司)将10 μl的PCR产物过度消化。通过2%琼脂糖凝胶电泳分离消化产物,A等位基因被切割成92、19 bp两个片段,G等位基因保持未切割,产生111 bp的片段。
1.5 PCR扩增及mRNA表达分析 收集患者新鲜外周血标本,但由于新鲜的外周血单核细胞(peripheral blood monouclear cells,PBMC)标本较难获取,最终纳入125例新鲜外周血标本采用淋巴细胞分离液Histopaque-1077对样本进行PBMC提取。用Trizol试剂提取PBMC中的RNA,real-time PCR仪器进行mRNA表达实验,引物序列如下:CNR1-1260G>A上游引物5'-TTCACAGGGCCGCAGAAAG-3',下游引物5'-GAGGCATCAGGCTCACAGAG-3'。探针序列如下:野生型探针5'-Fam-ATCAAGAGCACGGTCAAGATTGCC-TAMRA-3',突变型探针5'-VIC-ATCAAGAGCACAGTCAAGATTGCCTAMRA-3'。mRNA采用相对定量法2-ΔΔCt进行计算。
1.6 统计学方法 采用SPSS 19.0软件进行统计学分析,符合正态分布的计量资料以(±s)表示,两组间比较采用t检验,同组治疗前后的比较采用配对t检验;计数资料的分析采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 入组患者基线临床资料 230例患者中,男119例,女111例;年龄27~59岁,中位年龄43岁;BMI为(26.6±1.2)kg/m2;FPG 为(10.6±1.2)mmol/L;2 hPG为(14.2±1.2)mmol/L;HbA1c为(9.0±0.9)%。
1260G>A位点的基因分型结果为:GG型188例(81.7%),GA型39例(17.0%),AA型3例(1.3%),最小等位基因频率为0.098,三种基因型分布频率符合哈迪温伯格平衡(P=0.550)。由于AA型例数较少,后期分析将GA型和AA型患者合并。该位点不同基因型患者性别、年龄、BMI、FPG、2 hPG、HbA1c水平比较,差异均无统计学意义(P>0.05,见表1)。
2.2 利拉鲁肽对早期T2DM的疗效 治疗16周后,230例患者BMI为(23.6±1.0)kg/m2,FPG为(5.8±0.8)mmol/L,2 hPG 为(9.9±1.3)mmol/L,HbA1c为(6.4±0.8)%。治疗16周后患者BMI、FPG、2 hPG、HbA1c水平均低于治疗前,差异有统计学意义(t配对=29.127、50.475、36.860、32.746;P<0.001)。

表1 1260G>A位点不同基因型T2DM患者基线资料比较Table 1 Comparison of baseline clinical characteristics among T2DM patients with different CNR1 1260G>A genotypes
2.3 CNR1基因多态性位点易感性分析 对200例健康志愿者的CNR1基因1260G>A位点进行基因分析,基因型分布频率如下:GG型163例(81.5%),GA型35例(17.5%),AA型2例(1.0%),最小等位基因频率为0.10,三种基因型分布频率符合哈迪温伯格平衡(P=0.937)。T2DM患者和健康志愿者基因型分布比较,差异无统计学意义(χ2=0.104,P=0.949)。
2.4 CNR1基因多态性位点对利拉鲁肽疗效的影响治疗前,GG型和GA/AA型患者BMI、FPG、2 hPG、HbA1c水平比较,差异均无统计学意义(P>0.05)。治疗16周后,GG型和GA/AA型患者2 hPG水平比较,差异无统计学意义(P>0.05);GA/AA型患者BMI、FPG、HbA1c水平均低于GG型,差异有统计学意义(P<0.05)。GG型和GA/AA型患者治疗16周后BMI、FPG、2 hPG、HbA1c水平均低于治疗前,差异有统计学意义(P<0.05,见表2)。
2.5 CNR1基因多态性位点对CNR1基因mRNA表达的影响 通过提取PBMC标本中的RNA测定各组CNR1 mRNA的表达情况,并与1260G>A位点的基因型进行相关性分析。在125例病例样本中,GG型102例,GA型22例,AA型1例,三种基因型分布频率符合哈迪温伯格平衡(P=0.876)。AA型患者相对较少,将GA型和AA型合并,共计23例。GG型患者CNR1 mRNA表达水平为(4.2±1.3),高于GA/AA型患者的(2.8±1.2),差异有统计学意义(t=4.728,P<0.001)。
2.6 不同基因型患者的不良反应情况 使用利拉鲁肽治疗过程中,患者出现不同程度的恶心呕吐、低血糖等不良反应。不同基因型患者恶心呕吐、低血糖及总体不良反应发生率比较,差异均无统计学意义(P>0.05,见表3)。
3 讨论
本研究纳入了230例接受利拉鲁肽治疗的早期T2DM患者,通过对CNR1基因1260G>A位点基因分型并与患者的疗效进行关联分析。发现该位点携带A等位基因的GA/AA基因型患者相对于野生型GG型患者来说具有更好的控制血糖的相关疗效,并通过125例PBMC标本的CNR1 mRNA表达水平分析发现了该位点不同基因型患者的mRNA表达水平呈现较大的差异。CNR1基因1260G>A位点可能通过影响该基因mRNA的表达进而影响利拉鲁肽对T2DM患者的临床效果。
表2 1260G>A位点不同基因型T2DM患者治疗前后BMI、FPG、2 hPG和HbA1c水平比较(±s)Table 2 Comparison of BMI,FPG,2 hPG,HbA1c among T2DM patients with different CNR1 1260G>A genotypes before and after treatment

表2 1260G>A位点不同基因型T2DM患者治疗前后BMI、FPG、2 hPG和HbA1c水平比较(±s)Table 2 Comparison of BMI,FPG,2 hPG,HbA1c among T2DM patients with different CNR1 1260G>A genotypes before and after treatment
注:与同组治疗前比较,aP<0.05
images/BZ_66_964_485_985_515.pngimages/BZ_66_1407_485_1428_515.pngimages/BZ_66_1844_485_1865_515.png基因型 例数 BMI(kg/m2) FPG(mmol/L) 2 hPG(mmol/L) HbA1c(%)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后GG 型 188 26.7±1.2 23.6±1.0a 10.6±1.2 5.9±0.7a 14.2±1.2 9.9±1.4a 9.0±0.9 6.4±0.8a GA/AA 型 42 26.3±1.0 22.9±0.7a 10.4±1.1 5.3±0.6a 13.9±1.1 9.5±1.2a 8.8±1.0 6.1±0.7a t值 2.009 4.304 0.991 5.147 1.486 1.716 1.275 2.245 P值 0.068 <0.001 0.323 <0.001 0.139 0.088 0.204 0.026
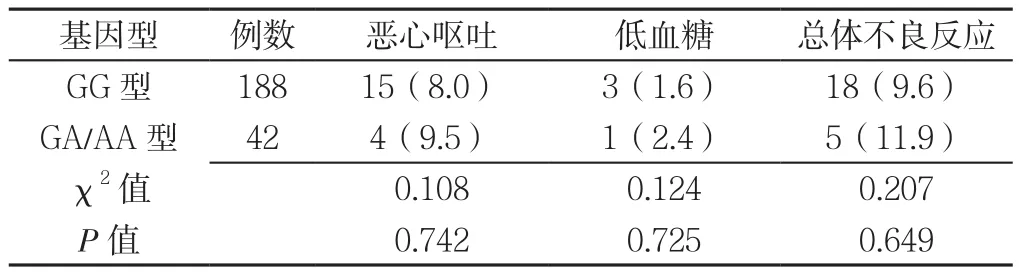
表3 1260G>A位点不同基因型T2DM患者不良反应发生率比较〔n(%)〕Table 3 Comparison of adverse reactions among T2DM patients with different CNR1 1260G>A genotypes
目前CNR1基因在T2DM及其并发症的发病机制和作用靶点仍然不完全清楚,但是越来越多的证据表明,CNR1系统失调与多种代谢性疾病有关,如肥胖、血脂异常、胰岛素抵抗和炎症,这些因素也是T2DM的危险因素[10-12]。据报道,CNR1基因中1260G>A位点的多态性与多种病理学相关,如代谢综合征等[12]、冠状动脉疾病[13]和克罗恩病[14]等。
本研究结果表明,利拉鲁肽治疗早期T2DM的治疗效果良好,治疗16周后各项指标与治疗前相比,差异存在统计学意义,且不良反应发生率较低。其中发现,治疗16周后各组基因型患者的各项指标与治疗前相比均下降。同时发现,治疗16周后GA/AA型患者的BMI、FPG和HbA1c水平低于GG型患者,表现出优于GG型的治疗效果。对于GA和AA型患者,GG型患者的mRNA相对表达明显较高。综上推断CNR1基因1260G>A位点多态性直接或间接与T2DM的治疗效果相关。其作用途径可能是由于内源性大麻素系统可以通过中枢和外周两种机制影响患者的摄食行为,过多的CNR1的表达,会直接增加患者的食欲,这从一方面也解释了GG型患者由于mRNA较高的表达量,影响治疗效果。同时携带A等位基因的患者在使用利拉鲁肽治疗后,会减轻对胰岛素的抵抗,随着代谢值的提高而减轻了更多的体质量,从而影响利拉鲁肽对T2DM治疗的临床效果,与相关研究结果基本一致[15]。此外,临床中应用利拉鲁肽改善T2DM合并肥胖存在其他多种机制[16],如:直接激活胰岛β细胞上的相关肽,促进胰岛素的分泌与合成;延长患者胃排空时间,控制患者食欲;抑制胰高血糖素的分泌,降低血糖水平等。已明确报道β细胞功能障碍和胰岛素分泌受损是导致T2DM患者出现慢性高血糖的关键因素,而不是由胰岛素抵抗所致。最新研究发现,利拉鲁肽可作用于p-AMPKα/NOX2/JNK1/2信号通路对抑制β细胞凋亡,从而改善患者的血糖水平[17-18]。同时,利拉鲁肽通过作用于线粒体ATP-钾等离子通道,对T2DM患者在治疗过程中减轻血管损伤,对抗动脉粥样硬化、降低心血管疾病风险起到保护作用,降低了不良反应的发生率[19]。
本研究通过对T2DM患者的基因型进行分析,发现CNR1基因1260G>A位点可能直接或间接与T2DM的遗传易感性相关,其GA/AA型可能通过影响该基因mRNA的表达影响利拉鲁肽对T2DM患者治疗的临床效果。当然,糖尿病及其并发症的发生取决于不同风险等位基因、环境因素和生活方式之间的相互作用,几个因素的相互作用可能导致低估或高估所研究多态性在确定表型中的作用[20]。本研究的数据只是本院的临床数据,可能在群体的代表性上存在一定的局限性,不适用于不同遗传或环境背景的人群,但为进一步研究CNR1基因1260G>A位点多态性对T2DM治疗效果的影响提供基础,并在临床预测中为药物治疗和药理学临床试验提供了可能的靶点。
利拉鲁肽在Ⅲ期临床试验中被证实可以有效降低糖尿病患者血糖水平,然而在临床应用过程中利拉鲁肽的降糖效果仍存在较大的个体差异。研究表明,基因多态性是造成众多药物出现个体差异的原因之一。本研究的结果表明CNR1基因1260G>A位点的GA/AA型可能通过影响该基因mRNA的表达进而影响利拉鲁肽对T2DM患者的疗效。
作者贡献:任丽君、宋瑞捧进行文章的构思与设计,对文章整体负责,监督管理;任丽君、王军杰、马豪莉进行研究的实施与可行性分析;任丽君、侯会娟进行数据收集及整理;任丽君、侯会娟、司马盼盼进行统计学处理;任丽君、侯会娟、司马盼盼、宋瑞捧进行结果的分析与解释;任丽君撰写论文;任丽君、司马盼盼进行论文的修订;宋瑞捧负责文章的质量控制及审校。
本文无利益冲突。

