肠内营养联合英夫利昔单抗治疗成人克罗恩病的随机对照研究
施嫣红, 汤茂春, 王俊珊, 孙明明, 翁 韵, 刘占举
(同济大学附属第十人民医院消化内科,上海 200072)
克罗恩病(Crohn’s disease, CD)是一种发生于口腔到肛门任何部位的慢性透壁性炎症,具有反复发作、难以治愈的特点,故常导致蛋白质-能量营养不足,表现为负氮平衡、低蛋白血症、体质量下降及贫血等[1]。儿童和青少年CD患者在诱导缓解中推荐首选肠内营养(enteral nutrition, EN)[2],而成人活动期CD在药物治疗无效或不耐受时,EN可作为替代治疗,且部分EN能够有效地延长克罗恩病的缓解期[3-4]。英夫利昔单抗(infliximab, IFX)是我国最早批准可用于治疗CD的生物制剂,是一种人鼠嵌合的抗肿瘤坏死因子抗体,其通过中和体内抗肿瘤坏死因子(TNF-α),进一步抑制肠道炎症反应。近年来EN联合药物治疗CD已越来越引起国内外研究者的重视,本研究使用EN联合IFX治疗CD患者,观察其临床疗效及营养状况,探讨联合用药的作用。
1 资料与方法
1.1 研究对象
收集2016年10月—2018年10月同济大学附属第十人民医院消化内科病房收治的92例CD患者,所有病例均经电子结肠镜及病理确诊,诊断符合《炎症性肠病诊断与治疗的共识意见(2012·广州)》中的标准[5]。纳入标准: (1) 年龄18~75岁;(2) 初发的轻-中度CD,无胃肠道梗阻症状;(3) 经营养风险筛查(NRS2002≥3分)评估为存在营养风险;(4) 女性患者无妊娠计划及严格避孕;(5) 未合并代谢性疾病。排除标准: (1) 心、肺、肝、脑或肾功能有明显异常者;(2) 具有严重药物过敏史,荨麻疹或其他过敏体质;(3) 有消化道大出血、肠穿孔及肠梗阻等肠内营养实施禁忌证者,高输出肠瘘、严重呕吐及顽固性腹泻者;(4) 有肠道手术史;(5) 依从性差或药物不耐受者;(6) 病情恶化者。
1.2 用药方法
将92例CD患者根据计算机产生随机数分为观察组46例和对照组46例,饮食为忌海鲜少渣饮食,按静息能量消耗(resting energy expenditure, REE): 30~35kcal/kg(125.6~146.5kJ/kg)给予能量。观察组: IFX为5mg/kg静脉滴注(第0、2、6周),口服雅培公司的肠内营养粉剂(商品名为安素)55.8g(6匙)加入200mL凉水,3~4次/d(能量3227.5~4303.7KJ)。对照组: IFX为5mg/kg静脉滴注(第0、2、6周)。疗程共12周。
1.3 观察内容
分别记录治疗前、治疗12周的血常规、红细胞沉降率(erythrocyte sedimentation rate, ESR)、C-反应蛋白(C-reactive protein, CRP) 、肝肾功能、大便常规及尿常规报告(检验科检测),记录体质量变化、CD活动指数(Crohn’s disease activity index, CDAI);分别于治疗前、治疗后12周测定炎症性肠病生存质量问卷(inflammatory bowel disease questi-onnaire of quality of life, IBDQ)[6],使用百利达MC- 980身体成分分析仪测定体质量指数(body mass index, BMI)、体质量、体脂肪量、体肌肉量、骨量及体水分量等,及时记录治疗不良反应。
1.4 疗效判断标准
疾病分型采用蒙特利尔分型(L1: 回肠末端,L2: 结肠,L3: 回结肠,B1: 非狭窄非穿透,B2: 狭窄,B3: 穿透,P为肛周病变),疾病活动度评判依据CDAI[7]。CDAI<150分定义为临床缓解,CDAI≥150分定义为临床活动,其中CDAI 221~450分为中度活动期,>450分为重度活动期[7]。比较两组患者的临床疗效,显效: CDAI较基线值下降>70分;有效: CDAI<150分;无效: CDAI升高>70分,总有效率=显效率+有效率[5,7]。比较两组患者治疗期间的生活质量、营养状况以及两组患者的不良反应发生率。
1.5 不良反应
记录用药过程中出现的任何不良事件情况及实验室指标(肝肾功能、血尿常规)有无变化,并进行药物相关性分析。
1.6 统计学处理
2 结 果
2.1 临床资料
入选的92例患者中治疗组有3例(观察组1例,对照组2例)因不能如期随访退出试验,最终完成试验共有89例患者。观察组45例(男性26例、女性19例),年龄18~56岁,平均年龄(32.2±10.3)岁;对照组44例,其中男性27例、女性17例,年龄18~54岁,平均年龄(31.2±11.0)岁。两组患者的年龄、性别、病变范围、疾病行为、肛周病变、BMI及CDAI之间比较差异无统计学意义(P>0.05),见表1。
表1 治疗前两组患者一般资料比较
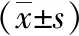
参数观察组(n=45)对照组(n=44)χ2P年龄/岁32.2±10.331.2±11.0>0.05性别 男26270.119>0.05 女1917病变范围 L1108 L222230.233>0.05 L31313疾病行为 B14242 B2320.189>0.05 B300肛周病变P340.18>0.05BMI/(kg·m-2)15.9±4.315.2±3.7>0.05CDAI237.8±43.4230.9±51.9>0.05
2.2 两组患者治疗前后疾病活动指数、炎症指数及IBDQ比较
治疗前两组CDAI评分比较差异无统计学意义(P>0.05),见表1。治疗12周后观察组及对照组的CDAI评分均较治疗前均明显降低[(237.8±43.4)vs(164.3±21.4)分;(230.9±51.9)vs(178.2±18.9)分,均P<0.05],而观察组CDAI评分较对照组降低更显著[(164.3±21.4)vs(178.2±18.9)分,P<0.05],见图1。治疗前两组CRP、ESR差异无统计学意义[(37.9±22.3)vs(35.6±27.9) mg/L;(38.7±15.1)vs(36.8±17.2) mm/h,均P>0.05],治疗12周后观察组及对照组的CRP、ESR均较治疗前明显降低,观察组的数值明显低于对照组[(12.5±9.2)vs(18.6±7.3) mg/L,(13.3± 11.2)vs(19.4±10.5) mm/h,均P<0.05]。治疗前两组IBDQ评分比较差异无统计学意义[(132.4±15.1)vs(136.8±17.2),P>0.05],但治疗12周后,观察组IBDQ评分较治疗前明显升高[(155.3±20.7)vs(132.4±15.1)分,P<0.05],而对照组虽有升高,但差异无统计学意义[(143.2±19.8)vs(136.8±17.2)分,P>0.05)],见图1。
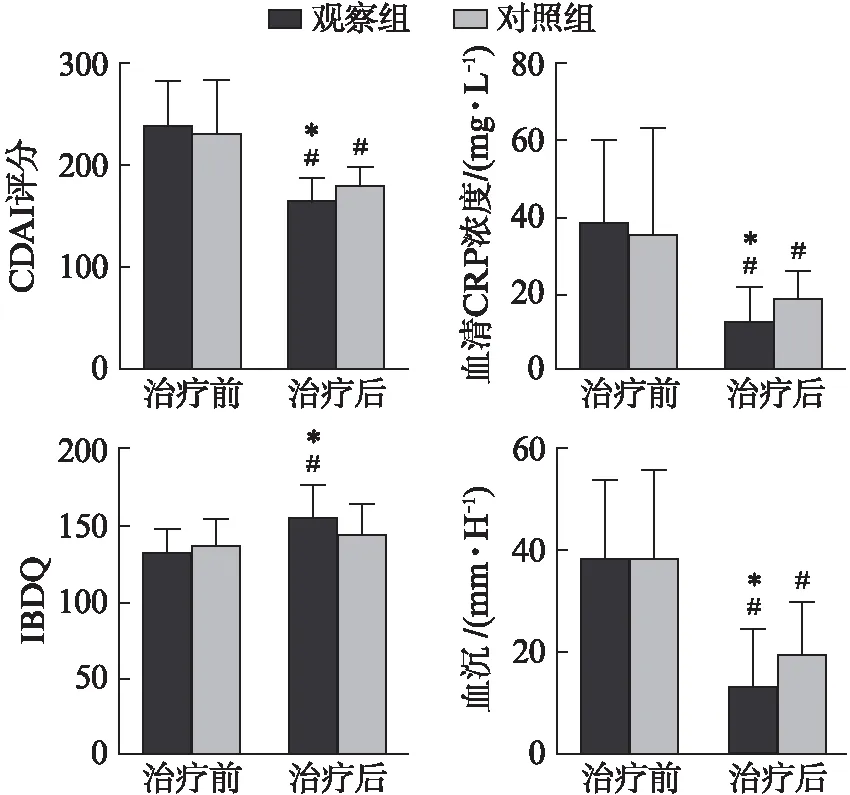
图1 两组患者治疗前后各项指标比较Fig.1 The difference of the indexes in the two groups before and after treatment与治疗前比较,#P<0.05;与对照组比较,*P<0.05
2.3 两组患者治疗前后的BMI及血清营养指数比较
治疗前两组BMI评分比较差异无统计学意义(P>0.05),见表1。治疗12周后,观察组BMI评分较治疗前明显升高[(19.4±5.5)vs(15.9±4.3) kg/m2,P<0.05],而对照组虽有升高趋势,但差异无统计学意义[(16.8±4.0)vs(15.2±3.7) kg/m2,P>0.05]。观察组和对照组患者治疗前的白蛋白、前白蛋白及血红蛋白差异无统计学意义[(28.3±9.4)vs(30.4±10.9) g/L,(58.9±17.0)vs(60.7±19.7) mg/L,(100.1±12.8)vs(97.2±15.3) g/L,均P>0.05],治疗12周后观察组的白蛋白、前白蛋白及血红蛋白分别为(39.8±14.8) g/L、(93.2±19.1) mg/L和(115.3±20.2) g/L,均高于治疗前(P<0.05)。对照组治疗后的前白蛋白为(72.7±17.0)mg/L,也高于治疗前(P<0.05),但其白蛋白及血红蛋白虽有所上升,分别为(34.2±11.2) g/L、(102.4±27.9) g/L,但与治疗前比较差异无统计学意义(P>0.05),见图2。
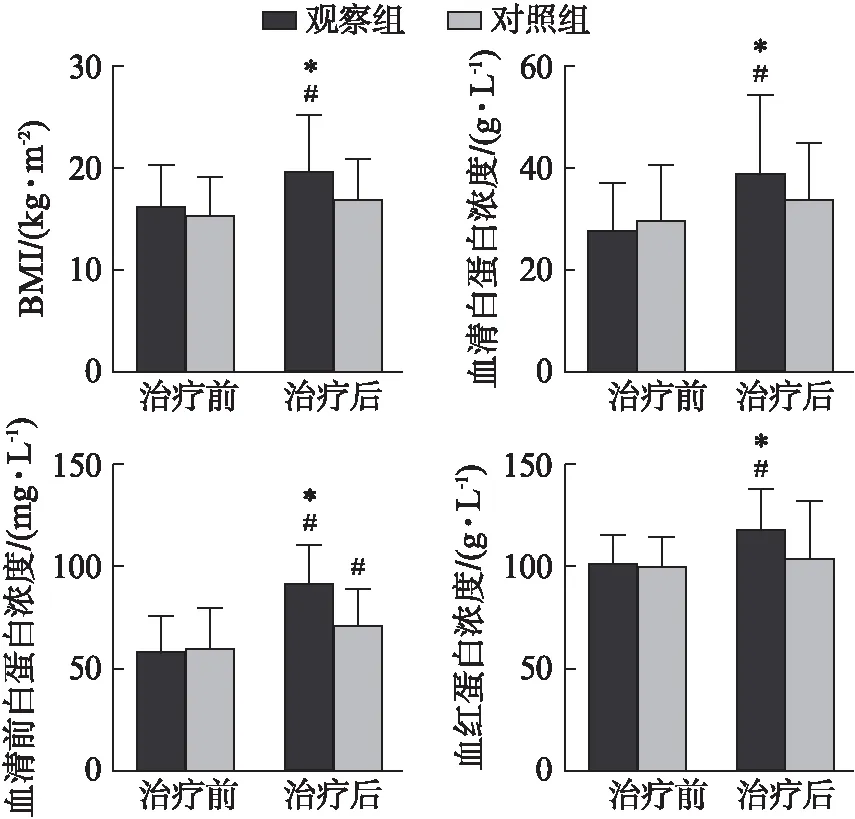
图2 两组患者治疗前后各项指标比较Fig.2 The difference of the indexes in the two groups before and after treatment与治疗前比较,#P<0.05;与对照组比较,*P<0.05
2.4 两组患者治疗前后的人体成分分析
治疗前观察组与对照组患者的体质量、体脂肪量、体肌肉量、骨量及体水分量差异无统计学意义(P>0.05),治疗12周后,观察组的体质量、体脂肪量及体肌肉量均较治疗前明显增加(P<0.05),而骨量及体水分量虽有增加趋势,但差异无统计学意义(P>0.05)。对照组经治疗后的体质量、体脂肪量、体肌肉量、骨量及体水分量均增加,但与治疗前比较差异无统计学意义(P>0.05),见表2。
2.5 两组患者临床疗效比较
两组患者经过12周治疗后,观察组患者显效22例(48.9%),有效15例(33.3%),无效8例(17.8%),总有效率为88.2%(37/45);而对照组患者显效17例(38.6%),有效11例(25.0%),无效16例(36.4%),总有效率为63.6%(28/44),见表3。观察组患者的总有效率高于对照组(P<0.05)。
表2 两组患者治疗前后的人体成分比较
参数对照组(n=44)观察组(n=45)体质量/kg0周50.8±15.952.7±10.412周53.3±15.461.6±15.2#∗体脂肪量/kg0周9.2±5.710.3±8.012周10.1±2.714.2±4.2#∗体肌肉量/kg0周37.2±13.338.3±11.812周38.4±16.344.7±12.1#∗骨量/kg0周2.3±0.92.2±1.112周2.3±1.02.3±0.7体水分量/kg0周25.0±10.825.7±13.712周26.2±10.530.8±12.7
与治疗前比较,#P<0.05;与对照组比较,*P<0.05
表3 两组患者治疗12周后综合疗效比较
2.6 两组患者不良反应的比较
两组患者经过12周治疗,均有不良反应发生,分别为观察组6.7%(3/45)、对照组6.8%(3/44),差异无统计学意义(P>0.05),见表4。治疗期间患者均未出现肝肾功能异常及心电图异常等不良反应。
表4 两组患者治疗后的不良反应比较
经χ2检验,P>0.05
3 讨 论
炎症性肠病(inflammatory bowel disease, IBD)患者发生营养不良常见于胃肠道炎症导致营养物质消耗丢失,吸收减少;疾病本身影响患者食欲,引起摄入减少及不平衡;并发症的发生(如狭窄、瘘管、肛周病变等)也增加了患者发生营养不良的风险。营养不良的出现不仅影响药物的疗效,增加了患者住院的风险,同时也增加了感染、静脉血栓、急诊手术和死亡的风险[8-10]。
传统治疗IBD的药物应答率仍然不理想,而且CD患者常合并营养不良,提示营养因素可能参与了CD的发病,所以单凭药物治疗无法有效、快速改善蛋白质-能量的营养不足。因此,营养支持治疗非常重要[11],国际上遵循只要肠道有功能,即使是部分功能,就应该使用肠道的原则,首选EN[12],因此,早在2006年,欧洲肠外肠内营养学会(ESPEN)指南中就提出,EN改善成人营养状态的同时还可减轻CD患者的炎症反应,因此推荐EN作为传统药物治疗的补充疗法,并可贯穿活动期及缓解期[13]。全肠内营养(exclusive enteral nutrition, EEN)是诱导CD缓解的一种高效治疗方法,被广泛应用于儿童CD患者,作为一线治疗方案,缓解率高达60%~80%[14-15]。在成人CD中,因依从性、耐受性原因(主要与成人留置鼻胃管以及营养配方口感差有关)常导致EEN治疗失败[16-17],因此常将皮质类固醇或生物制剂作为成人一线治疗药物[12],尽管如此,研究表明,部分CD患者对EEN反应良好,可用于有效和安全地诱导缓解[12,18],而且新诊断的IBD患者对营养治疗的应答比长期肠道炎症患者更好[19]。Lee等[20]的研究表明,部分肠内营养(partial enteral nutrition, PEN)治疗活动期CD,64%的患者达到临床缓解,EEN治疗缓解率为88%,抗TNF-α治疗为84%。国外另一项研究还发现,在儿童和成人中,使用特定饮食的PEN能70%地诱导疾病缓解[21]。
本研究选取的活动期CD患者采用PEN的方法,即口服整蛋白型肠内营养粉剂——安素,其具有口感好、营养全面、少渣及易消化吸收的特点,每天3~4杯(3227.5~4303.7kJ),>2510.4kJ/d,辅以忌海鲜少渣软食,避免了患者留置鼻胃管的不便及营养制剂口感差的问题,患者耐受性及依从性好。另外联合了IFX使用,IFX是人鼠嵌合体IgG1单克隆抗体,是一种TNF-α的药物,常用于中重度CD患者和对糖皮质激素治疗依赖、失败或不耐受的患者以及免疫抑制剂治疗失败或不耐受患者[22]。研究发现,两组经治疗后,观察组患者总有效率显著高于对照组。两组CDAI评分、CRP、ESR水平与治疗前比较显著降低,而且观察组数值较对照组降低更显著,其机制可能与EN提供肠黏膜上皮细胞营养的同时改善了肠黏膜屏障,促进肠黏膜修复,下调肠道炎症反应,减少肠道细菌引起的炎症瀑布现象[23-24]等相关,能有效降低患者疾病活动指数,缓解临床症状。
经治疗后两组的白蛋白、前白蛋白及HB均有上升趋势以及人体成分仪检测的两组体质量、体脂肪量、体肌肉量在治疗后也均有升高,但观察组的指标显著高于治疗前及对照组治疗后的指标,表明EN的给予一方面减少了食物对胃肠道的刺激,使肠道得到休息,另一方面可有效调节体内营养物质代谢,促进蛋白质、脂肪等的合成,快速改善患者的营养状态[25]。同时观察组BMI、IBDQ评分在治疗后明显升高,与对照组比较差异显著,提示EN纠正患者营养不良,提高了患者的BMI,同时也提高患者的生活质量。而两组不良反应发生率无差别。
EN治疗不仅可以提供充足、全面的营养,维持机体所需的能量,还有助于抑制肠道炎症、促进肠黏膜组织的愈合,本研究表明营养支持治疗联合药物治疗能更有效改善患者营养状况,提高临床疗效。但本研究选取的样本量较少,有待以后开展大样本的随机对照研究及基础研究。

