川陕金莲花黄色素提取工艺优化及稳定性与抗氧化性的研究
卢佳云,陈炼红,王琳琳,张岩
(西南民族大学 生命科学与技术学院,成都 610041)
川陕金莲花(TrolliusbuddaeSchipcz.),又名金梅草、旱金莲、骆驼七(陕西),是毛莨科金莲花属的植物, 分布于四川北部、甘肃南部及陕西南部。其味辛辣,嫩梢、花蕾、新鲜种子可作为食品调味料。绿色种荚可腌制泡菜,脆嫩可口,微辣甘甜。未熟的叶有辛辣味,作香辛料使用或用于泡菜[1];可药用,有活血、破血的功效[2]。据《中药大辞典》记载,金莲花具有一定的清热解毒功效,可以用于治疗上呼吸道感染、扁桃体炎和咽炎等疾病。其味苦清泄,性寒清热,毒性小,副作用少,因此广泛应用于临床治疗[3]。川陕金莲花黄色素的主要成分为黄酮类化合物,而黄酮类化合物具有很好的溶解特性,既有水溶性的黄酮类化合物,又有脂溶性的黄酮类化合物,所以,川陕金莲花黄色素作为着色剂可以满足食品加工的需要[4]。抗氧化剂对于改善人体衰老、癌症等具有一定的效果,目前国内对川陕金莲花的研究多见于成分分析和药理活性研究,而对金莲花黄色素的提取工艺和食用价值的研究少见报道[5-7]。本试验对川陕金莲花黄色素的提取工艺进行了研究,对其稳定性和抗氧化活性进行了评价,可以为川陕金莲花黄色素的利用提供理论依据,还可利用其叶子的辣味,开发出具有金莲花特色的功能性食品。
1 材料与方法
1.1 材料与仪器
川陕金莲花:购自甘肃省甘南藏族自治州合作市;无水乙醇、氯仿、丙酮、石油醚、氯化钙、氯化镁、氯化铝、氯化钾、抗坏血酸、山梨酸钾、硫酸亚铁、水杨酸、DPPH、过氧化氢:均为分析纯,成都市科龙化工试剂厂;蔗糖:成都市糖酒有限责任公司;食盐:四川久大制盐有限责任公司。
RE-52AA旋转蒸发器 上海亚荣生化仪器厂;FW100 高速万能粉碎机 北京中兴伟业仪器有限公司;UV-1000 型紫外分光光度计 上海美谱达仪器有限公司;5804R 离心机 德国Eppendorf公司。
1.2 试验方法
1.2.1 川陕金莲花黄色素提取工艺
干燥的川陕金莲花经粉碎机粉碎,按一定的料液比加入不同浸提剂,在一定的提取温度、时间条件下进行提取,经过滤、离心后,取上清液,将离心后取得的上清液在60 ℃下蒸发3~4 h,得到川陕金莲花黄色素的提取液,测定溶液的吸光度。
1.2.2 川陕金莲花光谱特性的确定
将0.01 g/mL的色素溶液用紫外-可见光分光光度仪在波长350~550 nm范围内测定其吸光值,测得最大吸收波长为450 nm[8]。
1.2.3 川陕金莲花黄色素提取条件的正交试验
通过单因素试验观察其对色素提取的影响,在此基础上,采用正交试验对川陕金莲花黄色素的提取工艺进行优化,并利用 Excel软件进行数据处理与分析。正交试验因素与水平见表1。

表1 正交试验因素与水平Table 1 The factors and levels of orthogonal test
1.3 色素的稳定性
1.3.1 温度对川陕金莲花黄色素稳定性的影响
采取最优组合提取色素后,取5 mL色素提取液,用蒸馏水定容至50 mL,取稀释好的色素置于不同温度的恒温水浴锅中,水浴3 h后取出,迅速冷却至室温,在波长450 nm处测其吸光值。
1.3.2 食品添加剂对川陕金莲花黄色素稳定性的影响
采取最优组合提取色素后,取5 mL色素提取液,用不同浓度的食品添加剂(食盐、蔗糖、山梨酸钾等)溶液定容至50 mL,以同浓度的食品添加剂溶液作为参比,在室温下静置,每隔一段时间,在波长450 nm处测定其吸光度。
1.3.3 还原剂(抗坏血酸)对川陕金莲花黄色素稳定性的影响
采取最优组合提取色素后,取5 mL色素提取液,用不同浓度的抗坏血酸溶液将其定容至50 mL,用相对应的抗坏血酸溶液作为参比,在室温下静置,每隔一段时间,在波长450 nm处测定其吸光度。
1.3.4 金属离子对川陕金莲花黄色素稳定性的影响
采取最优组合提取色素后,分别取5 mL色素提取液,用浓度为0.1%的不同金属离子溶液定容至50 mL,用相对应的金属离子溶液作为参比,在室温下静置,每隔一段时间,在波长450 nm处测定其吸光度。
1.4 川陕金莲花黄色素的抗氧化活性试验
运用体外抗氧化活性研究的方法,测定川陕金莲花黄色素对·OH和DPPH·的清除能力,并与相同浓度抗坏血酸的清除能力相对比,以此来评价川陕金莲花黄色素的抗氧化活性[9,10]。
1.4.1 川陕金莲花黄色素对·OH清除能力的测定[11]
将川陕金莲花黄色素浓缩液用超纯水稀释,配制成浓度为10,15,20,25 mg/mL的色素溶液,同时配制相同浓度的抗坏血酸溶液;取9份1 mL 9×10-3mol/L FeSO4,1 mL 9×10-3mol/L水杨酸加入已标记的试管中,摇匀,分别加入2 mL不同浓度的色素溶液及抗坏血酸溶液,空白组加入等量H2O,最后加入1 mL 8.8×10-3mol/L H2O2启动反应,振荡、摇匀后避光静置30 min;用H2O代替H2O2溶液的本底作为参比在510 nm处测定吸光度值。
式中:W为·OH自由基的清除率;A0为空白组的吸光度;Ax为试验组的吸光度;Ax0为参比的吸光度。
1.4.2 川陕金莲花黄色素对DPPH·清除能力的测定[12]
用超纯水稀释色素浓缩液,配制成浓度为10,15,20,25 mg/mL的色素溶液,同时配制相同浓度的抗坏血酸溶液;取9份2 mL 0.2×10-3mol/L DPPH·溶液(无水乙醇配制)加入标记好的试管中,再分别加入2 mL不同浓度的色素溶液和抗坏血酸溶液,空白组加入等量H2O;常温下避光反应30 min,然后以无水乙醇代替DPPH·溶液的本底作为参比,测定其在517 nm下的吸光度值。
式中:W为DPPH·自由基的清除率;A0为空白组的吸光度;Ax为试验组的吸光度;Ax0为参比的吸光度。
1.5 数据处理
为尽可能减小试验数据误差, 对每个试验做3次平行试验, 通过Excel软件进行数据处理, 采用测定数值的平均值进行结果分析和作图。
2 试验结果与分析
2.1 单因素试验
2.1.1 提取溶剂的筛选
准确称取0.5 g川陕金莲花粉末5份,分别用等量的水、95%乙醇、丙酮、氯仿、石油醚等以料液比1∶5 (m/V)浸提1 h,观察颜色。结果表明,色素在丙酮、氯仿和石油醚中溶解性较差,在水和乙醇溶液中溶解度较好,本试验选择水作为最佳浸提溶剂,省去了其他物质对色素的影响。
2.1.2 料液比对川陕金莲花黄色素提取的影响
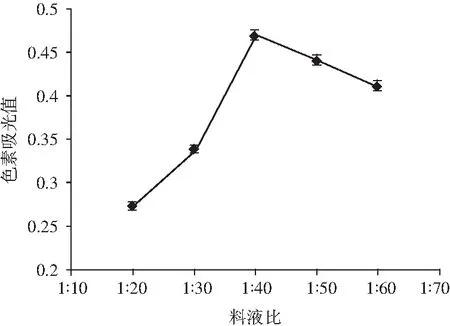
图1 不同料液比对川陕金莲花黄色素吸光度的影响Fig.1 Effect of solid-liquid ratio on absorbance of Trollius buddae Schipcz.yellow pigment
由图1可知,色素吸光值随料液比的增加呈先增大后降低的趋势,料液比在1∶40时,色素吸光值达到最大值,之后随料液比的增大而下降。这是由于在一定范围内增加浸提液体积可以增大溶剂与浸提物的接触面积,使水溶性的色素能够较多溶出,但浸提液体积继续增大会使色素的溶出达到饱和,吸光值趋于平稳或稍有降低。考虑到浸提液体积过大会增加提取时间,浸提液体积过小又会使色素提取不完全而浪费原料,所以,选择料液比在1∶40左右最为合适。
2.1.3 提取温度川陕金莲花黄色素提取的影响

图2 不同提取温度对川陕金莲花黄色素吸光度的影响Fig.2 Effect of extraction temperature on absorbance of Trollius buddae Schipcz. yellow pigment
温度对植物成分的提取影响很大[13]。由图2可知,当温度为60 ℃时,色素提取液的吸光度相对最高,为0.792;当温度为70 ℃时,色素提取液的吸光度下降3.6%。随着温度逐渐升高,川陕金莲花黄色素的提取速率加快,吸光值越高;但温度过高会使色素的结构发生变化,色素变性速率大于色素的浸出速率时,吸光值降低,逐渐趋于较低水平。
2.1.4 提取时间对川陕金莲花黄色素提取的影响
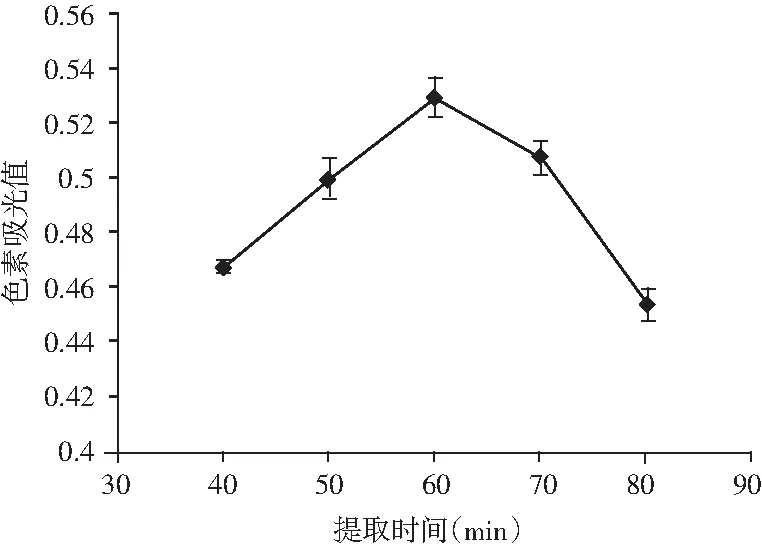
图3 不同提取时间对川陕金莲花黄色素吸光度的影响Fig.3 Effect of extraction time on absorbance of Trollius buddae Schipcz. yellow pigment
由图3可知,当浸提时间为 60 min时,浸提液的吸光值达到最大值,之后随着浸提时间的延长,浸提液的吸光值减小,有可能是因为浸提温度较高,长时间的浸提破坏了川陕金莲花黄色素的结构,使浸提液的吸光值降低。因此,适宜的提取时间为60 min。
2.2 正交试验
由表2可知,该色素提取最佳工艺参数为A1B3C1,与试验结果中吸光值最高的第6试验组A2B3C1不相符,因此需要验证试验A1B3C1和试验A2B3C1。
验证试验结果:A1B3C1组的吸光值为0.479,A2B3C1组的吸光值为0.546,即A2B3C1组优于A1B3C1组。因此可得川陕金莲花黄色素提取最佳工艺参数为:料液比1∶50(g/mL),提取温度50 ℃,提取时间60 min。
2.3 稳定性试验
2.3.1 不同温度对川陕金莲花黄色素稳定性的影响

表3 不同温度环境下川陕金莲花黄色素吸光值的变化Table 3 The variance in absorbance of Trollius buddae Schipcz. yellow pigment at different temperature conditions
由表3可知,在100 ℃以下的温度条件下,川陕金莲花黄色素的颜色不变,吸光值变化较小,说明温度对川陕金莲花黄色素的影响较小。
2.3.2 食品添加剂对川陕金莲花黄色素稳定性的影响

表4 食品添加剂对川陕金莲花黄色素的影响Table 4 The effect of food additives on Trollius buddae Schipcz. yellow pigment

续 表
由表4可知,食盐对川陕金莲花黄色素有减色作用,随着时间延长,变化不大,但是随着食盐浓度增加,减色作用有轻微改善,可以与色素混合使用;蔗糖和山梨酸钾对川陕金莲花黄色素有一定的增色作用,且随着时间和浓度的增加,增色作用逐渐上升,对色素原有色泽破坏较大,可能会影响其色素本身的味道[14]。
2.3.3 还原剂(抗坏血酸)对川陕金莲花黄色素稳定性的影响
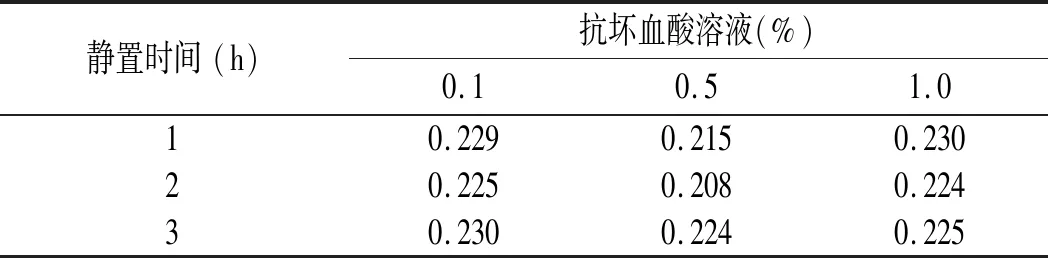
表5 不同浓度抗坏血酸溶液及静置时间下川陕金莲花黄色素吸光度的变化Table 5 The variance in absorbance of Trollius buddae Schipcz. yellow pigment in different concentration of ascorbic acids and standing time
由表5可知,在抗坏血酸溶液中,随着浓度和时间的增加,对川陕金莲花黄色素的影响不大。说明抗坏血酸对川陕金莲花黄色素的干扰性较小,可以用于以抗坏血酸为抗氧化剂的食品生产加工中。
2.3.4 金属离子对川陕金莲花黄色素稳定性的影响
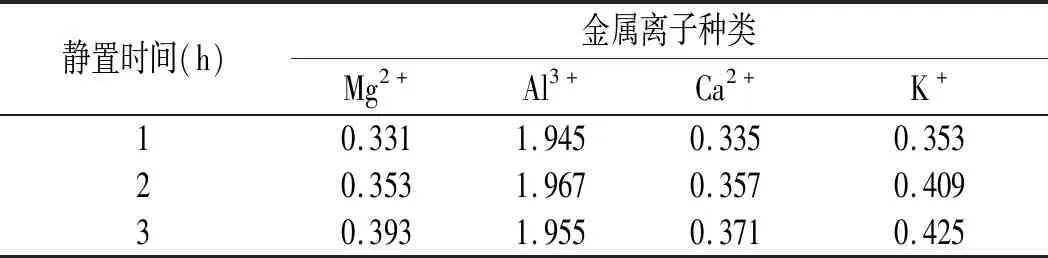
表6 不同金属离子及静置时间下川陕金莲花黄色素吸光度的变化Table 6 The variance in absorbance of Trollius buddae Schipcz. yellow pigment in different metal ion solutions and standing time
由表6可知,在Mg2+、Ca2+、K+溶液中,随着静置时间的延长,对川陕金莲花黄色素的增色效果逐渐增大;在Al3+溶液中,增色作用远高于其他3种金属离子溶液,溶液颜色明显加深,因此在储存和使用川陕金莲花黄色素时,应该避免与Al3+接触。金属离子对色素有一定的影响可能是色素分子与金属离子形成了螯合物或金属离子溶液本身的色泽导致的。川陕金莲花黄色素要避免与金属包装接触,以免影响其调味效果及色泽。
2.4 抗氧化性试验结果
2.4.1 川陕金莲花黄色素对·OH的清除能力

图4 川陕金莲花黄色素对·OH的清除能力Fig.4 The scavenging ability of Trollius buddae Schipcz.yellow pigment on·OH
由图4可知,川陕金莲花黄色素对·OH具有一定的清除效果,浓度越高,对·OH的清除率越大,且清除率的上升速度越迅速。但相同浓度抗坏血酸对羟自由基的清除率远高于川陕金莲花黄色素。结果表明,川陕金莲花黄色素具有一定去除羟自由基的能力且浓度越高,清除率越大,但效果低于同样浓度下的抗坏血酸。
2.4.2 川陕金莲花黄色素对DPPH·自由基的清除能力

图5 川陕金莲花黄色素对DPPH·的清除能力Fig.5 The scavenging ability of Trollius buddae Schipcz. yellow pigment on DPPH·
抗氧化性物质加入到DPPH·自由基醇溶液中,会发生颜色变化的反应,通过吸光值的变化,进而判断其清除能力[15]。由图5可知川陕金莲花黄色素对DPPH·的清除能力,以VC作对照,在浓度低于20 mg/mL时,川陕金莲花黄色素对DPPH·的清除作用随着色素浓度的增加呈递增趋势;大于20 mg/mL后,趋势变小,色素清除DPPH·的能力趋于稳定;色素浓度为25 mg/mL时清除作用达到最大值71.7%,结果表明,川陕金莲花色素具有较好的清除DPPH·的作用。川陕金莲花黄色素在食品的应用方面有较大的开发潜力。
3 结论
正交试验优化提取工艺结果表明,川陕金莲花黄色素的最佳提取条件为:蒸馏水、料液比1∶50(g/mL)、提取温度50 ℃、提取时间60 min,这时川陕金莲花黄色素的吸光值为0.546±0.0036。该色素属水溶性色素,耐热性强,除 Al3+外,其余金属离子对色素影响不大,在还原剂下有较好的稳定性,食盐对其有减色作用,蔗糖和山梨酸钾添加剂有一定的增色作用。在一定浓度范围内, 川陕金莲花黄色素都有较好的稳定性,DPPH·、·OH的最大清除率分别为71.7%和35.7%,但低于VC。川陕金莲花黄色素具有较好的稳定性和较强的抗氧化性,作为添加剂可对食品提供改善色泽和延长货架期的作用。金莲花作为调料在大部分食品加工过程中可以保持独特的原味。因此,川陕金莲花黄色素在具体应用中应在常温、干燥条件下进行,但在储藏过程中避免与金属类物质接触。优化的川陕金莲花黄色素提取工艺合理、可行,这为川陕金莲花色素的提取及应用提供理论参考。

