会同成熟杉木器官C∶N∶P生态化学计量的动态特征
王瑞禛,罗丽莹,孙嘉伟,顾红波,王光军
(1.中南林业科技大学,湖南 长沙 410004;2.中地博科(湖北)生态环境科技有限责任公司,湖北 武汉 430070)
生态化学计量学通过研究植物生态过程中化学元素的比例,分析植物生态过程中碳氮磷化学元素的平衡关系,这为探索其生态系统过程中营养元素间耦合关系,提供了研究方法[1]。植物器官的生态化学计量学特征反映了植物器官之间的内稳性及相互关系,内稳态是植物生长中相对活跃的器官,对维持营养水平需要,保证光能反应物质生产及能量利用效率[2],植物叶片就是通过光合作用固定C的过程中需要酶(N)的催化,酶的合成需要复制大量的RNA(P),体现出三种元素之间的耦合作用[3],因此植物器官C、N、P含量及其化学计量比不但能反映其营养利用效率,而且反映其生存环境的相对养分限制[4],通过对植物器官的研究可以分析植物的内稳性。植物生长环境中的养分含量也会影响植物中养分元素的含量,这对判断植物器官在养分利用效率、生长速率、碳氮磷的限制性具有重要的指导作用[5-6]。Han 等[7]研究中发现中国植物叶片N∶P 高于全球平均水平,表现出严重的P 限制。C∶N和C∶P 不但能够表征植物同化C 素,吸收N和P元素,而且N∶P 还反映植物营养需求与土壤环境中营养间的动态平衡[8,9]。对华北落叶松细根的生态化学计量特征的研究表明,细根具有更大的吸收表面积和生理活性,其生长和周转速率高,对树木养分循环具有重要作用,对整个生态系统中养分动态维持具有重要的作用[10]。在植物的生长过程中,N∶P <14 表现为N 限制,N:P>16为P 限制,14 <N∶P <16,为N、P 共同限制[11];和全球植物叶片的平均水平为12.7 相比,我国的平均水平为16.3,普遍表现为磷限制[12]。
杉木Cunninghamia lanceolata作为我国生长快、经济价值高的速生用材树种,对我国南方人工林培育具有重要地位。运用生态化学计量学方法,国内开展了造林密度对杉木人工林生态系统养分元素分配格局[13],杉木器官间C、N、P 化学计量比的异速生长关系[14]等方面研究。随着国家对木材战略安全问题的关注,培育大径材成为我国对杉木研究关注的热点。为探讨成熟杉木林生长逐渐缓慢的原因,本研究通过对湖南会同30年成熟杉木林植物器官生态化学计量的季节动态特征进行研究,旨在探讨植物器官在不同季节养分元素的变化情况及器官之间的相关关系,揭示成熟杉木林养分元素的变化规律以及与环境相关关系,对杉木人工林经营培育具有指导意义,为有效提高杉木人工林大径材的生产力提供理论支撑。
1 材料与方法
1.1 研究地概况
本研究试验样地选取在中南林业科技大学湖南会同杉木林国家重点野外科学观测研究站的Ⅲ号集水区。地理坐标为109°45′27″E,26°47′12″N,海拔高度为300~430 m 之间,该区域属中亚热带季风湿润气候区,地带性植属中亚热带常绿阔叶林。年平均气温16.8℃,降水充沛,年均降水量1 100~1 400 mm,无霜期长,严寒较短,光能较充足,冬季偏少。土壤为震旦纪板溪系灰绿色板岩发育的山地黄壤,介于中壤与中粘壤之间,pH 值为4.86。
Ⅲ号集水区是1987年炼山整地后种植的杉木纯林,1988年春季种植的杉木纯林,经营管理过程中无人工施肥,现为30年生成熟杉木人工纯林,乔木层全部为杉木,林下灌木、草本植物很少,仅有少量的冬青Ilex purpurea、油桐Vernicia fordii、菝葜Smilax china、杜茎山Myrsinaceae、铁线蕨Adiantum capillus-veneris、铁笀箕Dicranopteris linearis、桃金娘Rhodomyrtus tomentosa、狗脊蕨Woodwardia japonica、华南毛蕨Cyclosorus parasiticus等。Ⅲ号集水区样地中杉木林分的单位面积密度为1 504株/hm2,森林郁闭度达到0.8 以上,林木平均胸径为21.4±1.6 cm,平均树高为13.4±2.3 m,地面凋落物量410.6±60.2 g.m-2,样地土壤理化性质特征见表1。
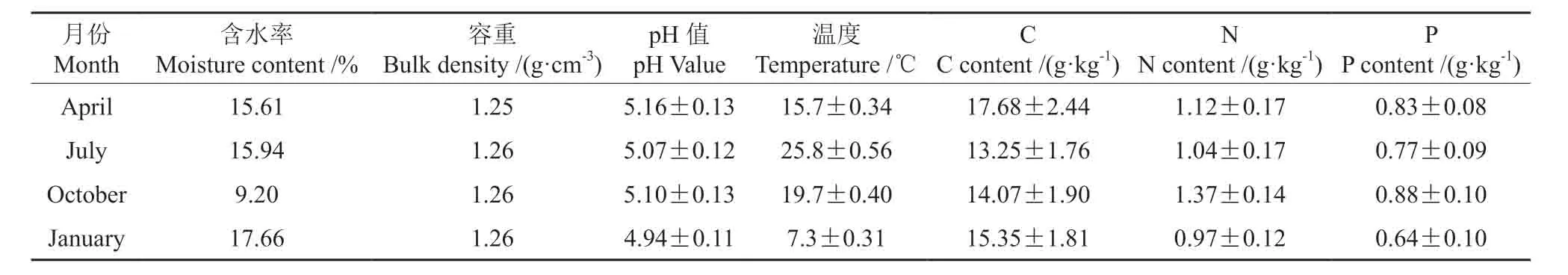
表1 样地土壤理化性质Table1 The physical and chemistry properties of soil
1.2 实验设计与样品采集
在会同生态站Ⅲ号集水区内沿着在上坡、中坡和下坡,分别各设置3 块20 m×20 m的方形样地,每块样地面积为400 m2,共计9 块。每块样地按照“之”字型,均匀选择6株杉木,采样时间分别于2016年4月、7月、10月以及2017年1月进行。
1.3 采样与测定方法
利用树高测量仪LD6172 测量样地内的树高,用胸径尺测量每棵树的胸径,用ProCheck 手持式多功能读表测量土壤温度和湿度。每株杉木上各采集树叶和树枝样品300 g 左右,同时在树木基部1 m的范围内,向下挖取50 cm 范围内采集杉木细根(直径≤2 mm)100 g,分别装入布袋后带回实验室。在每块样地中选择有代表性的部位挖取1个土壤剖面,收集0~15 cm、15~30 cm 及30~50 cm 深度的土壤混合样各300 g,装入自封袋并做好标记。
在实验室分别用烘箱将叶、枝、根样品在65℃ 下烘干至恒重,并称量记录、然后用要植物粉碎机粉碎过筛,装入封闭容器备用;土壤样品过 2 mm 筛后自然风干。用土壤粉碎机磨碎,过 0.2 mm 筛,放于封闭容器备用。分别测定杉木不同器官和土壤的C、N、P 元素含量。
植物、土壤样品中有机碳采用重铬酸钾外加热法测定,全氮采用凯氏定氮法测定,全磷采用硝酸-高氯酸消煮-钼锑抗分光光度法测定[11-12]。
1.4 数据处理
用Excel 2010 对数据进行整理,用SPSS 19.0单因素方差分析检验C、N、P含量及其化学计量比的差异显著性,用变异系数(CV)来衡量不同器官中碳氮磷生态化学计量比的内稳性,采用Pearson 分析器官间的各指标间相关性,柱状图用SigmaPlot1 2.5 绘制,CCA 约束性排序图用Canoco 4.5 绘制。
2 结果与分析
2.1 不同器官C、N、P 化学计量比及变异系数
杉木不同器官的C、N、P含量和化学计量比及其变异系数如表3所示。在不同器官间,C含量差异最小,差异性没有达到显著(P>0.05),N、P 含量均为叶最高、细根最低,器官N、P 含量之间差异性都达到了显著(P<0.05)。C∶N、C∶P、N∶P 均表现为细根最大,叶最小,叶、枝、根的C∶N、C∶P 之间差异性都达到了显著(P<0.05),但由于叶P含量明显高于枝和根,叶与枝、根的N∶P之间具有显著差异性(P<0.05),枝、根之间N∶P则差异性不显著(P>0.05)。其叶、枝、细根的C∶N∶P 分别为222∶5∶1、302∶6∶1、426∶7∶1。C含量的变异系数相对N、P 含量较低,且在叶、枝、根器官之间基本保持稳定。N、P 含量的变异系数为叶最小,C∶N、C∶P的变异系数均为枝最小,N∶P的变异系数为根最小。
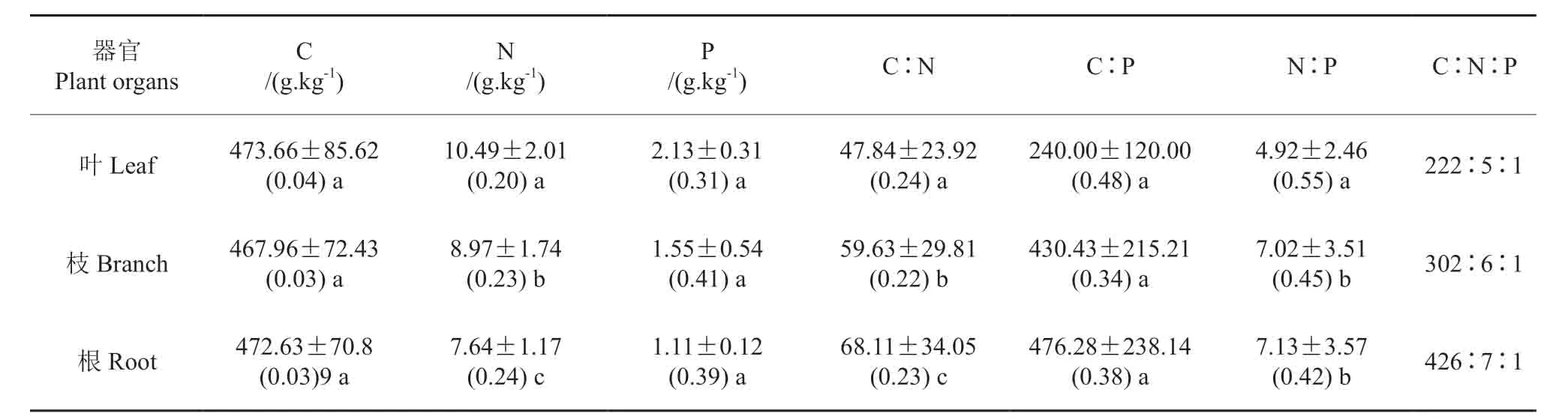
表2 杉木叶、枝、根C、N、P生态化学计量学的年均值及其变异系数†Table2 Average value of C,N,P contents and stoichiometry of different organs at Cunninghamia lanceolata
2.2 叶、枝、根C、N、P生态化学计量的季节动态
杉木叶、枝、根的C、N、P含量呈现显著季节动态特征(P<0.05,见图1),杉木叶、枝、根的化学计量比的季节动态特征,从4月份到第二年1月份,叶的C:N 值呈现为逐渐降低的变化趋势,枝表现为先升高后降低的变化趋势,根表现为先降低后升高的变化趋势。C∶P 值在叶中表现为1月份、4月份相对较高,7月份、10月份相对较低;枝中表现为逐渐降低的变化趋势;根中表现为4月份、10月份相对较高,1月份、7月份相对较低。N∶P值在叶中呈现为相对稳定的变化趋势;在枝中呈现为逐渐降低的变化趋势;在根中呈现为4月份、10月份相对较高,1月份、7月份相对较低。
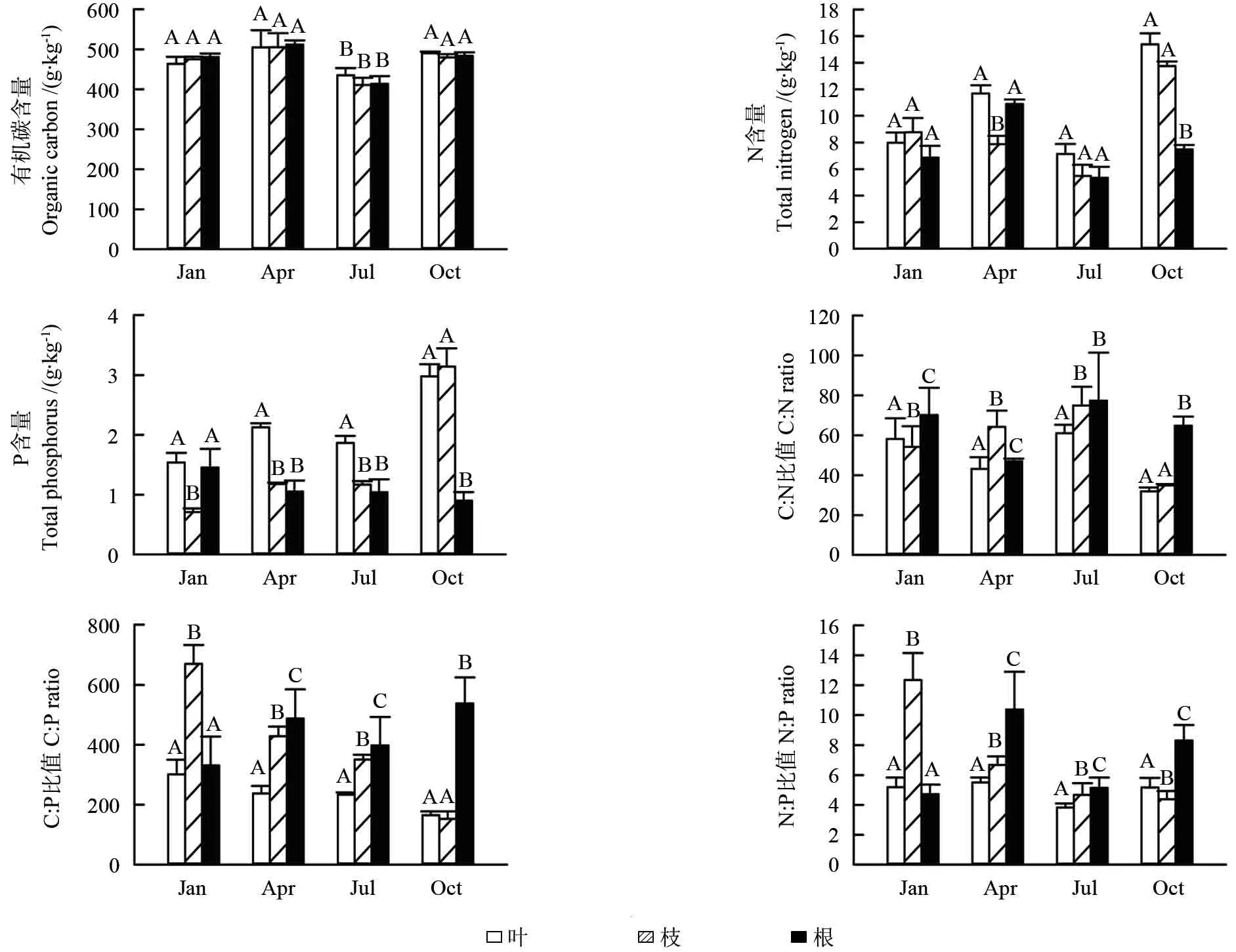
图1 杉木不同器官的C、N、P生态化学计量学的季节动态特征Fig.1 Seasonal dynamics of C,N,P contents and C:N、C:P、N:P mass ratios in different organs
成熟杉木林叶、枝、根在不同季节具有相应的变化规律,春秋两季期间的C、N、P含量高于冬夏两季,从表2可知,叶、枝、根的C含量年平均值分别为473.66、467.96、472.63 g/kg,表现为根>枝>叶;N为10.49、8.97、7.64 g.kg-1,P为2.13、1.55、1.11 g.kg-1,N、P 均表现为叶>枝>根。叶、枝、根的N含量和C:N之间具有显著差异性(P<0.05)。
2.3 叶、枝、根生态化学计量比之间相关关系
杉木叶与枝C 呈现为极显著正相关关系(P<0.01,表3),叶的N:P与枝的C、叶与枝的P、叶的C∶N与枝的C∶P、叶的C∶N∶P与枝的C∶P、叶的C∶N∶P与枝的N∶P 均存在的显著正相关关系(P<0.05)。叶的N∶P与根的C 呈现为极显著的正相关关系(表4),叶与根的C、叶的C∶N∶P与根的P 存在着不同程度的相关关系,达到显著正相关水平。枝与根的C、枝的N∶P与根的P、枝的P与根的C∶N∶P 存在着不同程度的相关关系(表5),达到显著正相关水平(P<0.05)。
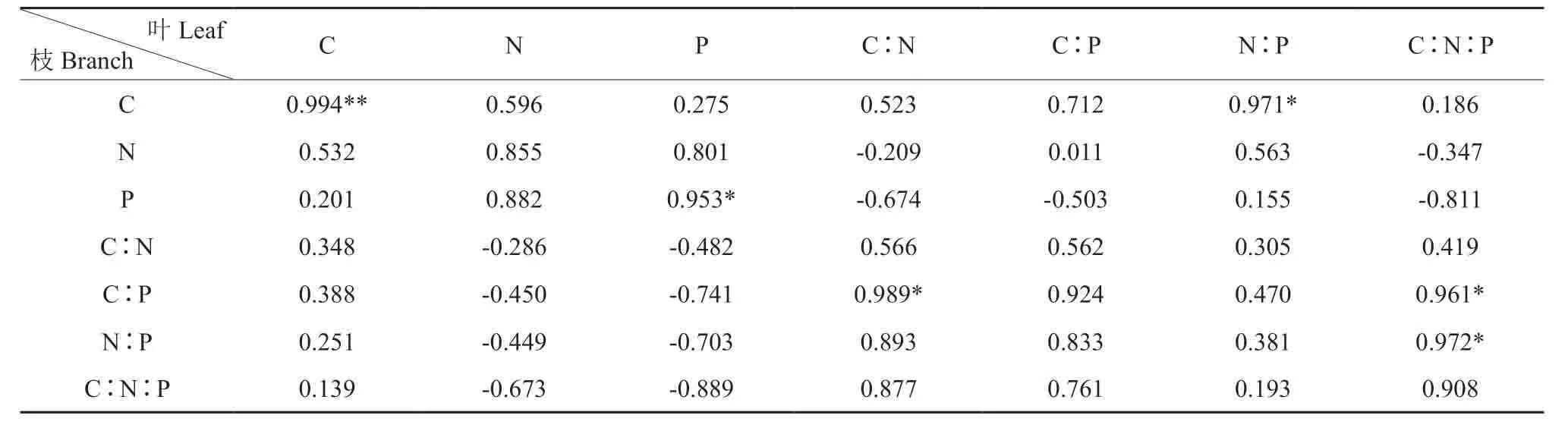
表3 叶、枝碳氮磷含量与生态化学计量比间的分析†Table3 The relationship between leaf and branch stoichiometry characteristics
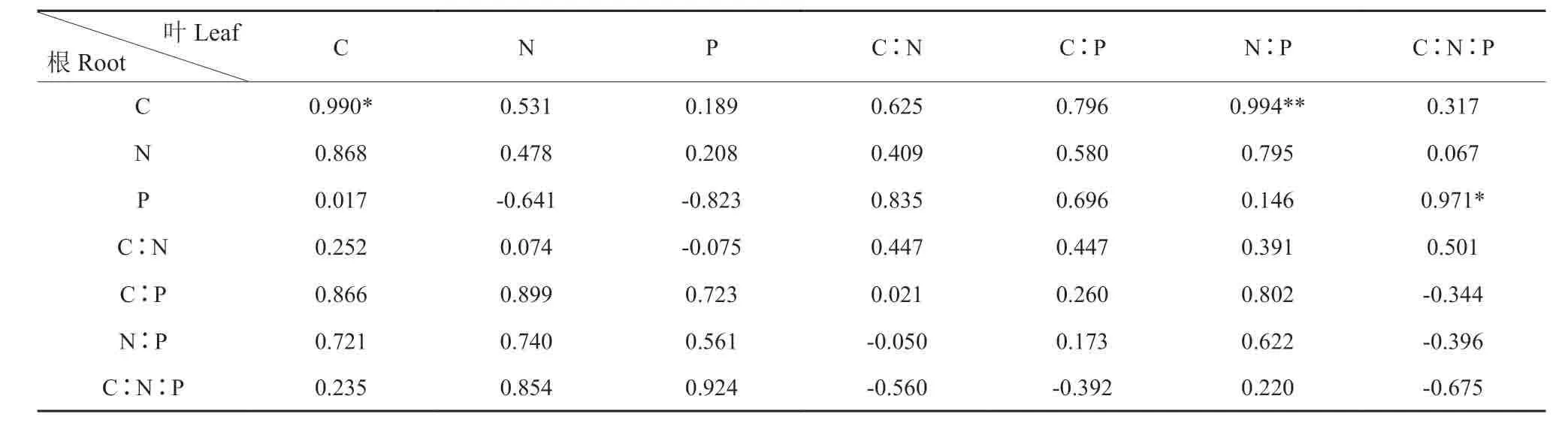
表4 叶、根碳氮磷含量与生态化学计量比的相关关系†Table4 The relationship between leaf and root stoichiometry characteristics
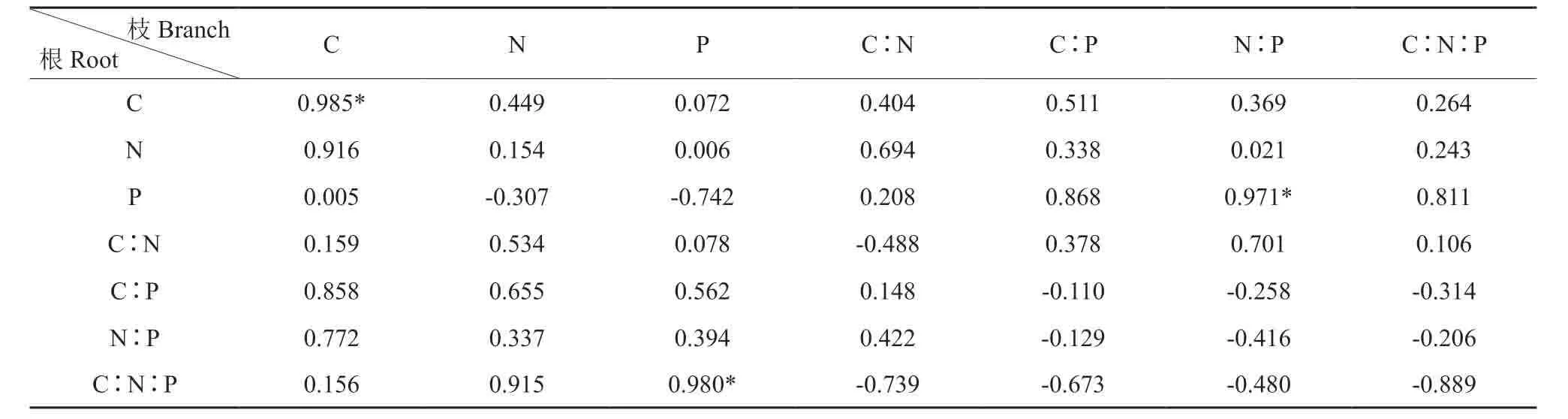
表5 枝与根碳氮磷含量与生态化学计量比的相关关系†Table5 The relationship between branch and root stoichiometry characteristics
2.4 植物器官C:N:P生态化学计量和环境因子的关系
不同季节的杉木叶、枝、根的C、N、P含量及生态化学计量比与土壤温度、含水率、pH、容重4个环境因子CCA 排序图见图2。箭头连线的长度代表不同器官变量与环境因子相关程度,连线越长相关性越大,连线越短相关性越小。箭头连线与排序轴之间的夹角代表环境因子和排序轴间相关性大小,夹角越小相关性越高。从图2中可知,1月份解释变量和环境因子在排序轴上的相关性分别为0.632、0.716、0.765、0.872;4月份分别为0.602、0.685、0.735、0.847;7月份分别为0.576、0.658、0.708、0.823;10月份的分别为0.755、0.833、0.875、0.951(P<0.05)。结果表明冬季温度、含水率对植物器官的C∶P、C∶N 具有较大直接的影响,春季容重对C∶P 影响相对较大,夏季含水率对C∶P、C∶N 影响相对较大,秋季容重对N∶P 影响相对较大。

图2 不同器官的C∶N∶P生态化学计量特征与环境因子的CCA 排序Fig.2 The CCA sequence diagram of ecological stoichiometric characteristics and environmental factors of C:N:P in different organs
3 结论与讨论
3.1 成熟杉木叶、枝、根的生态化学计量特征
植物不同器官C、N、P含量及生态化学计量的存在显著季节动态。本研究的Ⅲ号集水区30年生杉木叶、枝、根中的N 含量分别为10.49±2.01、8.97±1.74、7.64±1.17 g·kg-1,明 显低于我国陆生植物的N 平均含量18.6 g·kg-1,P 含量分别为2.13±0.31、1.55±0.54、1.11±0.12 g·kg-1,叶、枝的P 含量高于陆生植物1.22,而细根的P 含量接近对我国陆生植物P 含量的测定[13]。而叶、枝、根的N∶P分别为4.92±2.46、7.02±3.51、7.13±3.57,明显低于我国陆生植物的N∶P 均值14.4[7,14],也远低于北亚热带常绿落叶阔叶混交林和亚热带常绿阔叶林N∶P的12.7、15.3±1.5[7],这表明该区域杉木林的进入成熟期生长中仍然会受到N的限制,与田大伦等[14]和陈婵等[15]对成熟杉木林生态系统养分循环研究的结果相近。30年生杉木叶、枝、根的C∶N∶P 分别为222∶5∶1、302∶6∶1、426∶7∶1,远低于王晶苑等[16]关于亚热带人工常绿针叶林叶的C∶N∶P为728∶18∶1的值,与Han等[7]陆生植物叶、枝和根C∶N∶P的242∶14∶1、325∶6∶1和450∶7∶1的结果非常接近。证明了刘璐等[17]对神农架常绿落叶阔叶混交林研究中N∶P表现为针叶林<针阔混交林<阔叶林这一结论。这一结果与普遍认为成熟期杉木的生长基本停滞的观点不同,证明了杉木到成熟期N、P 作为植物生长过程中主要影响元素,其养分循环效率仍然很高,生长缓慢是由于N 素限制。
3.2 成熟杉木器官的生态化学计量季节特征
为满足植物生长发育的需求,植物体内的N、P 更多地被分配到更为活跃的器官[16],来自不同器官之间C、N、P含量及其化学计量比存在季节动态分配差异,导致其化学计量产生显著变化,植物不同器官的养分储存及其功能存在差异性,这与养分元素的生理功能关系密切相关[]。本研究中杉木叶、枝、根的C、N、P和生态化学计量比呈现出了季节性动态特征。C含量为根>枝>叶表现为春季最高,夏季最低,N、P 均表现春秋冬三季高于夏季,为叶>枝>根。植物不同生长季节N、P 浓度变化明显,其化学计量特征存在显著差异。这是由于夏季杉木生长旺季逐渐降低并达到最小值,夏季到秋季又开始升高,到冬季又回升至生长初期水平[18]。叶和枝的C∶N、C∶P 在7月份相对较高,与牛得草等[6]对阿拉善荒漠区不同植物叶片的C∶N、C∶P 结果相似,是由于该时期叶、枝中的N、P 利用率高。关于N、P 关系存在两种假说:内稳态和相对生长率假说。P 在细胞内多以核酸磷的形式存在,Ågren[19]就发现蛋白质合成速率决定植物生长速度,P 可通过影响有机物的分解、N 矿化过程来控制植物的固N 效率[20],快速生长时植物组织P 浓度较高。植物相对生长速率低时,N∶P 会先增加至最大值,然后与相对生长速率增高呈逐渐减少趋势。针对杉木N∶P 随季节变化存在的差异性还需要进一步研究。
3.3 器官间C、N、P 化学计量比的相关性
植物叶片通过光合作用为其生长提供能量,植物叶寿命长能提高养分利用效率。杉木叶片作为长寿命的针叶植物,其养分利用效率是紧密联系的[23]。本研究表明,叶与枝的C 呈极显著正相关(P<0.01),叶与根、枝与根的C 呈显著正相关(P<0.01),叶的N∶P与根的C 呈极显著
正相关关系,杉木器官之间的C 元素是相互移动和影响,C 在叶、枝、根的变异系数较低且基本一致,当植物叶在光合作用下固定C,形成有机质,并向枝和根转移[22]。叶片通过光合作用为植物生长提供能量,枝在杉木生长中为叶片生长提供营养,并承担叶片与其他器官的营养交换,叶片N、P 含量的变异系数相对其他器官明显低,叶分别和枝、根的N∶P 呈现极显著正相关,表明其具有相同的限制性元素[24]。叶和枝对养分的汲取和吸收呈同步的,因此叶与枝的C∶P 表现为极显著正相关关系,细根是树木水分和养分吸收的主要器官,吸收表面积大,生理活性强,生长和周转迅速,在杉木养分循环起着十分重要的作用。植物器官中的P 对N∶P的影响更大,这是由于植物能从环境中直接吸收利用的P 比N 更少[24]。因此 研究杉木林不同器官生态化学计量比季节动态特征,对成熟杉木林大径材培育过程中养分储存和维持长期的生产力有着重要的意义[25]。

