高效制备重组人α-突触核蛋白原纤维方法的建立
罗海玉, 吴正存, 马开利,2
(1. 中国医学科学院 北京协和医学院 医学生物学研究所 药物安全性评价研究中心, 昆明 650118;2. 中国医学科学院 北京协和医学院 医学灵长类研究中心&神经科学中心, 北京 100005)
帕金森氏病(Parkinson′s disease,PD)是发病率仅次于阿尔兹海默症的第二大神经系统退行性疾病,65岁以上人群的发病率为1%[1]。病理学研究发现,在PD的黑质致密部可见部分球状包涵体,称为路易小体(Lewy bodies,LBs)。LBs的形成可认为是PD的病理学标志,它的主要成分为部分中空的放射状淀粉样纤维,而该淀粉样纤维的主要成分为α-突触核蛋白(α-synuclein,AS)。AS是一种14 ku的蛋白质,主要分布于中枢神经系统神经元突触前末梢及细胞核,它可以与脂质结合并且调节突触小泡的释放,参与突触正常功能的维持,并且与多种神经系统疾病密切相关[2]。
近年来的研究报道表明,异常聚集的AS具有类朊病毒样的传播特性,其原纤维会像朊病毒一样进入细胞造成损害,并且会在多个神经元细胞间迁移,导致大脑中更多毒性AS的扩散集聚,最终导致大脑负责运动控制区域的神经元死亡[3]。同时,相比较于PD的经典毒素模型和转基因模型,利用AS原纤维建立的PD动物模型所诱导产生的内源性AS水平更接近于人类的生理水平[4],并且PD的原纤维动物模型所诱导产生的病理变化和神经元功能障碍更类似于人类的病症[5]。目前,AS原纤维已经成为建立PD模型的重要材料,高效制备大量AS原纤维将为PD的研究奠定重要基础。
本研究构建了高效表达人AS的原核载体,通过诱导条件优化获得了人α-突触核蛋白的大量表达,采用GST融合蛋白纯化磁珠法进行蛋白的纯化,同时对原纤维培养条件进行了优化,最终高效获取了重组人AS原纤维,并在透射电镜下成功观察到了原纤维的形态。以上结果为PD的动物模型及细胞模型的建立提供了重要的研究材料。
1 材料与方法
1.1 材料
pcDNA3.1-α-syn及pGEX-5X-1载体、大肠杆菌菌株BL21(DE3)均为本实验室保存。DNA Marker、各种限制性内切酶和T4DNA连接酶购自宝生物(大连)公司;PCR产物纯化试剂盒、质粒提取试剂盒、胶回收试剂盒、BCA蛋白浓度检测试剂盒购自上海生工生物有限公司;GST融合蛋白纯化磁珠试剂盒购自海狸公司;蛋白预染Marker购自NEB公司;鼠抗anti-α-synuclein一抗和羊抗鼠二抗购自Abcam公司;氨苄霉素、胰蛋白胨和酵母提取物(LB) 购自Oxoid公司;硫磺素T试剂、全黑的384孔板购自赛默飞公司;其他常用化学试剂均为国产分析纯。
1.2 方法
1.2.1 人AS原核表达载体的构建
根据GenBank中已经发表的人AS序列设计引物:α-synF:5′-TTCCCGGGTATGGATGTATTCATG-3′;α-synR:5′-AAGCGGCCGCTTAGGCTTCAGGTTCG-3′。引入酶切位点SmaⅠ和NotⅠ,以载体pcDNA3.1-α-syn为模板获取AS全长基因。分别用SmaⅠ和NotⅠ双酶切pGEX-5X-1和AS PCR片段后,按试剂盒方法回收产物。在T4连接酶的作用下,将AS片段克隆至载体pGEX-5X-1中,转化宿主菌DH5α。试剂盒方法抽提重组质粒DNA,经SmaⅠ和NotⅠ双酶切鉴定阳性的重组子送上海生工进行测序鉴定。测序正确的阳性克隆子命名为pGEX-5X-1-syn。
1.2.2 重组质粒的诱导表达
将鉴定正确的阳性克隆pGEX-5X-1-syn和PGEX-5X-1载体转化BL21菌株后,分别挑取单菌落接种到含有终浓度为50 nmol/L氨苄霉素的5 mL LB培养基中,37 ℃震荡培养过夜;再将菌液按1∶50的比例接种到含同样浓度氨苄霉素的新鲜的100 mL 培养基中,继续培养至OD值达到0.8左右,加入终浓度为1 mmol/L的IPTG继续培养6 h,收集菌体。加入细菌裂解液充分裂解菌体后,加入5 ×上样缓冲液,100 ℃煮沸10 min,进行10% SDS-PAGE电泳,电泳后进行考马斯亮蓝染色,脱色后观察诱导结果。同时采用AS单克隆抗体进行Western Blot验证蛋白的表达。
1.2.3 重组蛋白表达的可溶性分析
按上述方法诱导后离心收集菌体,加入细菌裂解液充分裂解,于4 ℃,13 000 r/min 离心20 min,分离上清为可溶性总蛋白,沉淀物为不溶性的包涵体。将沉淀物中加入适量的浓度为6 mol/L的尿素溶液进行溶解,同样方法离心取上清,得到不溶性的包涵体成分。进行10% SDS-PAGE电泳,分析重组蛋白表达的可溶性。
1.2.4 诱导条件优化
分别挑取单菌落接种到含有终浓度为50 nmol/L氨苄霉素的5 mL LB培养基中,分别加入终浓度为0、0.5、1.0和2.0 mmol/L的IPTG 37 ℃条件下诱导6 h,收集菌体进行10% SDS-PAGE电泳,分析IPTG的最佳诱导浓度。在筛选出最佳诱导浓度后,按上述方法加入最佳诱导的IPTG后,分别于每1 h取样,进行10% SDS-PAGE电泳,分析IPTG的最佳诱导时间。在筛选出最佳诱导浓度和最佳诱导时间后,按上述方法加入最佳诱导浓度的IPTG,分别于16 ℃、30 ℃及37 ℃条件下诱导,分别收集菌体进行10% SDS-PAGE电泳,分析IPTG的最佳诱导温度。
1.2.5 GST融合蛋白纯化
参考纯化试剂盒说明书并进行部分条件优化:将诱导表达的重组蛋白菌体100 mL 离心收集后加入30 mL Buffer A进行超声破碎(200 Hz,超声破碎10 s,停15 s,工作时间为15 min);离心后取上清加入终浓度为10 mmol/L的DTT和0.1% Tween 20,加入GST纯化磁珠;4℃条件下漩涡混合1 h;磁性分离,用Buffer A分别清洗3次磁珠。洗涤完后加入适量的Buffer B进行洗脱,收集洗脱液,取适量进行10% SDS-PAGE蛋白电泳。回收磁珠后按说明书用Buffer C和Buffer D进行洗涤,保存于20%的乙醇中重复利用。
1.2.6 Western Blot 检测
将诱导表达蛋白和纯化的人AS经10% SDS-PAGE凝胶分离;4 ℃ 60 V恒压转膜2 h;用1%脱脂奶粉常温封闭1 h。加入anti-α-synuclein抗体(1∶2000),4 ℃孵育过夜,TBST洗膜3次,每次10 min;加入红外荧光二抗标记的山羊抗鼠二抗(1∶10 000),室温避光孵育2 h,洗膜3次,每次10 min。用美国Licor的Odyssey红外激光扫描成像系统扫描结果。
1.2.7 硫磺素T实验
使用PBS将硫磺素T原液稀释到工作浓度为25 μmol/L,384孔板每孔加入95 μL的硫磺素T工作液,同时加入2.5 μL的样品,上下混匀。在室温孵育30 min,用Varioskan LUX多功能酶标仪进行荧光检测(激发波长450 nm,发射波长500 nm)。
1.2.8 透射电子显微镜验证原纤维的形成
用水将磷钨酸试剂稀释至1%,将原纤维溶液上下混匀后滴于事先准备好的铜网上,静置5 min用滤纸吸干未吸收的溶液,用尖头镊子夹住蘸取磷钨酸染液,稍微干燥之后沾水以洗去多余的染液,室温干燥30 min,在电压100 kV的透射电镜下观察样品并拍照记录。磷钨酸负染方法可以将背景染成黑色,所以电镜下看到的原纤维轮廓呈现白色。
2 结果与分析
2.1 高效表达重组人AS原核系统的构建
PCR产物经琼脂糖凝胶电泳结果如图1-A所示,PCR 扩增得到大小约为420 bp的单一条带,与目的片段大小一致。PGEX-5X-1是表达GST融合蛋白的原核高效表达载体,载体本身能表达一个分子量为26 ku的GST标签蛋白,因此预计融合AS后其分子量大约为45 ku。采用终浓度为1 mmol/L的IPTG进行蛋白诱导表达6 h,结果如图1-B箭头所示,诱导表达后菌体经SDS-PAGE蛋白电泳,相比较空载体对照组,在45 ku左右处有一明显的特异性蛋白条带,与预期的分子量大小一致,初步证实AS得到外源表达。采用anti-α-synuclein单克隆抗体通过Western Blot方法对表达蛋白进行鉴定,结果(图1-C)显示,相比较空载体转化组,重组载体pGEX-5X-1-syn转化组在45 ku左右处有特异性的条带出现,证实融合的AS得到高效表达。对表达蛋白菌体分离菌体上清和包涵体进行SDS-PAGE电泳分析,结果(图1-D)表明,融合AS几乎全部存在于菌体上清液中,显示融合AS为可溶性表达。以上结果证实人AS在PGEX-5X-1载体中得到高效融合表达。

图1 表达重组人AS原核载体系统的构建
2.2 重组人AS诱导条件的优化
为获取大量的重组人AS,对诱导剂IPTG的最佳浓度、最佳诱导时间及最佳诱导温度进行优化。结果(图2-A)显示,当存在IPTG的情况下,AS得到了大量诱导表达,且随着浓度增加,AS的表达量趋于平稳。所以本研究中采用终浓度为1.0 mmol/L的IPTG进行诱导。在此浓度条件下对诱导时间进行优化,分别诱导0~6 h取样进行SDS-PAGE电泳,结果(图2-B)显示,在诱导3 h时,重组人AS的表达量达到最大。因此筛选出重组人AS的最佳诱导条件为:IPTG终浓度1.0 mmol/L;诱导时间3 h。对诱导表达的温度进行进一步优化。分别采用37 ℃、16 ℃和30 ℃条件,IPTG终浓度为1.0 mmol/L,诱导表达3 h,进行SDS-PAGE电泳分析,结果(图2-C)显示,在诱导温度为37 ℃时,重组人AS的表达量达到最大。所以,本研究最终优化的诱导条件为:终浓度为1.0 mmol/L的IPTG 37 ℃下诱导3 h。

A: IPTG浓度;B:诱导时间;C:诱导温度
图2 重组人AS诱导条件的优化
Figure 2 Optimized induction conditions of recombinant human AS
2.3 重组人AS纯化条件的优化
本研究使用的蛋白纯化方法区别于传统的亲和层析方法,采用高效率的GST融合蛋白纯化磁珠进行蛋白纯化,在短短3 h内即可完成纯化工作。如图3-A所示,对纯化后的蛋白进行SDS-PAGE电泳分析,结果显示纯化后的蛋白纯度高达99%左右,测定蛋白浓度为600 ng/mL,每100 mL细菌培养液可纯化出AS蛋白2.5 mg。同时,如图3-B所示,对GST纯化磁珠的纯化效率进行SDS-PAGE电泳验证,发现多次重复使用磁珠,对纯化效率没有明显的影响。如图3-C所示,采用anti-α-synuclein单克隆抗体,通过Western Blot方法对纯化后的蛋白进行鉴定,在45 ku左右处有特异性的条带出现,证实纯化获得的是目的蛋白AS。以上结果证实采用GST融合蛋白纯化磁珠可以重复并高效率的获取高纯度的重组AS。

图3 采用GST融合蛋白纯化磁珠进行AS蛋白的纯化
2.4 重组人AS原纤维制备条件的优化
根据文献报道,AS的起始浓度及培养时间是原纤维形成的关键性因素。因此在37 ℃,1000 r/min震荡培养的条件下,进一步对原纤维培养的浓度和时间进行了优化。本研究采用硫磺素T实验对淀粉样蛋白原纤维的形成情况进行检测(激发波长450 nm,发射波长500 nm)。由图4-A荧光结果显示,重组人AS在浓度为9 mg/mL的条件下才能大量形成原纤维。在此浓度条件下,对原纤维形成的时间依赖性进行了检测(0~14 d),结果(图4-B)显示,原纤维在第6天达到最高值,随后趋于稳定。图4-B中的140 aggregate为商品化的AS聚集体,作为阳性对照。以上结果证实采用浓度为9 mg/mL,培养6 d可制备大量重组AS原纤维。
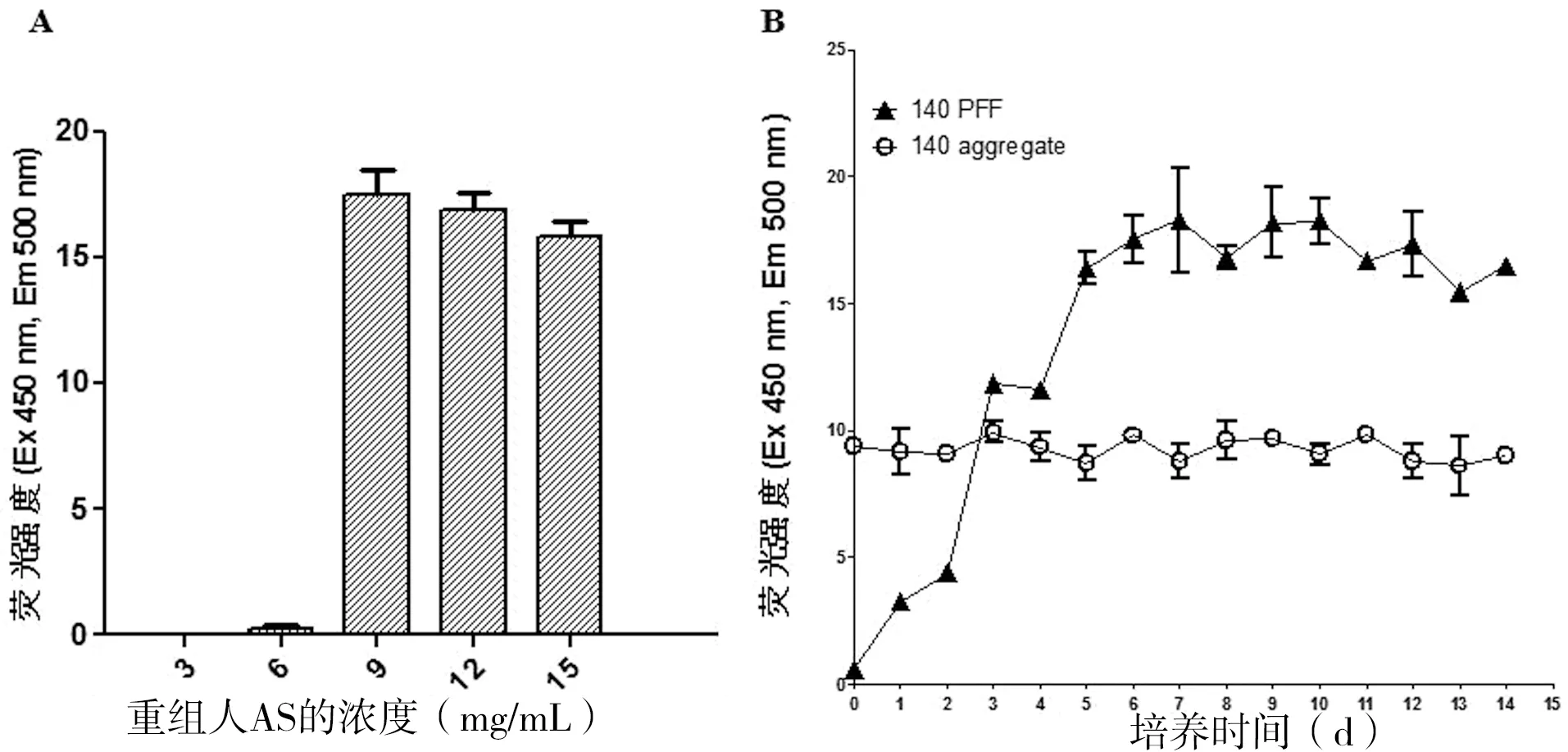
图4 重组人AS原纤维制备条件的优化
2.5 透射电镜检测重组人AS原纤维的形成
对原纤维样品进行磷钨酸负染后,置于铜网上,干燥后通过透射电镜观察原纤维的形态。如图5中箭头所示,电镜下可以观察到长度大于50 nm的较长的纤维结构,图5-A、B和C分别代表10.0、20.0和30.0 k倍数下重组人AS原纤维的电镜结果。证实AS原纤维制备成功。
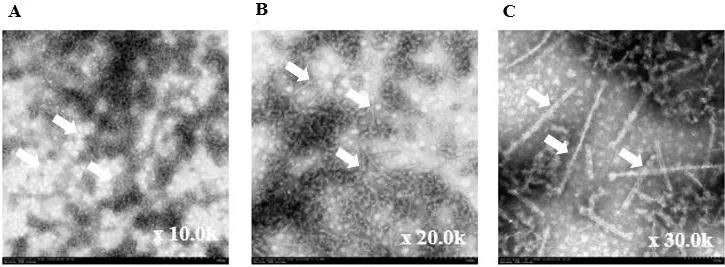
图5 透射电镜观察重组人AS原纤维的形成
3 讨论与结论
Volpicelli-Daley等人首先报道了外源性的AS原纤维会诱导路易体病变,并最终导致突触功能障碍和神经元死亡[6]。随后,其又发现AS原纤维会导致内源性的AS发生聚集并形成LBs[7]。最新研究表明,AS原纤维会优先与线粒体结合,并最终导致线粒体功能障碍[8]。研究者们将AS原纤维注射到小鼠的脑内,发现诱导产生了大量类LBs的包涵体[9];将AS原纤维接种于原代神经元细胞,发现诱导产生了大量包涵体并且发现磷酸化水平明显升高[10]。因此,利用AS原纤维建立PD模型,将有望成为研究体内PD样LB病理学的通用造模方法。
AS的聚集倾向是导致PD的主要原因,其本质上是一种无序的蛋白质,但不同的环境条件会影响其构象可塑性[11]。所以,如何高效率获得大量纯度较高的AS原纤维已经成为各项研究工作的基础环节,越来越多的研究者旨在建立一套高效的纯化及制备方法。选择合适的表达系统、快捷的纯化方法和高效的制备条件是获取高浓度纯度原纤维的关键。
本研究中采用pGEX系列载体中的PGEX-5X-1,pGEX系列载体是广泛用于融合蛋白构建和表达的载体,其所表达的蛋白产物在N端带有GST序列,融合蛋白产物可通过GST层析柱快速、简便地纯化[12]。实验结果显示,人AS在PGEX-5X-1载体中得到高效可溶性表达,大大降低了纯化难度。
在纯化过程中,本研究采用了GST融合蛋白磁珠方法,便于控制洗脱体积,能在短短3 h内从1 L细菌培养液中获取25 mg重组蛋白,与传统蛋白纯化方法(沉淀技术、层析技术、双水相萃取技术)相比[13],具有更快速、高效率、低成本和操作简单等优势。同时用磁珠进行纯化,无需对粗蛋白进行复杂的处理,能在短时间内就完成纯化工作,避免了纯化过程中蛋白质的损失。本纯化方法对实验室条件要求不高,不需要昂贵的层析设备,且GST融合蛋白纯化磁珠具有能重复使用的优良特点,能大大降低实验成本。
近年来,越来越多的研究者致力于寻找一种高效的PD模型以及监测量化AS聚集体的转变过程[14],并且大量研究表明特定的诱导条件可以诱导产生不同形式的AS聚集体。本研究参考总结了Polinski[4]和Volpicelli-Daley[7]等人的原纤维制备方法,对重组人AS原纤维的制备条件进行了优化和改良。发现在浓度为9 mg/mL的条件下,37 ℃,1000 r/min震荡培养6 d时,能够得到浓度较高的原纤维,并通过透射电镜对制备出的原纤维的形态进行了确证。由于原纤维聚集的随机性和调节因子的多样性,对原纤维形成进行准确的检测成为目前研究的难点之一[15]。本研究采用了目前公认的硫磺素T检测方法[16]对原纤维的形成进行了连续监测,由于硫磺素T能够与原纤维结合并且在特定的荧光光谱下产生较高的荧光值,所以可以根据荧光值判断出原纤维在不同浓度和不同时间的形成情况。本研究对原纤维的检测重复了多次,发现结果一致性和稳定性都较好,反复验证实验证实了该方法所制备的原纤维具有很高的浓度和纯度。
经本研究大量重复实验证实,GST融合蛋白磁珠可用于GST标签融合蛋白的高效纯化。硫磺素T染色和电镜观察均证实该制备方法获取了高浓度和高纯度的AS原纤维。本研究得出一套成本较低、浓度纯度较高、制备稳定性和重复性较高的AS原纤维的制备方法,为基于AS原纤维诱导的PD模型进行的各项机制研究奠定基础。

