油茶炭疽病拮抗内生细菌的筛选及鉴定
张林平,张仪平,陈 静,高一欣,陈言柳,吴 斐,郭春兰
油茶炭疽病拮抗内生细菌的筛选及鉴定
张林平1,张仪平2,陈 静1,高一欣2,陈言柳1,吴 斐1,郭春兰1
(1. 江西农业大学 鄱阳湖流域森林生态系统保护与修复国家林业局重点实验室,江西 南昌 330045;2. 江西省贵溪市林业局,江西 贵溪 335400)
从健康的油茶叶中分离得到内生细菌菌株125株,经平板对峙法初筛,筛选出对油茶炭疽病病菌有抑制作用内生细菌23株,再通过发酵法复筛,筛选到6株具有强拮抗作用的菌株。通过形态学观察、生理生化测定及16S rDNA序列分析等方法,将Y55和Y57鉴定为,Y56鉴定为,Y76鉴定为sp.,Y77鉴定为,Y112鉴定为sp.。
油茶;拮抗内生细菌;炭疽病;生物防治
油茶(Abel),系山茶科(Theaceae)山茶属()常绿小乔木或灌木,是我国亚热带地区特有的木本食用油料树种[1]。油茶适种于广大红壤丘陵低海拔地区[2]。长期食用茶油可降血压、降血脂,预防心血管疾病[3],油茶还可作为机械润滑油、防锈油等生产原料。此外,油茶树在净化空气、保持水土、涵养水源、抗污染等方面具有很强的能力[4]。由于日益受到消费者的青睐和能源危机突显,国家十分重视油茶产业的发展,到2020年我国油茶种植面积可达4.667×107hm2,茶油产量可达2.5×107t,可见,我国油茶产业迎来了难得的快速发展机遇。同时,油茶病害的发生程度突显严重,严重制约了油茶产业的可持续发展[5]。目前对油茶病害的防治仍以化学防治为主,但由此引发农药残留、环境污染、产生抗药性等一系列问题,严重影响了茶油质量和食品安全。因此,要实现油茶高产、优质、绿色无公害,有必要从不同生态环境中分离、筛选有益微生物,这是解决油茶病害防治的重要途径之一。
当前,油茶产区中油茶炭疽病是主要病害之一。本研究拟从油茶健康植株叶片分离出内生细菌,通过平板对峙法和发酵液复筛法筛选出对油茶炭疽病菌具有强烈抑制作用的菌株,并对拮抗内生菌株进行鉴定,为油茶炭疽病生物防治研究提供理论依据和优良菌株。
1 材 料
1.1 供试样品
供试样品于2018年9月从宜春市江西星火油茶科技示范园内采集5~6 a生的健康油茶植株叶片,装入自封袋,并带回实验室置于4 ℃冰箱,48 h内完成分离。油茶炭疽病菌(),菌株由江西农业大学森林保护教研室分离并保存。
1.2 供试培养基
PDA培养基:葡萄糖18 g,马铃薯200 g,琼脂粉18 g,蒸馏水1 000 mL,自然pH;NA培养基:牛肉膏3 g,NaCl 5 g,蛋白胨10 g,琼脂粉20 g,蒸馏水1 000 m,pH 7.2~7.4。
2 方 法
2.1 油茶内生细菌的分离
采用组织块分离法随机挑选从宜春油茶基地采集回来形态正常、无病虫害、色泽正常的油茶叶片适量,用自来水冲洗干净,晾干。在体积分数75%酒精中浸泡90 s,然后再在体积分数3.5%次氯酸钠中浸泡180 s,最后用体积分数75%酒精浸泡45 s,取出后用无菌水冲洗3~4次,用灭菌的滤纸将叶面水分吸干,剪成2 mm×2 mm大小的组织块。每个含有NA培养基的平板内放置5个组织块,共40皿,放置于28 ℃培养箱中进行培养。以最后一次清洗完油茶叶的无菌水涂布于NA培养基作为CK对照,3 d后培养基上无菌落形成,表明材料表面消毒彻底,组织块上长出的菌落则为内生细菌,菌株纯化后保存。
2.2 拮抗细菌的筛选
(1)平板对峙法初筛。用移液枪取1 mL已灭菌的NA液体培养基至1.5 mL的离心管中,用挑针蘸取待测细菌至离心管中28 ℃摇培2 d,制得细菌悬浮液。将油茶炭疽病菌于PDA培养基平板上活化后,用直径为6 mm的打孔器在平板外缘随机打孔成菌饼,将菌饼挑至固体PDA平板中央,用移液枪取5 μL摇培后的待测细菌的悬浮液等距离(距炭疽菌菌饼2.5 cm)对称点接,以只接菌饼的培养基为空白对照,每个处理3个重复。放于28 ℃培养箱中培养4 d后观测抑菌带有无及大小,判断菌株是否具有抑菌作用。
(2)拮抗细菌复筛。初筛获得的内生细菌经活化后接入5 mL NB培养基的10 mL离心管中,室温,160 r/min的条件下摇培3 d。于12 000 r/min室温离心20 min,使用注射器取上清液,再用0.22 μm的细菌过滤器过滤上清液至无菌10 mL离心管中得到无菌发酵液液,用移液枪取其中1 mL的无菌发酵液加入至25 mL 50 ℃的PDA培养基混匀后倒平板,放入油茶炭疽病菌菌饼至28 ℃培养,3 d后观察并测定菌落大小并计算抑制率,筛选出强拮抗菌株。
抑菌率=(对照-处理)/对照×100% (1)
2.3 拮抗菌株的形态学和分子生物学鉴定
参照《Bergey’s manual of determinative bacteriology》[6]和《常见细菌系统鉴定手册》[7]。并依据菌落特性、形态和菌体的生理生化反应等进行形态学和生理生化鉴定。
分子生物学鉴定:利用Ezup柱式细菌基因组DNA 抽提试剂盒提取菌株DNA,使用通用引物27F“5′-AGAGTTTGATCCTGGCTCAG-3′”和1492R“5′-GGTTACCTTGTTACGACTT-3′”进行PCR扩增,20 μL PCR扩增体系:引物27F和1492R各1 μL,2×PCR Master mix 7 μL,内生细菌的DNA模板1 μL,双蒸水10 μL。PCR扩增程序:95 ℃ 5 min,(95 ℃ 45 s、55 ℃ 50 s、72 ℃ 40 s)(30个循环),72 ℃ 8 min。PCR产物送至上海生工生物工程技术服务有限公司进行测序,测序结果与GenBank数据库相关序列进行BLAST比对并下载高同源性的相似序列,采用Mega 7.0软件构建内生细菌的系统发育树并确定其系统发育学地位。
3 结果与分析
3.1 内生细菌的分离及拮抗菌株的筛选
将NA培养基上分离出来的细菌进行纯化、保存,共获到125株内生细菌,菌株编号为Y1~Y125。通过平板对峙法,共有23株对油茶炭疽病菌具有拮抗作用的菌株,占菌株总数的17.6%(图1)。
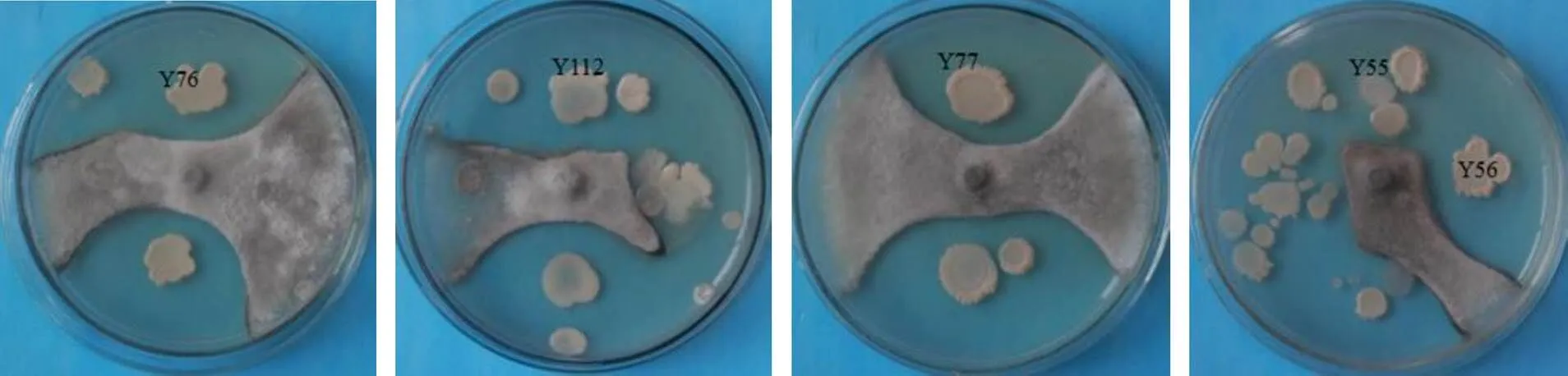
图1 部分内生细菌对油茶炭疽病菌的抑菌效果
参照周国英等[8]方法将抑菌带宽度大小将拮抗菌分为强(7~10 mm)、中(4~7 mm)和弱(<4 mm)等3类。抑菌带宽度小于4 mm的有9株,占拮抗菌株的39.1%;抑菌带宽度为4~7 mm的有8株,占拮抗菌株的34.8%;抑菌带宽度为4~7 mm的有6株,占拮抗菌株的26.1%。
将平板对峙法初筛获得的6株强拮抗菌的发酵液进行复筛,6株拮抗菌的发酵滤液对油茶炭疽病菌具有明显的抑制作用,其中菌株Y55的抑菌率最低(66.0%),菌株Y56(79.3%)、Y57(74.4%)、Y76(78.2%)、Y112(79.1%),而菌株Y77的抑菌率最高(82.4%)。
3.2 强拮抗细菌菌株的鉴定
3.2.1 形态特征及生理生化反应结果 在NA培养基上,菌株Y55、Y57的菌落均呈白色,圆形或近似圆形;菌株Y112的菌落呈米黄色,不透明、不光滑;菌株Y56的菌落呈淡黄色,圆形,表面光滑;菌株Y76的菌落为灰色,不规则圆形,不透明;菌株Y77菌落为淡黄色,半透明。光学显微镜下观察到菌株Y55、Y56、Y57、Y76、Y112均呈杆状,革兰氏染色阳性,产芽孢;菌株Y77呈规格细胞圆球状,革兰氏染色阳性,可产芽孢。
6株拮抗内生细菌生理生化特性如表1所示。根据菌株的形态特征和生理生化特性,初步鉴定菌株Y55、Y57、Y112为芽孢杆菌属(),菌株Y56、Y76、Y77为梭形芽孢杆菌属()。
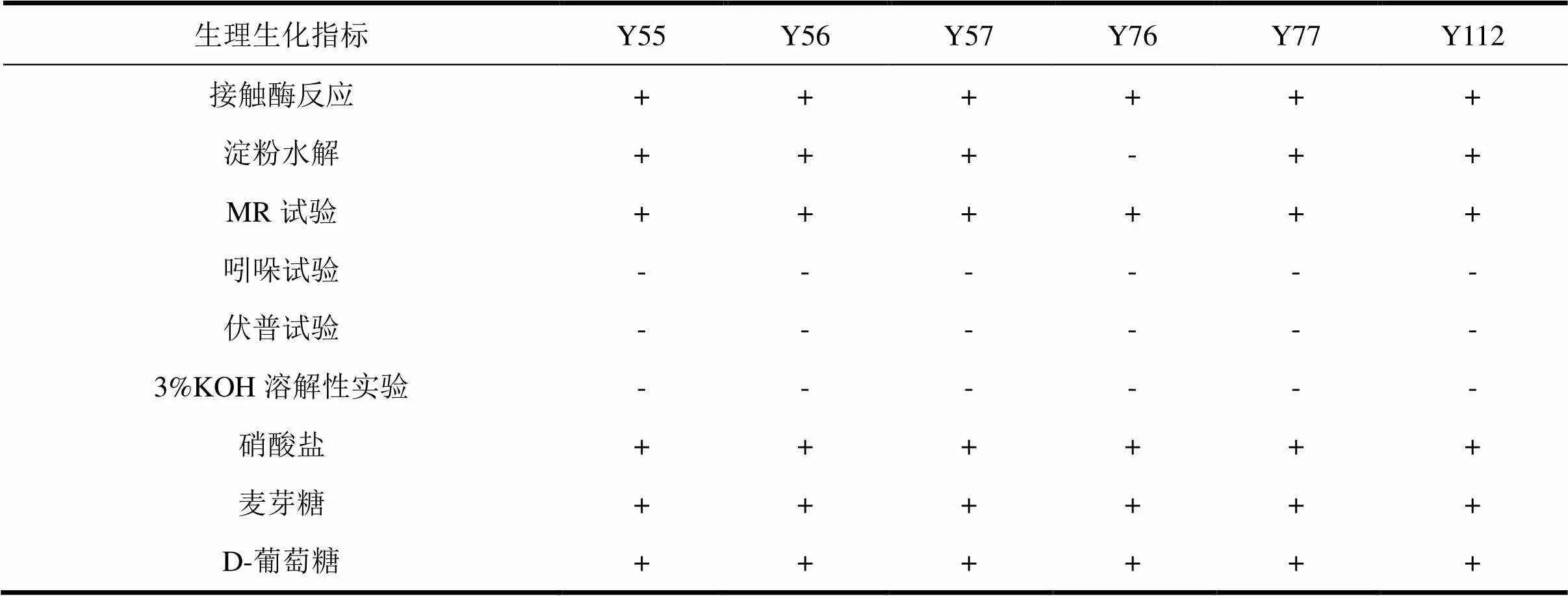
表1 6个菌株生理生化反应结果
“+”表示反应呈阳性;“-”表示反应呈阴性
3.2.2 16S rDNA序列及系统发育分析 从GenBank数据库获得相关属及种的16S rDNA基因序列,以16S rDNA基因序列为基础构建系统发育树如图2所示,Y55、Y57与位于同一分支,其聚类支持强度为100%;Y56与位于同一分支;Y77与位于同一分支,其聚类支持强度为100%。综合形态特征、生理生化和16S rDNA序列分析将Y55和Y57鉴定为,Y56鉴定为,Y76鉴定为sp.,Y77鉴定为,Y112鉴定为sp.。
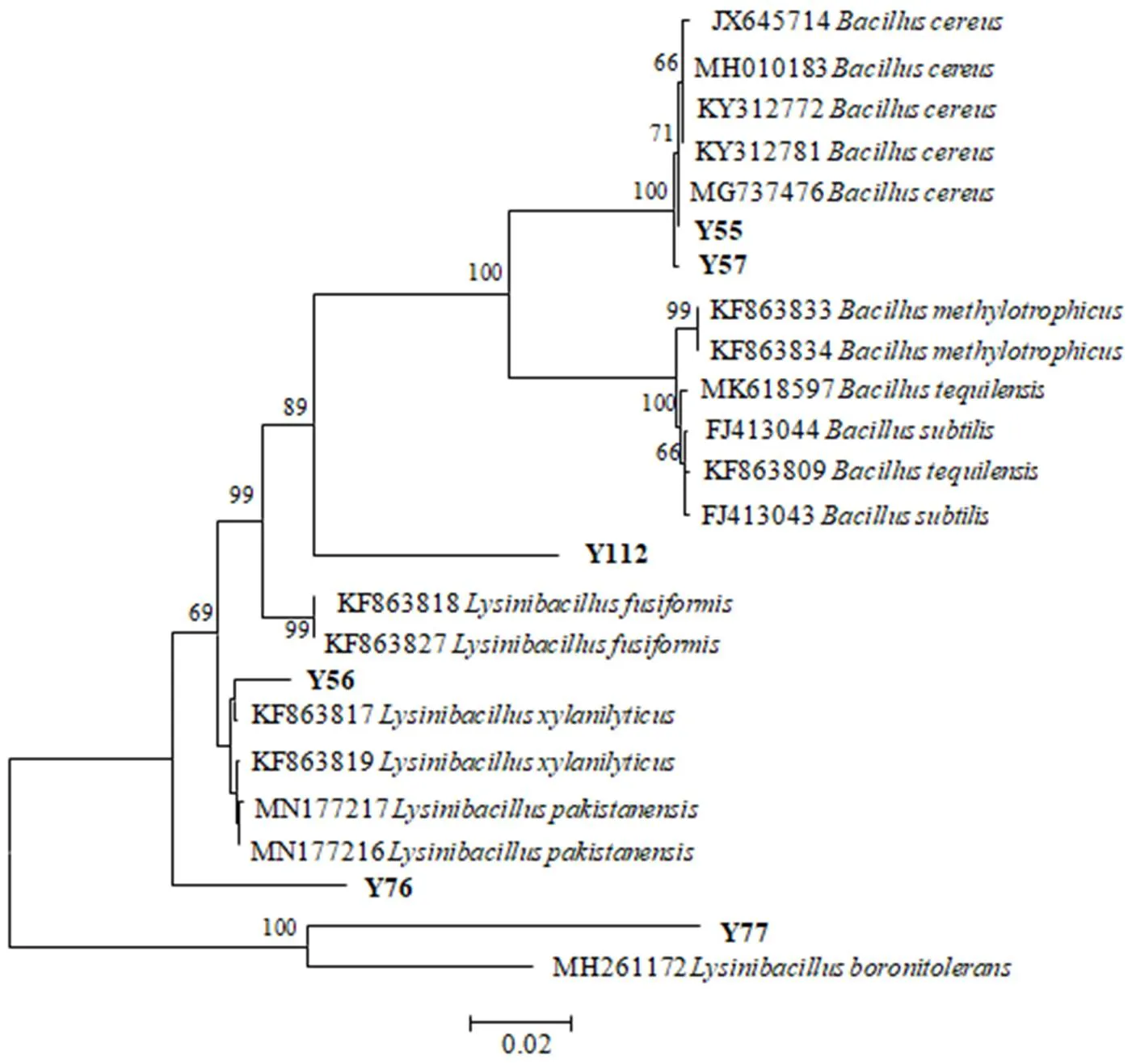
图2 基于16S rDNA基因序列构建油茶拮抗内生细菌及其它相关菌株的系统发育树
4 结论与讨论
植物内生细菌是植物中重要的有益微生物,利用内生细菌协助宿主植物抵制病原菌侵染是当前植物病害生物防治的重要途径[9-13]。大量研究表明,植物内生细菌具有一菌多防的效果。周国英等[8]从油茶中分离筛选获得对油茶炭疽病病菌的生长有较强抑制作用的内生细菌Y13,抑菌直径达10 mm以上;曲田丽等[14]从合欢叶中分离的内生菌H8对6种植物病原菌均有抑制作用;Gong等[15]发现内生细菌代谢产物中有能抑制植物病原菌的抗菌脂肽;苏博等[16]从健康杜仲筛选出拮抗菌株DZSY21可引起病原菌菌丝断裂、畸形等,同时对玉米根系分泌物具有较好的趋化性。本研究从健康油茶中分离筛选获得23株对油茶炭疽病病菌具有抑制的内生细菌,表明油茶中存在丰富的拮抗微生物资源。其中6株内生细菌对油茶炭疽病病菌的生长具有较强的抑制作用,同时6株菌株的发酵滤液对毛竹枯梢病病菌的生长也具有明显的抑制作用,抑菌率为67%~82%。
对6株拮抗内生细菌进行形态和分子生物学鉴定,3株内生细菌为芽孢杆菌属,2株为梭形芽孢杆菌属,这与周国英等[8]的研究结果是一致的。芽孢杆菌能产生耐热抗逆的芽孢,有利于其在环境中定殖、繁殖及开发成生防菌剂,Jeong et al.[17]研究发现,从腌制的泰国食物中分离得到的西姆芽胞杆菌可以抵抗病原物并促进植物生长;张爱梅等[18]从沙棘根瘤内生细菌中筛选出一株具有广谱抑菌作用的内生细菌TT201,经鉴定为侧孢短芽孢杆菌。随着油茶产业可持续发展和环境保护的意识增强,替代或部分替代化学药剂是未来趋势,因此,应用植物内生细菌防治油茶炭疽病具有广阔前景。由于植物内生细菌所处的生境特殊,有关于拮抗内生细菌在油茶的定殖能力、菌株抑菌物质性质及林间的施用剂量等仍需进一步深入研究。
[1] 何方, 何柏, 李忠海, 等. 茶油产品品质等级标准制订说明[J]. 经济林研究, 2004, 22(4): 105-108.
[2] 张日清, 吕芳德, 王义强, 等. 我国油茶生产现状、存在问题及发展意义[J]. 经济林研究, 1996, 45(2): 203-205.
[3] 徐学兵. 茶油研究进展评述[J]. 中国油脂, 1995, 20(5): 7-9.
[4] 彭邵锋, 王湘南, 陈永忠, 等. 油茶及其近缘种种质资源收集与保存利用[J]. 湖南林业科技, 2007, 34(2): 16-18.
[5] 周国英, 宋光桃, 李河. 油茶病虫害防治现状及应对措施[J]. 中南林业科技大学学报, 2007,27(6): 179-182.
[6] 布坎南 R E. 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984.
[7] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[8] 周国英, 卢丽俐, 刘君昂, 等. 油茶炭疽病拮抗内生细菌的筛选[J]. 湖南农业大学学报(自然科学版), 2008, 34(6): 698-700.
[9] 廖晓兰, 罗宽. 油菜花上细菌的分离及其对菌核菌的拮抗作用[J]. 湖南农业大学学报(自然科学版), 2000, 26(4): 296-298.
[10] 易图永, 高必达, 何昆, 等. 水稻纹枯病菌生防细菌的筛选[J]. 湖南农业大学学报(自然科学版), 2000, 26(2): 116-118.
[11] 周燕, 成志军, 易有金, 等. 晒黄烟内生菌株筛选及对青枯病生物防治[J]. 湖南农业大学学报(自然科学版), 2005, 31(5): 500-501.
[12] 马超, 朱洪磊, 黄太伟, 等. 番茄灰霉病菌内生拮抗细菌的筛选及鉴定[J]. 山西农业科学, 2018, 46(3): 437-440, 452.
[13] 张洪波, 巢进, 王跃强, 等. 柑橘溃疡病拮抗菌的分离筛选及其田间防效[J]. 湖南农业大学学报(自然科学版), 2007, 33(5): 605-607.
[14] 曲田丽, 张淑颖, 金玉兰. 合欢内生菌H8的分离、鉴定及其抗菌代谢物质研究[J]. 华北农学报, 2015, 30(1): 54-60.
[15] Gond S K, Bergen M S, Torres M S, et al. Endophyticspp. produce antifungal lip peptides and induce host defence gene expression in maize[J]. Microbiological Research, 2015, 172(1): 79-87.
[16] 苏博, 姚沛琳, 刘小阳, 等. 杜仲内生细菌对植物病原菌的拮抗作用[J]. 安徽农业大学学报, 2018, 45(6): 148-154.
[17] Jeong H Y, Jeong D E, Kim S H, et al. Draft genome sequence of the plant growth-promoting bacteriumKCTC 13613T[J]. Journal of Bacteriology, 2012, 194(15): 4148-4149.
[18] 张爱梅, 吴菊艳, 韩雪英, 等. 沙棘根瘤内生细菌中抑菌促生菌株的筛选和鉴定[J]. 微生物学通报, 2019, 46(5): 74-84.
Screening and Identification of Beneficial Endophytic Bacteria to Controland Effects of Control Diseases
ZHANG Lin-ping1, ZHANG Yi-ping2, CHNE Jing1, GAO Yi-xin2, CHEN Yan-liu1, WU Fei1, GUO Chun-lan1
(1. Key Laboratory of State Forestry Administration on Forest Ecosystem Protection and Restoration of Poyang Lake Watershed, Jiangxi Agricultural University, Nanchang 330045, China; 2. Forestry Bureau of Guixi City, Guixi, Jiangxi 335400, China)
125 bacteria strains were obtained fromleaves which were collected from Jiangxi province. The antagonistic screening of endophytes was carried out that 25 strains can inhibit mycelium ofgrowth markedly; and six of them was strongly antagonistic tothrough fermentation. The strain Y55, Y77 as, Y56 as, Y76 assp., Y77 asand Y112 assp., which identified by morphological observation, physiological, biochemical determination and 16S r DNA sequence analysis.
; antagonistic endophytic bacteria;; biological control
S794.4
A
2095-3704(2020)01-0014-05
2020-02-28
国家自然科学基金项目(31660189)和江西省教育厅项目(GJJ150414)
张林平(1979—),副教授,博士,主要从事森林保护学研究,zlping619@163.com。
张林平, 张仪平, 陈静, 等. 油茶炭疽病拮抗内生细菌的筛选及鉴定[J]. 生物灾害科学, 2020, 43(1): 14-18.
10.3969/j.issn.2095-3704.2020.01.03

