天麻制剂通过腺苷途径治疗偏头痛相关的分子机制研究
郑海非,陈金波,宋维伟,张德福,张 颖,宋晓文,董晓梦,苏毅鹏,鲁文先,李 斌,吴欣彤
偏头痛是一种临床常见的、慢性的、反复发作的神经血管疾病,其发作以单侧搏动性头痛为特征,常见症状还包括恶心、呕吐、畏光、恐声、视觉障碍及自主神经功能障碍。在美国,偏头痛发病率女性为18%,男性为6%[1],偏头痛目前被列为仅次于背痛的全球第二大致残疾病,是神经功能障碍最常见的原因,严重影响了人类生活质量,给世界各地的医疗系统造成巨大负担[2]。目前临床中,应用于缓解偏头痛发作的药物应用最多的主要有曲坦类及非甾体类抗炎药等,其不良反应相对较多,而中药(traditional Chinese medicine,TCM)具有多药、多成分、多靶点的特点,在偏头痛的治疗中已被公认具有临床疗效,虽然其确切的分子机制尚不清楚,但其不良反应相对较少,已经引起越来越多研究者的关注,诸多临床试验证实天麻制剂可有效缓解偏头痛发作[3]。本实验采用ESTG方法复制大鼠偏头痛模型,通过免疫荧光、Western Blot、ELisa技术检测TG、TNC、外周血中的CGRP及TG、TNC中的A1R的表达量变化来探讨天麻制剂各有效成分在偏头痛发病机制中的作用,为研究天麻制剂治疗偏头痛的分子机制提供理论依据。
1 材料与方法
1.1 实验动物及分组 84只SPF级雄性SD大鼠(230~260 g),购于济南朋悦实验动物繁育有限公司,实验动物在滨州医学院SPF级动物房饲养,光/暗循环饲养12 h,给予紫外线消毒后的标准颗粒和高压蒸汽灭菌水喂养,温度在18~25 ℃,经过至少1 w的适应,大鼠按随机数字法分为假手术组(A组/阴性对照组)、偏头痛模型组(B组)、舒马普坦干预组(C组/阳性对照组,6 mg/kg·d)、天麻素干预组(D组,200 mg/kg·d)、对羟基苯甲醇干预组(E组,20 mg/kg·d)、香英兰醇干预组(F组,70 mg/kg·d))、β-谷甾醇干预组(G组,250 mg/kg·d)。
1.2 主要试剂及仪器
1.2.1 主要试剂 琥珀酸舒马普坦片(天津华津制药有限公司),天麻素、香英兰醇、对羟基苯甲醇及β-谷甾醇(上海源叶生物科技有限公司),CGRP相关的ELisa试剂盒(上海酶联生物科技有限公司),CGRP抗体、A1R抗体(美国Abcam公司),β-actin抗体(武汉三鹰生物技术有限公司),辣根过氧化物酶标记的山羊抗小鼠IgG、辣根过氧化物酶标记的山羊抗兔IgG(博士德生物公司),Western Blot试剂盒(博士德生物公司)、FITC-驴抗兔IgG(美国Abcam公司)。
1.2.2 主要仪器 YLS-9A生理药理电子刺激仪(济南益延科技发展公司),ZH蓝星脑立体定位仪及ZHRXZ柔性颅骨钻(安徽正华生物仪器设备有限公司),低温高速离心机(德国Eppendorf公司),电泳仪、湿转转膜仪及酶标仪(美国Biorad公司),共聚焦荧光显微镜(美国Biorad公司)。
1.3 方法
1.3.1 大鼠偏头痛模型 电刺激三叉神经节(ESTG)模型:10%水合氯醛按照0.4 ml/100 g 的剂量将大鼠进行腹腔注射麻醉,然后固定在大鼠立体定位仪上,头顶正中去毛、消毒暴露处皮肤,以“十”字型切口依次切开皮肤、筋膜、肌肉,暴露颅骨。以大鼠前囟为基点,在旁开3 mm、后移3.2 mm处,用颅骨钻小心钻直径为1.5 mm的小孔,然后将电极经此孔向内垂直轻轻插入,遇阻力后微向上抬电极约1 mm,即至TG处(以硬脑膜算起深度约为9.5 mm)。调试好刺激电极,设电刺激参数为周期200 ms,波宽5 ms,幅度10 V,刺激30 min。ESTG模型制作成功的标志为:大鼠电刺激TG侧咀嚼肌收缩,口鼻分泌物增多。
1.3.2 实验给药 D、E、F、G组大鼠于模型制作前7 d连续每天分别给予天麻制剂各有效成分灌胃处理;C组大鼠则提前7 d连续每天给予琥珀酸舒马普坦片灌胃;B组大鼠于模型制作前7 d连续每天分别给予生理盐水灌胃处理;A组大鼠不进行电刺激,余处理同B组。每天1次,持续7 d。最后一次灌胃后1 h,建立ESTG模型,以上所有操作均在无菌条件下进行,操作过程保持动作轻柔、环境安静、避免强光,室温保持25 ℃左右,灌胃后大鼠被送回各自的笼子里,自由获取食物和水。本次研究人员会对动物进行监测,以确保不会出现任何治疗后的反胃现象。电刺激结束后30 min内处死大鼠。
1.3.3 ELisa 颈外静脉取血2 ml注入预冷的抗凝试管中,3000 r/min离心10 min,取上层清液分装后置于-80 ℃冰箱保存待测。按试剂盒说明检测各组大鼠血清中CGRP水平,根据标准品的浓度及对应的吸光度(OD)值在回归方程上计算出对应的样品浓度。
1.3.4 免疫荧光 大鼠造模成功后电刺激30 min后,开胸经左心室插管至升主动脉快速注射37 ℃生理盐水至右心耳流出液变清、肝脏变白,多聚甲醛磷酸缓冲液灌注至大鼠肝脏变韧,肢体变僵直后取出TG、TNC对应的脑干部位,4%多聚甲醛磷酸缓冲液中固定12~24 h后,蔗糖梯度脱水48 h后制作冰冻切片,PBS洗涤后封闭2 h,加入一抗(1∶500),4 ℃孵育过夜,滴加用FITC标记稀释(1∶100)后的IgG(二抗)37 ℃孵育4h(孵育至3.5 h后加入hoechst染色,直至4 h充分反应后展片、封片,最后将制作好的载玻片放于共聚焦荧光显微镜下观察。
1.3.5 Western Blot测定蛋白浓度 大鼠造模成功后电刺激30 min处死取TG及TNC组织,分别置于玻璃匀浆器中,加入裂解液和蛋白酶抑制剂研磨均匀,将裂解的液体以12000 r/min、4 ℃离心5 min,取上清,按照BCA 法测定蛋白浓度,然后100 ℃煮沸10 min,放入-20 ℃冰箱保存备用。配置SDS-PAGE胶,在每个上样孔中加入蛋白样品进行电泳,然后电转移到PVDF膜上,7%脱脂奶粉封闭2 h后加用一抗稀释液稀释的一抗(1∶1000),β-actin(1∶1000)作为内参对照,4 ℃孵育过夜,TBST洗膜,加辣根过氧化物酶标记的山羊抗兔/小鼠IgG二抗(1∶5000),37 ℃振荡孵育2 h,TBST洗膜,加ECL发光剂、曝光,Image J软件分析吸光度值(A值),最终结果以目的蛋白A值与内参蛋白A值的比值表示。
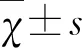
2 结 果
大鼠最后一次灌胃1 h后,建立ESTG模型,刺激30 min后处死大鼠,颈外静脉取血2 ml注入预冷的抗凝试管中,并正确解剖出TG、TNC,进行相关处理后,采用免疫荧光与western blot技术检测TG、TNC中CGRP的水平及通过免疫荧光与western blot技术测定TG、TNC中A1R的水平。
2.1 天麻制剂各有效成分对大鼠偏头痛模型中CGRP表达的影响 本实验通过ELISA技术检测颈外静脉血CGRP的表达,通过免疫荧光与western blot技术检测TG、TNC部位CGRP的表达。与A组相比,B组大鼠颈外静脉血、TG、TNC中的CGRP表达明显高于A组,差异具有统计学意义(P<0.01);与B组相比,C、D组大鼠CGRP的表达量明显下调,差异具有统计学意义(P<0.01),而E、F、G组的CGRP的表达量与B组相比差异无统计学意义(P>0.05);与C组相比,D组大鼠的CGRP表达无明显差异(P>0.05)(见图1~图4、表1)。
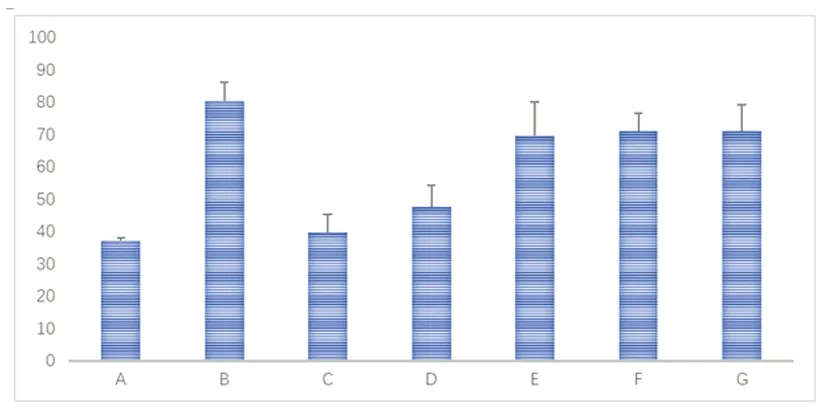
图1 各组大鼠外周血中CGRP 的表达量(n=12,与A组相比,B组PPP>0.05;与C组相比,D组P>0.05)
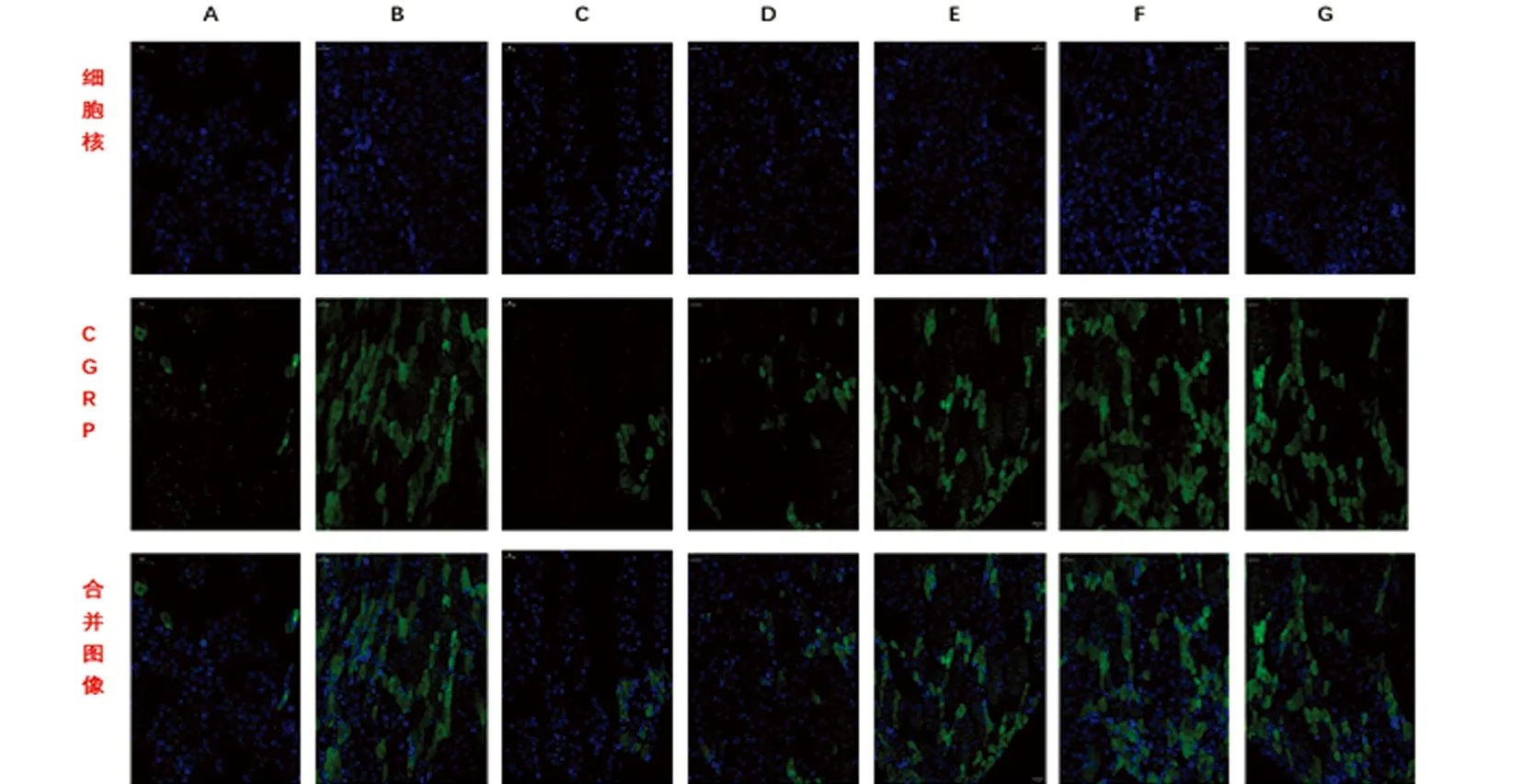
图2 免疫荧光检测各组大鼠TG中CGRP的表达情况(标尺均为50 μm)
图3 免疫荧光检测各组大鼠TNC中CGRP的表达情况(标尺均为50 μm)

图4 Western Blot检测各组大鼠TG、TNC中CGRP的表达情况(n=6,与A组相比,B组PPP>0.05;与C组相比,D组P>0.05)

表1 各组大鼠TG、TNC中CGRP的表达情况
n=6,χ±s,与A组相比B组P<0.01;与B组相比C、D组P<0.01,而E、F、G组P>0.05;与C组相比D组P>0.05
2.2 天麻制剂各有效成分在大鼠偏头痛模型中对A1R表达的影响 本实验通过免疫荧光与western blot技术检测TG、TNC部位A1R的表达。与A组相比,B组大鼠TG、TNC中的A1R的表达明显偏低,差异具有统计学意义(P<0.01);与B组相比,C、D组大鼠A1R表达明显上调,差异具有统计学意义(P<0.01),而E、F、G组大鼠A1R的表达与A组相比差异无统计学意义(P>0.05);与C组相比,D组大鼠的A1R表达无明显差异(P>0.05),(见图5~图7、表2)。
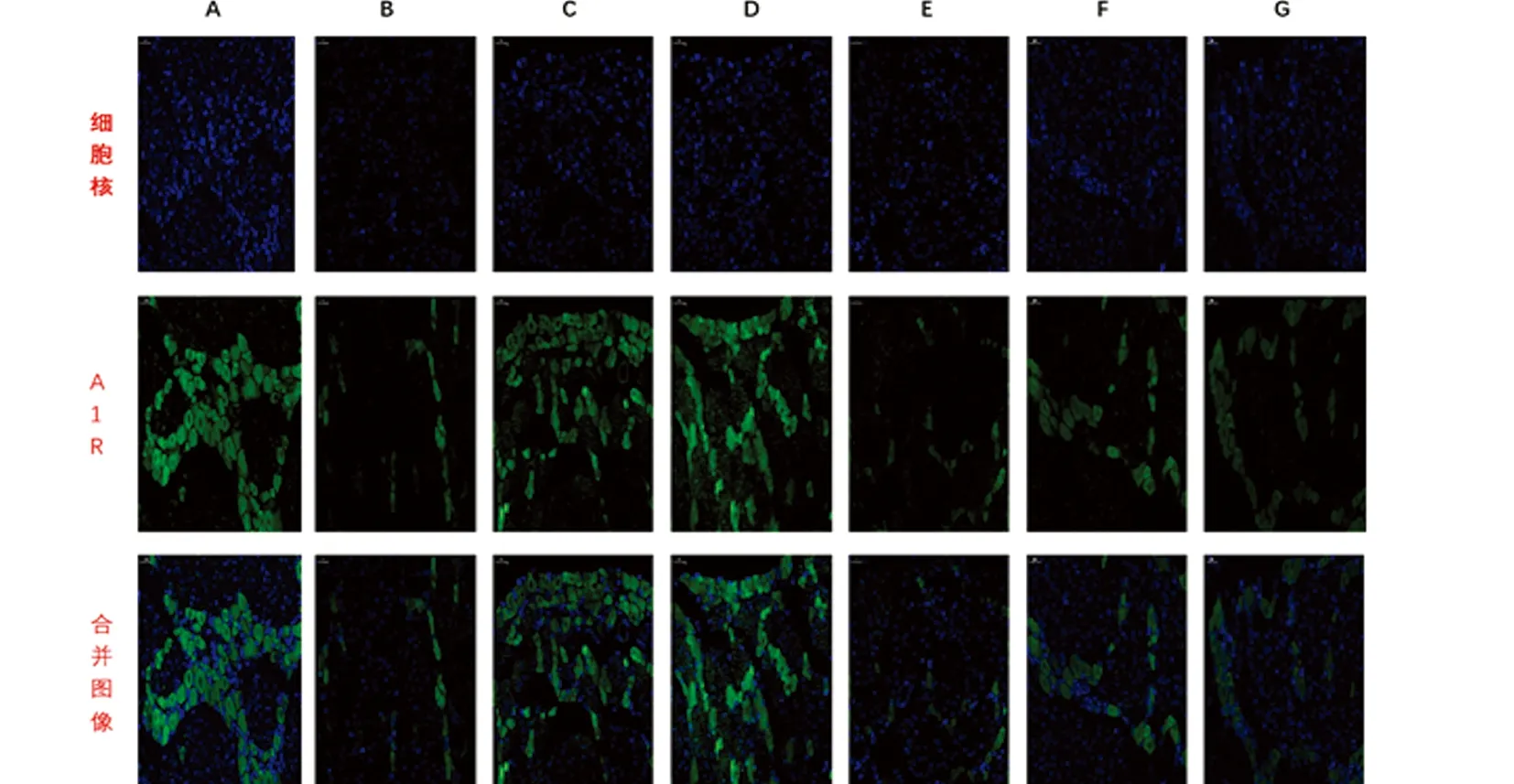
图5 免疫荧光检测各组大鼠TG中A1R的表达情况(标尺均为50 μm)
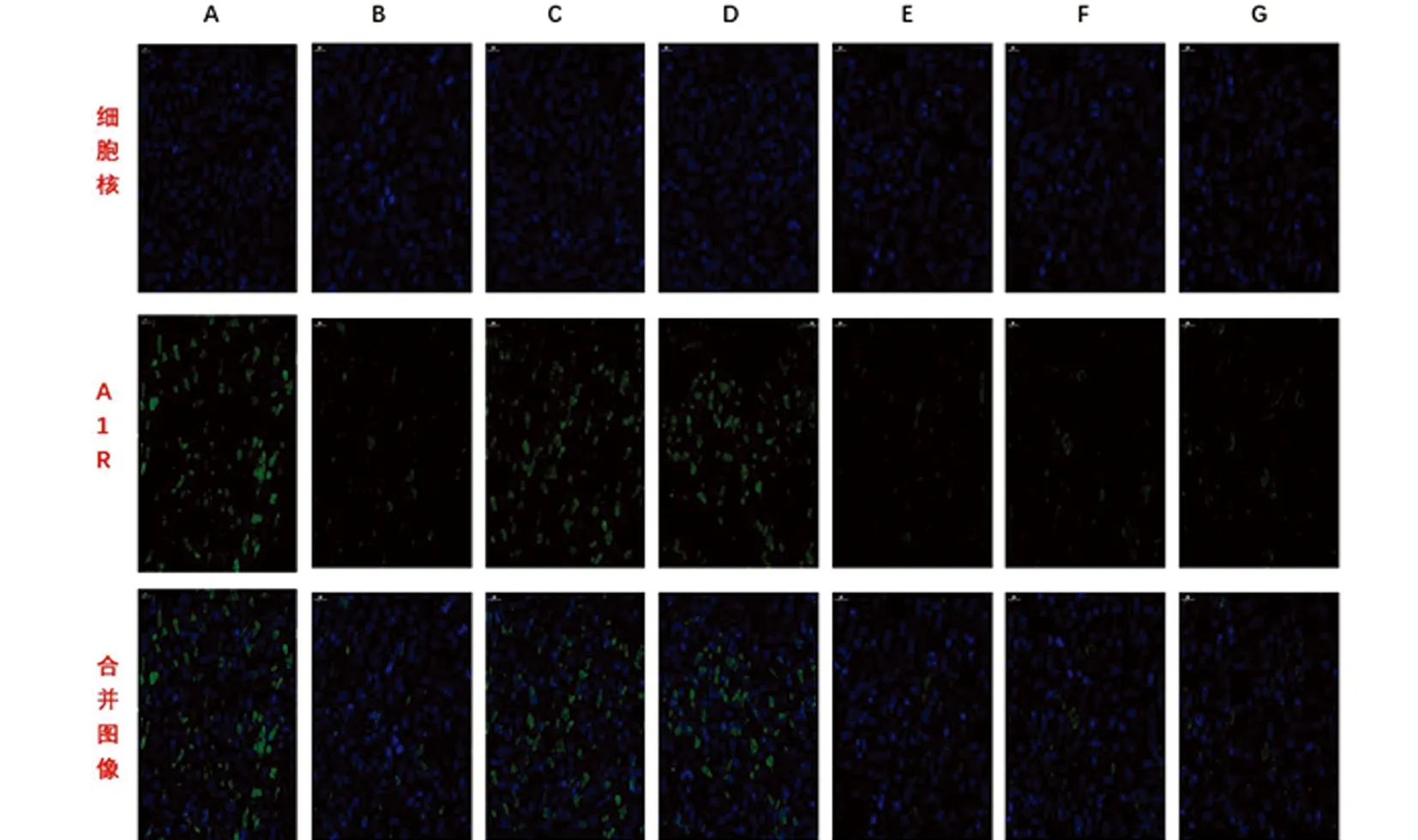
图6 免疫荧光检测各组大鼠TNC中A1R的表达情况(标尺均为50 μm)

图7 Western Blot检测各组大鼠TG、TNC中A1R的表达情况(n=6,与A组相比,B组PPP>0.05;与C组相比,D组P>0.05)

表2 各组大鼠TG、TNC中A1R的表达情况
n=6,χ±s,与A组相比B组P<0.01;与B组相比C、D组P<0.01,而E、F、G组P>0.05;与C组相比D组P>0.05)
3 讨 论
偏头痛是临床常见的原发性头痛,其发病机制中三叉神经血管反射学说中占主导地位,神经源性炎性反应及痛觉敏化是该学说的核心部分[4]:偏头痛发作时,激活的三叉神经血管系统产生一系列的神经源性炎性反应,导致TG释放CGRP增多,TNC接受来自TG的信号,汇聚在丘脑腹后内侧核神经元上,同时痛觉信号被传递到大脑皮质,从而引起典型的偏头痛发作[5~7]。CGRP在偏头痛中具有一定的特异性和敏感性,由三叉神经感觉传入纤维及TNC的激活释放,是TVS激活的生物标志物[6,8,9]。国内外研究发现偏头痛与体内的CGRP、A1R密切相关[10,11],A1R可通过对CGRP的抑制作用来缓解偏头痛急性发作,其镇痛效应十分显著且不良反应相对较少[11]。临床研究指出,曲坦类药物广泛应用于偏头痛患者,能够通过抑制CGRP的过度分泌,起到缓解偏头痛的作用[12],但因其禁用于心脑血管疾病患者,限制了其在临床中的应用[13]。研究表明,在天麻制剂主要成分中,天麻素可以显著地缓解偏头痛、血管性头痛等顽固性慢性痛[14];香英兰醇可对疼痛小鼠产生镇痛作用,对羟基苯甲醇在临床实践中对脑神经衰弱和头痛有效,而β-谷甾醇的药理具有抗炎及退热作用[15~17]。由于偏头痛患者缺乏有效的广泛适用的药物治疗方法,使得传统中药方剂(如天麻制剂)越来越受到重视。
基于神经源性炎症反应机制而建立的ESTG模型是最常用的偏头痛模型之一[18],本实验通过大鼠电刺激TG侧咀嚼肌收缩及口鼻分泌物增多来评定ESTG模型制造成功,该模型主要通过电刺激引起神经源性炎性反应,与目前较为公认的三叉神经血管反射学说相契合。本实验研究显示,与ESTG模型组相比,舒马普坦干预组与天麻素干预组大鼠TG、TNC中的CGRP表达明显降低,A1R的表达明显增高,差异具有统计学意义(P<0.01);而香英兰醇干预组、β-谷甾醇干预组、对羟基苯甲醇干预组组与ESTG模型组之间差异无统计学意义(P>0.05),推测天麻素可能是天麻制剂中的主要活性成分,可用于预防及改善大鼠偏头痛发作,而香英兰醇、β-谷甾醇、对羟基苯甲醇对偏头痛的预防及缓解作用甚微。实验显示,A1R与CGRP在TG与TNC中的表达量呈负相关关系,使用天麻素治疗后TVS中的A1R表达增多、CGRP表达减少,表明天麻素可以通过调节血管活性因子的表达,即激活的A1R在一定程度上降低TVS的激活,而减少TVS释放CGRP等相关活性物质,抑制神经源性炎性反应及痛觉敏化,故在偏头痛的治疗和预防中发挥至关重要作用。实验通过研究天麻制剂各有效成分对ESTG模型大鼠的A1R与CGRP的表达的影响,不仅证实了天麻素预防及治疗偏头痛的腺苷相关性分子机制,还有助于揭示偏头痛的病理生理过程,也为研究天麻制剂治疗偏头痛的腺苷相关性分子机制及偏头痛的发病机制提供实验基础和理论依据,随着我们对天麻制剂的进一步深入认识和研究,天麻制剂的应用前景将会更加广阔。

