不同品种谷子种子愈伤组织再生体系的建立
尹艺臻,马春英,王晓璐,王玉玲,温银元,原向阳,赵 娟
(山西农业大学农学院,山西太谷030801)
谷子(Setar italica Beauv)为一年生禾本科狗尾 草属植物,是我国的传统作物和环境友好型作物,其具有营养丰富、水分利用效率高、抗逆性强、基因组稳定等特点,是我国北方干旱、半干旱地区重要的区域性特色杂粮作物;其蛋白质、维生素、脂肪以及钙、磷、铁、硒等微量元素含量丰富,已被列入国家现代农业产业体系,在我国的粮食安全中起重要作用。同时,谷子秸秆营养较均衡,纤维素含量少,又是较好的饲料作物[1-13]。
建立稳定高效的再生体系是分子生物学相关技术在谷子上开展应用的前提条件和关键环节。关于谷子的组织培养已开展了大量的研究工作,日本学者BAN等[14]最早于20世纪70年代开始研究谷子组培,在含有2,4-D和KT的Blaydes培养基上培养谷子花药获得成功。RANGAN等[15]也成功地诱导出谷子的愈伤组织,同时获得了再生植株。VASIL[16]和MARRISH[17]研究了谷子原生质体悬浮培养和胚性愈伤组织的培养,并取得了成功。RAO等[18]用成熟胚作为外植体培养获得愈伤组织和再生植株,发现谷子不同基因型再生能力存在差异。国内学者许智宏等[19]利用谷子与狗尾草的幼穗作为外植体获得了谷子的再生植株。赵连元等[20]和刁现民等[21]在谷子原生质体和体细胞无性系的组织培养试验中均成功培养出理想材料。周俊彦等[22]用云南狗尾草×谷子(4n)的F1获得愈伤组织,并获得再生植株。张树录等[23]利用谷子的幼穗培养获得愈伤组织,并获得再生植株。许多学者以多种谷子材料(原生质体、愈伤组织、叶片、茎尖端、幼胚、成熟种子等)为外植体进行研究,均获得了大量成熟的再生植株[24-26]。王晓璐等[27]研究了不同种类植物激素及浓度配比对晋谷21号谷子种子愈伤组织的诱导与植株再生的影响。狗尾草(Setaria viridis)为谷子的近缘野生种,其组织培养和遗传转化方面的研究已获得了成功,为谷子相关研究提供了借鉴[28-29]。
有学者研究不同植物组织培养再生体系的建立中发现,不同基因型、不同外植体、不同激素种类、不同浓度配比等对其再生效率均有较大的影响[3,30-33]。谷子种子相比于现有谷子组织培养方面的报道中谷子幼穗、幼胚等外植体材料具有可储存且不受季节、地理环境和发育阶段的限制等特点,是一种较为理想的谷子再生体系建立的材料[3]。
本试验选用3个品系的6个谷子品种的种子为外植体,对培养基成分以及基因型对谷子成熟胚愈伤组织诱导和分化的影响进行了研究,旨在为遗传转化在谷子上的应用及开展谷子的相关研究工作提供一定的理论依据。
1 材料和方法
1.1 试验材料
供试材料晋谷29号、晋谷61号、张杂谷10号、张杂谷16号、冀谷39号、冀谷41号等6个品种谷子种子均由山西农业大学农学院谷子创新团队提供。
1.2 试验方法
1.2.1 外植体消毒 挑选6个谷子品种干净、饱满的成熟种子作为外植体,灭菌方法参照文献[27]进行。
1.2.2 愈伤组织的诱导 将经过灭菌处理的6个品种的谷子种子接种到附加有不同浓度2,4-D(1.0、2.0、3.0、4.0 mg/L)和 6-BA(0.2 mg/L)的愈伤组织诱导培养基上,每瓶接种7粒种子,每个处理接种10瓶,(25±1)℃下进行暗培养。接种4 d后,统计种子的萌发率;接种21 d后,统计愈伤组织的诱导率。
1.2.3 愈伤组织的分化 筛选诱导获得的优质愈伤组织接种到附加有不同浓度6-BA(1.0、1.5、2.0、2.5 mg/L)和 NAA(0.5 mg/L)的分化培养基中,每瓶接种5个愈伤组织,每个处理接种12瓶,在(25±1)℃、光照时间 15 h/d、2 000~3 000 lx光强下培养30 d,观察愈伤组织的生长和分化情况,并统计愈伤组织分化率。
1.2.4 试管苗的生根 选取生长健壮的分化苗转接到生根培养基上(MS、1/2 MS(大量和微量减半)和MS+1.0 mg/LNAA),每瓶接种5株,每个处理接种 12瓶,在(25±1)℃、2 000~3 000 lx条件下培养30 d,观察试管苗的生根情况,并统计生根率。
1.2.5 培养基情况 愈伤组织的诱导和分化以MS培养基为基本培养基;生根培养基以MS或1/2 MS(大量和微量减半)为基本培养基。所有培养基均附加蔗糖30 g/L,琼脂5 g/L,pH值为5.6~5.8。
1.3 数据分析
使用SPSS 19.0软件对数据进行多重比较和方差分析。
种子萌发率=种子的萌发数/接种的种子总数×100% (1)
愈伤组织诱导率=诱导的愈伤组织种子数/接种的种子总数×100% (2)
愈伤组织分化率=分化幼苗的愈伤组织数/诱导的总愈伤组织数×100% (3)
生根率=生根试管苗/试管苗总数×100%(4)
2 结果与分析
2.1 不同浓度2,4-D与6-BA配比对谷子种子萌发的影响
从表1可以看出,MS培养基中附加2,4-D 1.0 mg/L、6-BA 0.2 mg/L时,晋谷 29号(22.86%)、张杂谷10号(60.00%)和张杂谷16号(64.28%)谷子种子的萌发率达到最大,附加2,4-D 2.0 mg/L、6-BA 0.2 mg/L时,晋谷61号(95.71%)、冀谷39号(51.43%)和冀谷41号(82.86%)种子的萌发率达到最大。总体来看,随着2,4-D浓度的增加6种谷子的种子萌发率呈现出不同的变化趋势,说明2,4-D对谷子种子的萌发在不同品种间存在一定差异。
主体间效应检查结果表明(表2),在P=0.05水平上,不同品种对种子的萌发率具有极显著的差异,不同培养基对种子的萌发率没有显著性差异;F 值表现为品种(187.428)>培养基(1.411),表明2种因素对种子萌发率作用的主次关系为品种大于培养基。
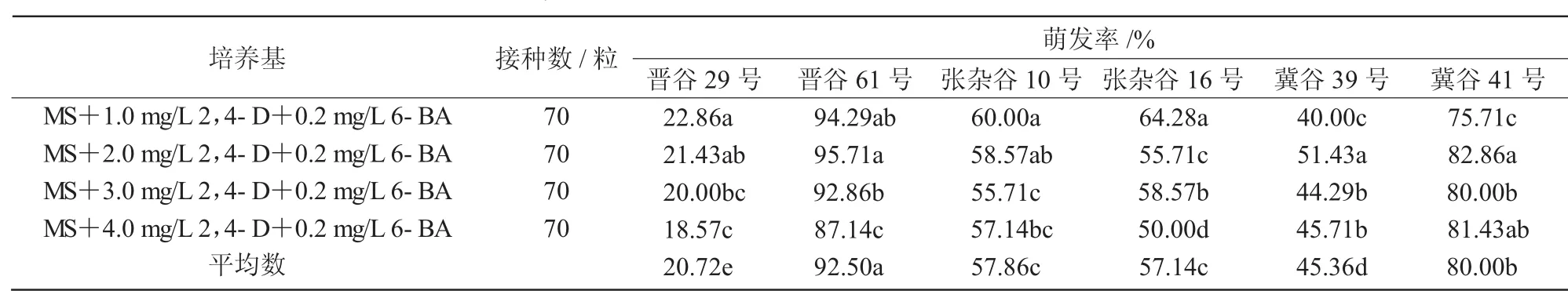
表1 2,4-D与6-BA配比对不同品种谷子萌发的影响

表2 不同品种谷子种子萌发率方差分析
2.2 不同浓度2,4-D与6-BA配比对谷子种子愈伤组织诱导的影响
将6个品种谷子种子分别接种到含有不同浓度2,4-D和6-BA配比的愈伤组织诱导培养基上,观察并比较种子愈伤组织的诱导率,结果表明(表3),6个品种的谷子种子愈伤组织诱导率在不同配比2,4-D和6-BA的培养基上呈现出不同的变化趋势,其中,MS培养基中附加2,4-D 1.0 mg/L和6-BA 0.2 mg/L时,晋谷 61号(100.00%)、张杂谷10号(60.00%)和张杂谷16号(65.71%)谷子种子的愈伤组织诱导率均达到最大,但随着2,4-D浓度的增加,这3种谷子种子的愈伤组织诱导率的变化趋势有所不同,晋谷61号愈伤组织诱导率先保持不变后降低,但愈伤组织褐化速度加快,张杂谷10号呈现出先降低再升高的趋势,张杂谷16号则随着2,4-D浓度的增加表现出先降低再增高再降低的趋势;MS培养基中附加2,4-D 2.0 mg/L和 6-BA 0.2mg/L时,晋谷29号(51.43%),冀谷39号(58.57%)和冀谷41号(84.29%)种子的愈伤组织诱导率达到最大,且随着2,4-D浓度的增加,这3种谷子种子的愈伤组织诱导率的变化趋势也有所不同,其中,晋谷29号和冀谷41号均呈现出先增高后降低的趋势,但冀谷39号则表现为先升高再降低再升高的趋势。结果表明,2,4-D浓度对谷子种子愈伤组织诱导的影响较大,浓度过高或过低都会影响愈伤组织的诱导;且不同品种谷子种子对2,4-D的浓度要求不同(图1)。
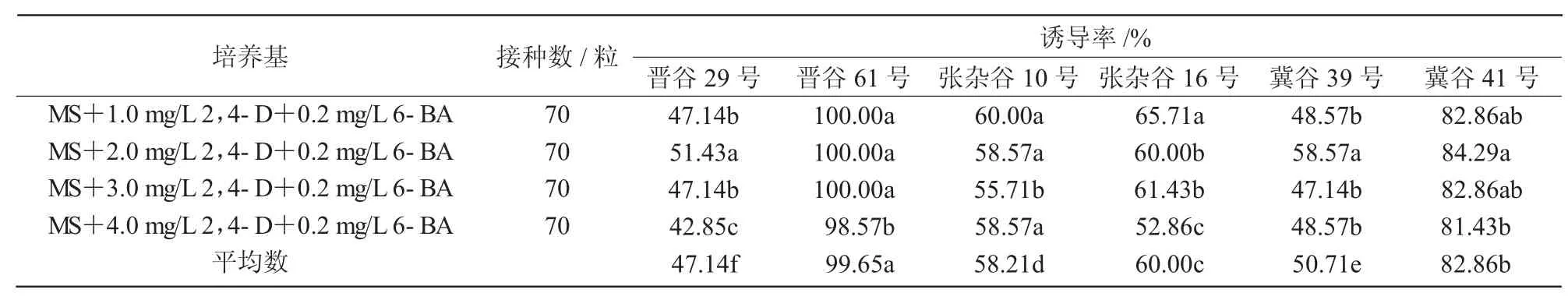
表3 不同2,4-D与6-BA配比对不同品种谷子愈伤组织诱导的影响
主体间效应检查结果表明(表4),在P=0.05水平上,谷子品种不同对种子愈伤组织诱导率具有极显著差异,培养基的不同对谷子愈伤组织诱导率没有显著性差异;F值表现为品种(183.049)>培养基(3.039),表明2种因素对谷子愈伤组织的诱导率作用的主次关系为品种大于培养基。

表4 不同品种谷子种子愈伤组织诱导率方差分析
2.3 不同浓度6-BA与NAA配比对谷子愈伤组织分化的影响
由表5可知,6种谷子愈伤组织的分化率在不同培养基和不同品种间均存在显著差异,除冀谷39号外,其他品种愈伤组织均在MS附加1.0 mg/L 6-BA、0.5 mg/L NAA的培养基上分化率达到最大,并随着6-BA浓度的增加,愈伤组织的分化率有所降低,且分化率的最大值在各品种间存在显著差异,其中,张杂谷16号分化率最高,达25.00%,晋谷29号最低,仅为3.33%;冀谷39号则在MS附加2.0 mg/L 6-BA、0.5 mg/L NAA的培养基上分化率达到最大(13.33%)(图 2)。
方差分析从主体间效应检查可以得出(表6),在P=0.05水平上,谷子品种差异对愈伤组织分化率影响具有极显著的差异,培养基差异对愈伤组织分化率影响差异不显著;F值表现为品种(13.253)>培养基(3.084),表明2种因素对谷子愈伤组织的分化率作用的主次关系为品种大于培养基。

表5 不同6-BA与NAA配比对不同种类谷子愈伤组织分化的影响

表6 不同品种谷子愈伤组织分化的方差分析
2.4 不同种类培养基对分化苗生根的影响
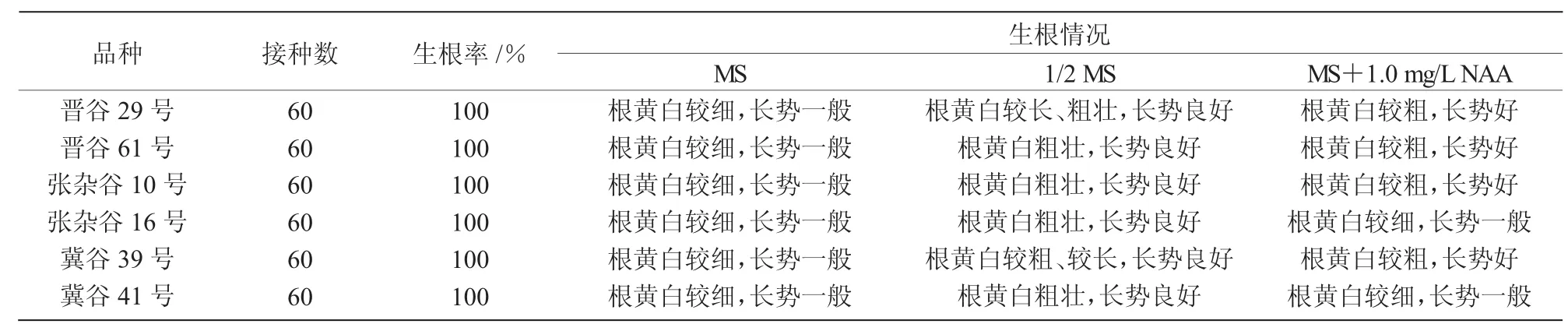
表7 不同种类培养基对分化苗生根的影响
将生长健壮的6个品种谷子试管苗分别接种到MS、1/2MS(大量和微量减半)和MS附加1.0 mg/L NAA的3种培养基上,培养21~28 d后,结果表明,试管苗在这3种培养基上均可生根,但在1/2 MS(大量和微量减半)和MS附加1.0 mg/LNAA这2种培养基较MS基础培养基诱导出的根更粗壮、试管苗的长势更好,尤其在1/2 MS(大量和微量减半)培养基上诱导出的根黄白且粗壮、试管苗生长健壮,适合移栽(表 7、图 3)。
3 结论与讨论
近几年,大量研究者开展了谷子组织培养和遗传转化的研究,谷子基因型通过其遗传学特性决定着分化机制及影响分化再生的进程,其对谷子愈伤组织诱导和再生的作用显著大于培养基成分和培养条件,是影响谷子高效再生体系建立的内因。袁进成等[3]研究了冀谷11号、豫谷2号、铁谷5号和十里香4个谷子品种成熟胚的再生能力及其影响因素,结果发现,不同品种的成熟胚诱导愈伤和愈伤分化能力不同,基因型对谷子的再生能力影响较大。RAO等[18]用成熟胚作为外植体获得了愈伤组织和再生植株,并证明谷子不同基因型再生能力存在差异。李颜方等[34]研究发现,不同谷子基因型其愈伤组织诱导率和植株再生率存在较大差异。王寒玉等[35]采用谷子茎尖作为外植体进行愈伤诱导试验,结果表明,不同基因型的谷子对2,4-D的浓度要求不同,其各自在最适的2,4-D浓度下才有较高的愈伤组织诱导效率。本试验结果表明,在所设置的各培养基中,不同品种谷子达到最高的种子萌发率(晋谷29号20.72%、晋谷61号92.50%、张杂谷10号57.86%、张杂谷16号57.14%、冀谷39号45.36%、冀谷41号80.00%)、愈伤组织诱导率(晋谷29号47.14%、晋谷61号99.65%、张杂谷10号58.21%、张杂谷16号60.00%、冀谷39号50.71%、冀谷41号82.86%)和愈伤组织分化率(晋谷29号1.25%、晋谷61号3.33%、张杂谷10号2.09%、张杂谷16号19.58%、冀谷39号7.08%、冀谷41号10.83%)均存在显著的差异;通过主体效应分析发现,谷子愈伤组织的诱导和分化在品种间存在显著差异,这与已有研究结果一致,表明基因型是影响谷子稳定高效离体再生体系建立的首要因素。
同一基因型的谷子,不同激素的种类和浓度配比对诱导出的愈伤组织质量有很大的影响。王晓璐等[27]采用晋谷21号谷子成熟种子作为外植体进行愈伤组织诱导及植株再生的试验,结果表明,在MS培养基中附加2,4-D对于愈伤组织诱导的效果优于NAA,同时加入适合浓度的6-BA可以提高愈伤组织的质量,6-BA诱导愈伤组织分化的效果优于ZT。本试验在所设置各激素配比条件下,各品种间愈伤组织诱导率差异显著,但均较高,晋谷29号诱导率最低也达到了47.14%;但各品种的分化率均较低,张杂谷16号分化率最高也仅为19.58%。可见,谷子高效再生体系建立的另一个关键在于愈伤组织分化率的提高,须通过对激素浓度配比、附加物等进行细致筛选。
谷子试管苗较易生根,ANJALI等[36]以不同浓度的萘乙酸(0、1.0、2.0、3.0 mg/L)和苄基氨基嘌呤(0、1.0 mg/L)诱导生根,结果表明,在不含植物激素的MS培养基上,继代培养10 d后生根效果最佳,MS培养基中生长素或细胞分裂素的存在完全抑制了根系的诱导。本试验中,谷子试管苗在所设置的3种培养上均可生根,但生根效果有所差别,以在不含植物激素的1/2 MS(大量和微量减半)培养基上生根黄白且粗壮,试管苗生长健壮,适合移栽,与ANJALI等[36]的研究结果基本一致。
本试验通过主体效应分析发现,谷子愈伤组织的诱导和分化在品种间存在显著差异,谷子基因型对谷子愈伤组织诱导和植株再生的影响显著大于培养基和条件,基因型是影响谷子高效再生体系建立的内因和首要因素。建立谷子高效再生体系的另一个关键因素在于提高愈伤组织分化率,须通过对激素浓度配比、附加物等影响因素进行细致筛选。谷子试管苗易生根,在不含植物激素的MS培养基上生根效果最佳。筛选适合建立稳定高效再生体系的谷子基因型及适宜培养基和条件,可有效促进相关生物技术在谷子上的应用。

