鞣花酸对红色毛癣菌细胞活力及MEP、SUB基因表达的影响
李治建 阿米娜·阿不拉 马丽


[摘要] 目的 探讨鞣花酸对红色毛癣菌细胞活力及金属蛋白酶(MEP)、枯草菌素蛋白酶(SUB)基因表达的影响。方法 实验分5组,分别为生长对照组,特比奈酚0.08 μg/mL组,鞣花酸64、128、256 μg/mL三个剂量组。药物作用红色毛癣菌7 d后,采用CCK-8测定红色毛癣菌细胞活力,采用反转录聚合酶链式反应方法检测红色毛癣菌蛋白酶MEP、SUB基因表达量。 结果 与生长对照组比较,特比奈酚0.08 μg/mL和鞣花酸64、128、256 μg/mL剂量组能明显抑制红色毛癣菌细胞活力,并能使真菌中蛋白酶MEP、SUB基因表达量下降,差异有统计学意义(P < 0.05或P < 0.01)。 结论 鞣花酸对红色毛癣菌有较强的抑制作用,可通过抑制真菌中蛋白酶MEP、SUB基因表达来發挥其抗真菌作用。
[关键词] 鞣花酸;红色毛癣菌;金属蛋白酶;枯草菌素蛋白酶
[中图分类号] R285 [文献标识码] A [文章编号] 1673-7210(2020)03(a)-0015-04
[Abstract] Objective To investigate the effect of ellagic acid on the cell activity and expression of metalloproteinase (MEP) and subtilis proteinase (SUB) genes in trichophyton rubrum. Methods The experiment was divided into 5 groups, including the growth control group, the terbinanol 0.08 μg/mL group, and the ellagic acid 64, 128 g/mL and 256 g/mL dose groups. After 7 days of drug action, CCK-8 was used to determine the cell activity of trichophyton rubrum, and reverse transcription polymerase chain reaction was used to detect the gene expression levels of trichophyton rubrum protease MEP and SUB gene. Results Compared with the growth control group, the tepinecol 0.08 g/mL and the ellagic acid 64, 128 μg/mL and 256 μg/mL dose groups significantly inhibited the cell activity of trichophyton rubrum, and decreased the expression levels of protease MEP and SUB genes in the fungi, with statistically significant differences (P < 0.05 or P < 0.01). Conclusion Ellagic acid has a strong inhibitory effect on trichophyton rubrum, and can exert its antifungal effect by inhibiting the expression of protease MEP and SUB genes in fungi.
[Key words] Ellagic acid; Trichophyton rubrum; Metalloproteinase; Subtilis proteinase
鞣花酸(ellagic acid,EA)是存在于许多蔬菜、水果和药材中的天然多酚组分,如黑莓、覆盆子、葡萄和核桃等。作为没食子酸的二聚体形式,它由具有4个羟基和2个代表亲水部分的内酯环的稠合四环结构组成,已发现EA具有多种药理特性,例如:抗癌、抗氧化、抗纤维化、抗菌、抗病毒、抗炎等药理作用[1-2]。本课题组从地锦草(Euphorbia humifusa Willd)中分离得到了鞣花酸,其具有抗皮肤真菌的作用[3-4],鞣花酸对红色毛癣菌(trichophyton rubrum)最敏感,对红色毛癣菌感染致皮肤癣菌病豚鼠具有一定的治疗作用,且能明显抑制红色毛癣菌细胞膜中甾醇14α-去甲基化酶(CYP51)酶活性、使羊毛甾醇蓄积,且有明显的剂量依赖性[5]。红色毛癣菌是最常见的引起皮肤癣菌的感染性真菌,典型特征是通过释放多种蛋白水解酶侵嗜皮肤角蛋白,并可侵入角质化的结构,例如皮肤角质层、头发和指甲,通过分解受侵组织来满足自身新陈代谢需要,尤其是基质金属蛋白酶(MEP)和枯草菌素蛋白酶(SUB)在组织入侵及控制宿主的防御机制上也起着十分重要的作用[6-8]。本研究围绕鞣花酸对红色毛癣菌细胞活力及MEP、SUB基因表达的影响,进一步探讨鞣花酸抗红色毛癣菌的作用特点。
1 材料与方法
1.1 药物及试剂
鞣花酸,南京景竹生物科技有限公司,批号:JZ13041101;盐酸特比萘芬(TBF),Sigma公司,批号:78628805;马铃薯培养基(sabouraud dextrose agar,SDA),北京奥博生物科技有限公司,批号:20150608;RPMI-1640培养基,美国Gibco,批号:31800022;3-(N-吗啡林)丙磺酸(MOPS),美国Amresco,批号:0670;二甲基亚砜(DMSO),SCIENTIFIC RESEARCH,批号:201501 02;其他试剂均为分析纯。
1.2 菌株
红色毛癣菌(trichophyton rubrum,ATCC 28188),冻存于-20℃冰箱,使用时通过NCCLS M38-A方法制备丝状真菌接种悬液[10],冻存的真菌挑取生长良好的直径约为3 mm的孢子和菌丝片段的混合物,接种到SDA培养基的斜面中央位置,在28℃下生长第7~14天后进行药敏实验。
1.3 仪器
BHC-1300ⅡA型生物安全柜,苏州安泰空气技术有限公司;FM型生化培养箱,上海福玛实验设备有限公司;DM2500显微镜,德国Leica;K5500型核酸蛋白定量仪,北京凯奥科技发展有限公司。
1.4 方法
1.4.1 鞣花酸对红色毛癣菌细胞活力的影响 实验分五组,分别为生长对照组(在96孔板相应位置加菌接种液100 μL和RPMI-1640培养基100 μL),特比奈酚0.08 μg/mL组(在96孔板相应位置加菌接种液100 μL和浓度为0.16 μg/mL RPMI-1640培养基100 μL),鞣花酸64、128、256 μg/mL三个剂量组(在96孔板相应位置分别加菌接种液100 μL和浓度为128、256、512 μg/mL的RPMI-1640培养基100 μL)。各组处理情况:将红色毛癣菌接种于SDA的斜面上,置于28℃孵育箱培养7~14 d。采用移液器的吸头尖端轻轻地挑拨菌落,将菌落悬浮在约无菌0.85%盐水中,将所得的分生孢子、孢子囊和菌丝片段的混合物转移至无菌管中。使较重的颗粒沉降3~5 min,收集上部均匀悬浮液,并用涡旋混合器混合15 s。采用血细胞计数板将分生孢子、孢子囊和菌丝片段的悬浮液的浓度调节在0.4×106~5×106 cfu/mL,用RPMI-1640培养基将其稀释50倍至2倍终浓度[9]。将调好的分生孢子、孢子囊和菌丝片段的悬浮接种液分别吸取100 μL加入相对应的微孔之内,使每1个浓度梯度的抗真菌药物及其2倍终浓度的分生孢子、孢子囊和菌丝片段的悬浮接种液分别按1∶1的比例稀释到终浓度,鞣花酸的终浓度从高向低的顺序依次为:256、128、64 μg/mL;TBF的試验终浓度由高向低依次为:0.08 μg/mL;生长对照组不加药物,仅加RPMI-1640培养基100 μL。28℃孵育7 d后严格按照CCK-8试剂盒的操作说明来处理样品,每孔加入20 μL的CCK-8溶液,按照试剂盒说明书在酶标仪上450 nm测定吸光度。
1.4.2 鞣花酸对红色毛癣菌MEP、SUB基因表达的影响 实验分5组,分别为红色毛癣菌的生长对照组,特比奈酚0.08 μg/mL组,鞣花酸64、128、256 μg/mL三个剂量组。药物干预方法同上,28℃孵育7 d后先进行5000 r/min(离心半径8 cm,下同)、10 min离心菌液,用研钵研磨液氮处理的组织样品,置于加有1 mL Trizol的离心管中,静置5~10 min;加入0.2 mL氯仿上下剧烈混匀15~30 s,然后静置3 min(冰浴);4℃,12 000 r/min离心15 min;取水相到新的EP管中,加入0.5 mL异丙醇,混匀,冰浴10 min;4℃,12 000 r/min离心10 min;倾倒上层液体,用75%冰乙醇沉淀(1 mL),混匀;4℃,12 000 r/min离心5 min;干燥。加入DEPC处理水溶解RNA,测浓度,取5 μL RNA用1%琼脂糖凝胶进行电泳,以检测RNA的完整性。反转录反应使用TAKARA公司AMV反转录酶按40 μL体系进行反转录。目的基因引物由乌鲁木齐欧意生物有限公司合成,具体序列见表1。反应体系20 μL:包括dd H2O 8.2 μL、2×Master Mix 10 μL、上下游引物0.8 μL及cDNA 1 μL,基因的PCR扩增条件:50℃预变性2 min、95℃聚合酶激活2 min、95℃变性15 s、60℃退火1 min,40个循环,72℃延伸7 min。荧光定量PCR反应体系反应后用1%凝胶电泳检测,PCR产物大小显示与理论值一致,对扩增产物进行光密度分析,与β-actin值相比并计算相对表达量。
1.5 统计学方法
采用SPSS 13.0对所得数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,采用单向方差分析(ANOVA),首先比较各组的总体平均值,统计检验水准为0.05,后进行给药组和生长对照组的多对一比较。根据方差齐性检验的结果,方差齐采用LSD方法进行统计学检验,而方差不齐采用Tamhane′s的T2方法进行统计学检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 鞣花酸对红色毛癣菌细胞活力的影响
与生长对照组比较,特比奈酚0.08 μg/mL组和鞣花酸64、128、256 μg/mL剂量组作用于红色毛癣菌后,OD值明显降低,差异有高度统计学意义(P < 0.01)。见表2。
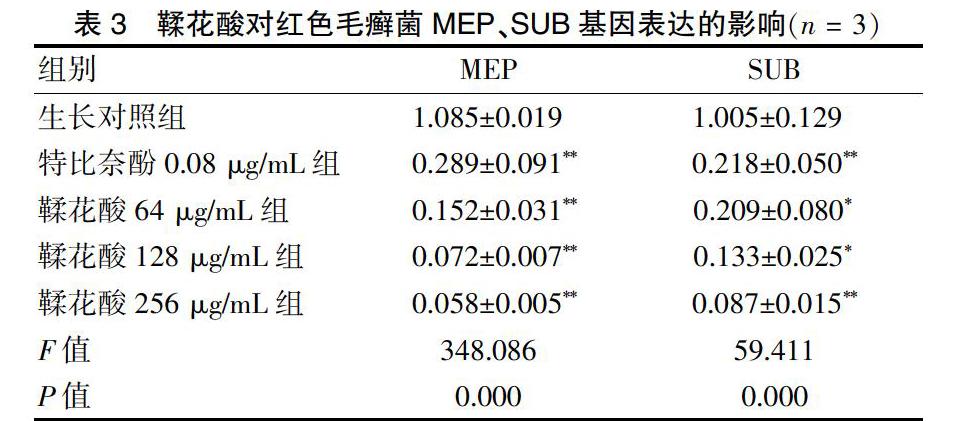
2.2鞣花酸对红色毛癣菌MEP、SUB基因表达的影响
与生长对照组比较,特比奈酚0.08 μg/mL组和鞣花酸64、128、256 μg/mL剂量组作用于红色毛癣菌后,MEP、SUB基因表达降低,差异有统计学意义(P < 0.05或P < 0.01)。见表3。
3 讨论
近年来,皮肤癣菌病作为皮肤科临床上最常见的浅表真菌感染,由于其流行病学的改变和耐药性不断增加而备受关注。目前,糖尿病患者、老年人和免疫功能低下人群的皮肤癣菌病病例数量有所增加。红色毛癣菌是最常见的皮肤癣菌病致病真菌。尽管在实践中有许多有效的抗真菌药物,皮肤癣菌病的流行率仍然没有改变,慢性和复发性真菌感染的发病率上升。有关抗皮肤癣菌药物的体外抗真菌药敏试验、体内相关性及抗真菌耐药机制亟待研究[10]。CCK-8是一种基于WST-8的广泛应用于细胞增殖和细胞毒性的快速高灵敏度检测试剂,WST-8是一种类似于MTT的化合物,在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的结晶甲瓒Formazan,细胞增殖越多越快,则颜色越深;细胞毒性越大,则颜色越浅。对于同样的细胞,颜色的深浅和细胞数目呈线性关系,利用这一特性直接用酶标仪检测Formazan含量的OD值,可以直接检测细胞活力的强弱。鞣花酸64、128、256 μg/mL剂量组作用于红色毛癣菌后对OD值具有明显降低作用,提示鞣花酸作用红色毛癣菌后,真菌细胞出现死亡,生成橙黄色的结晶甲瓒Formazan的量减少,从而导致OD值降低。以往的研究表明,鞣花酸体内外均具有一定的抗真菌作用,且对红色毛癣菌细胞膜生物合成途径有一定抑制作用,皮肤癣菌在入侵宿主组织的过程中通过释放多种蛋白水解酶分解受侵组织来满足自身新陈代谢需要,外分泌蛋白酶被认为是毛癣菌最为重要的毒力因子[6-7],并且这些蛋白水解酶在组织入侵及控制宿主的防御机制上也起着十分重要的作用[11-12]。蛋白水解酶是皮肤癣菌潜在致病毒力因子,SUB蛋白酶在真菌侵袭角化组织中起重要作用,不同病例的红色毛癣菌SUB的表达水平与临床症状的严重程度密切相关;红色毛癣菌致病力的大小可能与SUB的不同表达有关,已有7个编码SUB基因在毛癣菌中分离得到,其中SUB1、SUB3-7是皮肤癣菌特异性的致病毒力因子调控基因[13]。
具有角蛋白水解活性的角蛋白酶被認为是包括红色毛癣菌在内的浅部致病性真菌毒力因子中最为重要的一种[14-16]。M36家族的金属蛋白酶(Mep)是皮肤癣菌入侵宿主的重要毒力因子,在真菌感染过程中可能与其获得营养和扩大侵袭范围有关,在以前的研究中,从烟曲霉和米曲霉的MEP基因序列设计的引物被用于扩增棉铃虫的MEP基因,并表达了5个MEP基因(MEP1-MEP5),在体外蛋白质诱导研究中观察到这5个MEP基因在不同皮肤真菌中的表达差异,提示它们的功能和蛋白水解能力不同,MEP3在突变菌株中表现出最强的蛋白水解活性,尤其是对毛发生物降解能力和动物致病性较强[17-18]。本研究发现鞣花酸能使真菌中蛋白酶MEP、SUB基因表达量下降,可通过抑制真菌中蛋白酶MEP、SUB基因表达来发挥其抗真菌作用。
[参考文献]
[1] Wang D,Chen Q,Liu B,et al. Ellagic acid inhibits proliferation and induces apoptosis in human glioblastoma cells [J]. Acta Cir Bras,2016,31(2):143-149.
[2] Hagiwara Y,Kasukabe T,Kaneko Y,et al. Ellagic acid,a natural polyphenolic compound,induces apoptosis and potentiates retinoic acid-induced differentiation of human leukemia HL-60 cells [J]. Int J Hematol,2010,92(1):136-143.
[3] Selvadurai Muralidharan,Jaya Raja Kumar,Sokkalingam Arumugam Dhanara. Development and validation of an high-performance liquid chromatographic,and a ultraviolet spectrophotometric method for determination of Ambroxol hydrochloride in pharmaceutical preparations [J]. J Adv Pharm Technol Res,2013,4(1):65-68.
[4] Ferrell J,Sellers B,Leon R. Management of Spreading Pricklypear(Opuntia humifusa)with Fluroxypyr and Aminopyralid [J]. Weed Technol,2014,28(4):734-738.
[5] Li ZJ,Guo X,Dawuti G,et al. Antifungal Activity of Ellagic Acid In Vitro and In Vivo [J]. Phytother Res,2015, 29(7):1019-1025.
[6] Kaufman G,Horwitz BA,Duek L,et al. Infection stages of the dermatophyte pathogen Trichophyton: microscopic characterization and proteolytic enzymes [J]. Med Mycol,2007,45(2):149-155.
[7] Giddey K,Favre B,Quadroni M,et al. Closely related dermatophyte species produce different patterns of secreted proteins [J]. FEMS Microbiol Lett,2007,267(1):95-101.
[8] Liang PP,Huang XZ,Yi JL,et al. A Trichophyton Rubrum Infection Model Based on the Reconstructed Human Epidermis-Episkin [J]. Chin Med J(Engl),2016,129(1):54-58.
[9] CLSI. Reference Method for Broth Dilution Antifungal Susceptibility Testing of Filamentous Fungi;Approved Standard (M38-A)[M]. Pennsylvania:CLSI,2002.1.
[10] Rudramurthy SM,Shankarnarayan SA,Dogra S,et al. Mutation in the Squalene Epoxidase Gene of Trichophyton interdigitale and Trichophyton rubrum Associated with Allylamine Resistance [J]. Antimicrob Agents Chemother,2018,62(5):e02522-17.
[11] Zaugg C,Monod M,Weber J,et al. Gene expression profiling in the human pathogenic dermatophyte Trichophyton rubrum during growth on proteins [J]. Eukaryot Cell,2009,8(2):241-250.
[12] Sato N,Tagami H. Severe measles in a young female patient with chronic,generalized Trichophyton rubrum infection showing type2 helper T cell-dominant immunologic reactivity [J]. Am Aead Dermatol,2003,48(5Supp1):43-46.
[13] Jousson O,Léchenne B,Bontems O,et al. Secreted subtilisin gene family in Trichophyton rubrum [J]. Gene,2004,339:79-88.
[14] Okafor JI,Ada N. Keratinolytic activity of five human isolates of the dermatophytes [J]. J Commun Dis,2000,32(4):300-305.
[15] 李治建,趙明月,古力娜·达吾提,等.地锦草有效部位对红色毛癣菌细胞膜合成及MEP、SUB基因表达的影响[J].药学学报,2014,49(2):273-276.
[16] Viani FC,Dos Santos JI,Paula CR,et al. Production of extracellular enzymes by Microsporum canis and their role in its viru-lence [J]. Med Mycol,2001,39(5):463-468.
[17] Jousson O,Léchenne B,Bontems O,et al. Multiplication of an ancestral gene encoding secreted fungalysin preceded species differentiation in the dermatophytes Trichophyton and Microsporum [J]. Microbiology,2004,150(Pt 2):301-310.
[18] Zhang X,Wang Y,Chi W,et al. Metalloprotease genes of Trichophyton mentagrophytes are important for pathogenicity [J]. Med Mycol,2014,52(1):36-45.
(收稿日期:2019-09-30 本文编辑:顾家毓)

