温度和pH值条件对白鱼内源性蛋白酶活性的影响
刘小莉 王荣 王帆 崔晋 周剑忠


摘要:研究不同温度和pH值条件对白鱼内源性蛋白酶活性及其降解肌原纤维蛋白的影响。结果表明,钙蛋白酶残余活性在不同温度和pH值条件下差异较大,在温度为4、10、20、37 ℃条件下放置20 h后残余活性分别为94.5%、63.2%、43.9%、47.1%;在pH值为4.50、5.00、5.50、6.89条件下放置20 h后残余活性分别为94.62%、77.86%、31.36%、60.04%。在不同温度和pH值条件下组织蛋白酶D变化幅度次于钙蛋白酶,而组织蛋白酶B、L残余活性的差异不大。SDS-PAGE结果显示,随着温度的升高,白鱼肌肉肌球蛋白重链降解程度增加,而在pH值为5.00、5.50条件下肌球蛋白重鏈和肌动蛋白的降解均很明显。综合考虑生产实际,最佳操作环境温度为10~20 ℃、腌制液pH值为4.5。
关键词:白鱼;温度;pH值;内源酶;肌原纤维蛋白
中图分类号: TS254.4
文献标志码: A
文章编号:1002-1302(2020)02-0188-04
收稿日期:2018-10-10
作者简介:刘小莉(1981—),女,江苏泰兴人,博士,研究员,研究方向为水产品加工。E-mail:liuxljaas@hotmail.com。
通信作者:周剑忠,博士,研究员,研究方向为水产品加工。E-mail:zjzluck@126.com。
白鱼(Culter alburnus)学名翘嘴红鲌,别称翘白、白条等,隶属鲤科鲌亚科红鲌属[1],肉质鲜嫩美味而不腥,营养价值高,为鱼中上品,是我国南北水域常见的淡水经济鱼类。白鱼肉质非常细嫩[2],保鲜储运比较困难,因此白鱼的加工对扩大其消费市场尤为重要。
淡水鱼肌肉中水分含量高,蛋白丰富,宰杀僵直后鱼肉新鲜度下降与很多复杂的因素有关,除了微生物引起的腐败,还与其他生化、物理、结构方面的改变有关[3]。在加工初期或冰藏过程中通常发生由内源性蛋白酶催化的肌原纤维蛋白降解,导致肌肉软化、品质劣变等。肌原纤维和细胞外基质中重要结构蛋白的水解以及肋节和中间丝蛋白的水解,都与组织软化有关[4]。通常认为,降解肌原纤维等蛋白的系统是钙激活蛋白酶-钙蛋白酶抑制蛋白系统和溶酶体组织蛋白酶-胱蛋白抑制系统[5]。研究发现,肌肉组织蛋白降解过程中起主要作用的酶包括钙蛋白酶和组织蛋白酶B、L、D,它们可诱导宰后机体肌原纤维蛋白发生变化,对结构软化和生物活性肽释放具有很大的影响[6]。一般认为,钙蛋白酶主要在宰后储藏的早期造成有限的肌原纤维蛋白降解,而组织蛋白酶具有在后期降解肌动蛋白和肌浆球蛋白的能力。本研究以太湖白鱼为研究对象,考察加工过程中不同操作环境温度和腌制液pH值条件对白鱼肌肉中内源酶活性及其肌原纤维蛋白降解的影响,以期为白鱼的加工研究提供参考依据。
1 材料与方法
1.1 材料与试剂
主要材料为鲜活白鱼,购于江苏省南京市玄武区集贸市场,平均质量为(500±50) g/条。
主要试剂为酶活性检测试剂盒(Biovision,USA,钙蛋白酶、组织蛋白酶B、组织蛋白酶D、组织蛋白酶L测定试剂盒货号分别为K240-100、K140-100、K143-100、K142-100),其他试剂均为分析纯,购于上海化学试剂有限公司。
1.2 仪器与设备
主要设备有T25高速匀浆机(德国IKA公司)、infinite M200 PRO酶标仪(瑞士Tecan公司)、SDS-PAGE电泳仪(BIO-RAD公司)、离心机(上海精密科学仪器有限公司)、全自动数码凝胶成像系统(上海天能科技有限公司)、pH值计[梅特勒-托利多仪器(上海)有限公司]、低温恒温水浴锅(南京舜玛仪器设备有限公司)。
1.3 试验方法
1.3.1 样品处理 参照Nie等的方法[7]对白鱼肌肉中内源酶及肌原纤维蛋白进行提取:购买鲜活白鱼,30 min内带回实验室宰杀,去头尾、皮、大刺后,取背部肌肉20 g置于50 mL离心管中,加220 mL经4 ℃预冷的去离子水,12 000 r/min匀浆30 s,静置30 min后,在10 000 r/min、4 ℃下离心10 min,留上清。向沉淀中再加入20 mL水,重复提取1次,合并2次上清,得到肌浆蛋白提取液,即内源酶粗酶液。
向上述所得沉淀中加入20 mL 4 ℃预冷的 0.05 mmol/L 磷酸缓冲液(pH值=7.2)(向其中补充 0.6 mol/L NaCl),12 000 r/min 匀浆30 s,在 10 000 r/min、4 ℃下离心10 min,收集上清液。沉淀用上述步骤再重复提取1次,合并上清即为肌原纤维蛋白提取液。
1.3.2 不同处理对内源酶活性的影响
1.3.2.1 温度对内源酶活性的影响 取10 mL内源酶粗酶液置于试管中,分别在4、10、20、37 ℃条件下进行水浴,分别于水浴0、0.5、1.0、2.0、4.0、10.0、20.0 h时取样,测定酶活性;
1.3.2.2 pH值对内源酶活性的影响 采用乙酸调节内源酶粗酶液pH值至4.5、5.0、5.5,另外以不调节pH值(6、8P)的样品作为对照,在37 ℃条件下进行水浴,分别于水浴0、0.5、1.0、2.0、4.0、10.0、20.0 h取样,测定酶活性;
1.3.3 肌原纤维蛋白的降解 采用“1.3.2”节中不同温度和pH值处理后的肌浆蛋白提取液,与肌原纤维蛋白提取液按体积比1 ∶1进行混合,37 ℃水浴2 h后进行聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,简称SDS-PAGE),采用考马斯亮蓝R-250染色2 h后,用脱色液脱色过夜,观察成像。
1.4 统计分析
采用SPSS软件进行数据统计分析,结果用平均值±标准误差表示。
2 结果与分析
2.1 温度对肌原纤维蛋白降解及蛋白酶活性的影响
2.1.1 温度对内源酶残余酶活性的影响 由图1可知,与其他组织蛋白酶相比,钙蛋白酶残余活性受温度影响最大,在温度为4 ℃下存放初期(0.5 h内)残余活性有上升趋势,其他温度条件下残余活性均总体呈下降趋势,20 h后,4、10、20、37 ℃条件下钙蛋白酶残余活性分别为94.5%、63.2%、43.9%、47.1%。在4、10、20、37 ℃条件下,组织蛋白酶D活性变化幅度次于钙蛋白酶,处理20 h后残
余酶活性分别为72.6%、60.5%、55.3%、50.1%,而组织蛋白酶B、L残余活性的差异不大,处理20 h后活性范围分别为45.0~52.0%、49.0~55.0%。4 ℃低温加工条件可以明显抑制酶活性,当恢复到最适测定温度条件时测得的残余酶活性反而较其他温度条件下的残余酶活性明显增大。组织蛋白酶L也呈现类似的趋势。
2.1.2 温度对肌原纤维蛋白降解作用的电泳图谱 由图2可知,随着温度升高,肌动蛋白没有发生明显变化,但在37 ℃时,肌球蛋白重链逐渐模糊,说明肌原纤维蛋白开始降解。在4、10 ℃条件下肌原纤维蛋白未见明显的降解,说明低温加工条件能有效抑制内源酶对肌原纤维蛋白的降解作用,进一步验证了图1中4种酶的残余活性结果。温度越低,对白鱼肌肉中内源酶活性的抑制效果越好,但考虑到生产实际条件,4~10 ℃的操作环境温度不易实现,因此选择10~20 ℃ 为最佳操作温度范围。
2.2 pH值对肌原纤维蛋白降解及蛋白酶活性的影响
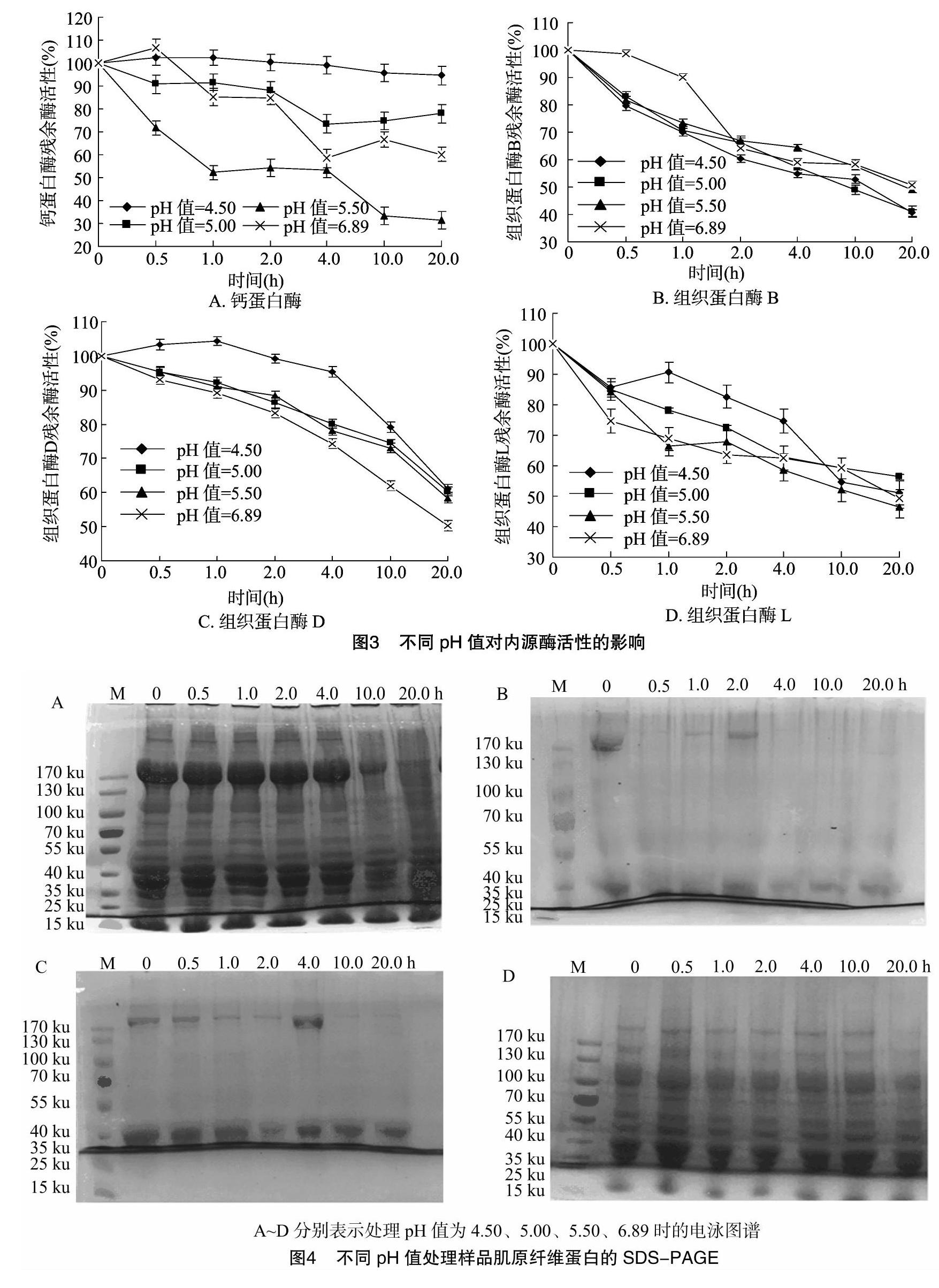
2.2.1 pH值对内源酶残余酶活性的影响 由图3可知,不同酶受pH值影响的变化趋势与温度类似,不同pH值条件下钙蛋白酶残余酶活性差异最大,在pH值为4.50、5.00、5.50、6.89条件下处理20 h后残余酶活性分别为94.62%、77.86%、31.36%、60.04%;其次是组织蛋白酶D,而组织蛋白酶B、L差异较小。钙蛋白酶最适pH值为6.9~7.5,组织蛋白酶B、L属于半胱氨酸蛋白酶,大多半胱氨酸蛋白酶的最适pH值为7.0~8.0[8],而组织蛋白酶D是一种天冬氨酸蛋白酶,其最适pH值在5.0以下[9-10]。未经过pH值调节的对照组pH值为6.89,在自然pH值条件下各种蛋白酶的活性下降相对较快。处理20 h后,B、D、L的残余活性在pH值为5.50、4.50、6.89、5.50条件下钙蛋白酶与组织蛋白酶最低。
2.2.2 pH值对肌原纤维蛋白降解作用的电泳图谱 由图4可知,在pH值为5.00、5.50条件下,肌球蛋白重链和肌动蛋白的降解均很明显,结合残余酶活性测定结果可以推断组织蛋白酶D可能是引起肌原纤维蛋白降解的主要原因。在以往的研究报道中,对肌原纤维蛋白降解具有影响的蛋白酶种类各不相同。李树红等研究了漂洗后鲢鱼鱼糜中组织蛋白酶的残留情况,认为溶酶体半胱氨酸组织蛋白酶在鲢鱼鱼糜凝胶软化中起一定作用,其中组织蛋白酶L可能是重要的蛋白水解酶[11]。钟婵等研究发现,组织蛋白酶B参与蓝圆鲹肌原纤维蛋白的降解,更可能参与在低pH值条件下鱼糜凝胶劣化[12]。
3 结论
在不同温度和pH值条件下对白鱼内源性蛋白酶残余活性及其对肌原纤维蛋白降解的情况进行研究,结果表明,低温和低pH值加工条件可以明显抑制内源性蛋白酶的活性,特别是钙蛋白酶残余活性在不同温度和pH值条件下差异较明显,其次为组织蛋白酶D,组织蛋白酶B、L残余活性的差异不大,低温和低pH值条件能明显延缓肌原纤维蛋白的降解,结合生产实际,最佳操作环境温度为 10~20 ℃、腌制液 pH值为4.5。
参考文献:
[1]陈银瑞. 白鱼属鱼类的分类整理(鲤形目:鲤科)[J]. 动物分类学报,1986,11(4):429-438.
[2]邓君明,康 斌,张 曦,等. 滇池金线鲃和白鱼鱼体营养成分分析与评价[J]. 营养学报,2013,35(6):607-609.
[3]励建荣,李婷婷,李学鹏. 水产品鲜度品质评价方法研究进展[J]. 北京工商大学学报(自然科学版),2010,28(6):1-8.
[4]Delbarre-Ladrat C,Verrez-Bagnis V,Noёl J,et al. Relative contribution of calpain and cathepsins to protein degradation in muscle of sea bass(Dicentrarchus labrax L.)[J]. Food Chemistry,2004,88(3):389-395.
[5]Ahmed Z,Donkor O,Street W A,et al. Calpains- and cathepsins-induced myofibrillar changes in post-mortem fish:impact on structural softening and release of bioactive peptides[J]. Trends in Food Science and Technology,2015,45(1):130-146.
[6]Gaarder M O,Bahuaud D,Veiseth-Kent E,et al. Relevance of calpain and calpastatin activity for texture in super-chilled and ice-stored Atlantic salmon (Salmo salar L.) fillets[J]. Food Chemistry,2012,132(1):9-17.
[7]Nie X,Lin S,Zhang Q. Proteolytic characterisation in grass carp sausage inoculated with Lactobacillus plantarum and Pediococcus pentosaceus[J]. Food Chemistry,2014,145:840-844.
[8]張娅楠,赵 利,袁美兰,等. 水产品加工中蛋白酶的应用进展[J]. 食品安全质量检测学报,2014,5(11):3705-3710.
[9]Jiang S T. Effect of proteinases on the meat texture and seafood quality[J]. Food Science and Agricultural Chemistry,2000,2(2):55-74.
[10]Shahidi F,Kamil Y V A J. Enzymes from fish and aquatic invertebrates and their application in the food industry[J]. Trends in Food Science and Technology,2001,12:435-464.
[11]李树红,张 楠,刘 欢,等. 鲢鱼背肌肌原纤维蛋白自溶与内源组织蛋白酶B、L、H的关系[J]. 中国农业大学学报,2004,9(5):71-75.
[12]钟 婵,沈建东,蔡秋凤,等. 蓝圆鲹肌肉组织蛋白酶B的纯化与性质分析[J]. 食品工业科技,2012,33(10):108-112.樊玉花,瞿素萍,王珍珍,等. 香味茶花远缘杂交亲本云南核果茶(Pyrenaria yunnanensis Hu)香气成分分析[J]. 江苏农业科学,2020,48(2):192-196.

