酶法制备壳寡糖工艺优化及抗氧化能力分析
朱恒 王超 张一驰


摘 要:以壳聚糖为制备原料,利用壳聚糖酶水解壳聚糖来制备壳寡糖。通过单因素试验结果分析可以得出反应时间、壳聚糖酶添加量、温度、pH等4个因素对酶解作用的影响。采用正交法设计4因素3水平的试验,将壳寡糖产率作为检测结果,做正交试验分析,优化工艺条件,从正交分析结果得到最佳工艺条件如下:反应时间4h、酶添加量2000U/g、温度35℃、pH5.0。通过验证试验可以得到最佳工艺条件下还原糖浓度最高,即壳寡糖的产率最高,为1.884%。利用壳寡糖对清除羟自由基的能力试验和还原能力试验,验证了壳寡糖具有一定的抵抗人体氧化衰老的能力。
关键词:壳聚糖酶;壳寡糖;正交试验;抗氧化
中图分类号 TS201.3文献标识码 A文章编号 1007-7731(2020)06-0028-05
Abstract: In this experiment, chitosan was used as a raw material to prepare chitosan oligosaccharides by using chitosanase to hydrolyze chitosan. Observing the results of single factor experiments, we can conclude that the reaction time, the amount of chitosan enzyme, temperature, and pH affect the enzymatic hydrolysis. The orthogonal experiment was used to design the four-factor three-level experiment. The chitosan oligosaccharide yield was taken as the test result. The orthogonal experimental analysis was conducted to optimize the process conditions. The optimum process conditions from the orthogonal analysis results were as follows: reaction time 4 h, enzyme Adding amount 2000 U/g, temperature 35℃, Ph5.0. Through verification experiments, the highest concentration of reducing sugars can be obtained under the optimal conditions, that is, the highest yield of chitosan oligosaccharides is 1.884%. Experiments using the ability of chitosan oligosaccharides to scavenge hydroxyl radicals and experimental studies of reducing power have demonstrated that chitooligosaccharides have a certain ability to resist oxidative aging in humans.
Key words: Chitosanase; Chitosan oligosaccharide; Orthogonal test; Antioxidation
壳寡糖(Chitosan oligosaccharide),又名寡聚氨基葡糖、甲壳低聚糖,是2~10个氨基葡萄糖通过β-1,4糖苷键连接起来的小分子聚合物[1]。壳寡糖是壳聚糖的水解产物,其在水中的溶解度好,生物可利用度高,具有独特的生理活性和功能,现已广泛应用于食品、生物医药和化妆品中[2-3]。壳寡糖具有一定的还原性,由于还原能力越强,抗氧化衰老的能力就越强,使得其具有较强的抗氧化活性。壳寡糖抗氧化性的应用广泛,目前已在动物饲料和食品安全,蔬果的贮藏和保鲜以及医药保健等方面发挥着重要的作用,尤其是在生物医药与保健领域。由于壳寡糖具有良好的抗氧化活性,为其在降脂、降糖以及肝功能保护方面提供了良好的应用前景[4]。但由于当前壳寡糖在制备方面还没有多大的突破,产量过低,从而导致价格过高,因此,提高其制備产量的方法已成为了国内外研究和开发的热点。
目前,对壳聚糖的降解方法大致分为酸降解法、酶降解法和氧化降解法3大类[5]。其中,酸降解法的工艺繁琐,反应产物单糖较多,壳寡糖产率较低,并且不易操作控制,对环境具有一定的污染;酶降解法反应条件温和,无其他副反应,易操作控制,是工业化制备壳寡糖最具前景的方法。酶降解法一般可分为非专一性酶降解和专一性酶降解[6,8],其中非专一性酶包括脂肪酶、纤维素酶[7]等对壳聚糖的降解不充分,对酶的消耗量大,产物复杂且很难分离;专一性酶包括壳聚糖酶、甲壳质酶等的反应条件适宜,容易调控,是一种很好的壳寡糖制备方法。壳聚糖经壳聚糖酶降解后生成壳寡糖,壳聚糖酶在降解壳聚糖多聚物,大规模生产壳寡糖中发挥着重要的作用[9-13]。
本试验以壳聚糖作为原料,对其进行酶解制备壳寡糖,通过单因素试验和正交试验的结果构建制备壳寡糖工艺条件的数学模型,由此得出优化的最佳工艺条件组合,再利用壳寡糖对清除羟自由基的能力的试验和其还原能力的试验来考察其抗氧化能力。
1 材料与方法
1.1 材料与试剂 壳聚糖(脱乙酰度80%),北京中生瑞泰科技有限公司生产;壳聚糖酶(酶活力40000U/g),诺维信生物科技有限公司生产;三氯乙酸(分析纯),上海展云化工有限公司生产;D-氨基葡萄糖,SIGMA公司生产;氢氧化钠、无水亚硫酸钠、乙酸钠、乙酸、3,5-二硝基水杨酸、苯酚、铁氰化钾、磷酸二氢钾等,国药集团化学试剂有限公司生产。
1.2 仪器 DL-5低速大容量离心机,上海安亭科学仪器厂生产;旋转蒸发器RE-52A,上海亚荣生化仪器厂生产;紫外-可见分光光度计,上海菁华科技仪器有限公司生产;DK-S22型电热恒温水浴锅,上海精宏实验设备有限公司生产;电热鼓风干燥箱,上海一恒科学仪器有限公司生产;电子天平,上海海康电子仪器厂生产。
1.3 试验方法
1.3.1 还原糖标准曲线的绘制 参照刘玥等[14]的方法进行DNS试剂和氨基葡萄糖标准液(1.0mg/mL)的配制,得到标准曲线如图1所示。回归方程为:y=0.7155x-0.0265,R2=0.9981,作为定量分析的标准曲线。
1.3.2 壳寡糖的制备 精密量称量2.0g的壳聚糖于500mL烧杯中,加入一定量的乙酸-乙酸钠缓冲溶液(0.2mol/L),搅拌形成胶体溶液,固定底物浓度为2%(w/v),再加入一定量的壳聚糖酶酶解壳聚糖。通过加入缓冲溶液的体积不同,可以使烧杯中溶液置于不同pH值下。分别在不同温度、不同pH、不同酶添加量下酶解一段时间,之后迅速把酶解液置于100℃沸水中,保持5min使酶灭活,然后离心取上清液,测出上清液中的还原糖浓度,计算壳寡糖的产率,然后将上清液过滤纯化,使用旋转蒸发仪浓缩过滤液,当浓缩掉2/3过滤液后,将剩余的过滤液使用无水乙醇洗涤后,烘干得到壳寡糖。
1.3.3 还原糖含量的检测 酶解液中还原糖含量的测定方法与上述标准曲线的制定方法一致,将氨基葡萄糖标准溶液改为待测样品,其他步骤不变,得到相应的还原糖浓度。壳寡糖提取率的计算公式如下:
壳寡糖产率(%)=还原糖含量/壳聚糖含量×100
1.3.4 清除羟基自由基的能力测定 取5支试管,编号为1~5,准确量取0.2mL的FeSO4-EDTA混合液(10.0mmol/L)加入到每支试管中,并再分别向每支试管加入0.5mL的2-脱氧核糖溶液(10.0mmol/L)、0.5mL磷酸缓冲液(0.1mol/L pH7.4)、0.2mL的H2O2溶液(10.0mmol/L)和0.6mL一定浓度的壳寡糖溶液(浓度梯度分别为0.2mg/mL、0.4mg/mL、0.6mg/mL、0.8mg/mL、1.0mg/mL),混合均匀,放入37℃水浴锅中水浴1h后,向每支试管加1.0mL的2.8%(w/w)三氯乙酸溶液,在离心速度为4000r/min和离心温度4℃条件下离心20min,均量取上清液2.0mL相对应的放入编号①~⑤的试管中,向编号①~⑤的每支试管加入1.0mL的1.0%(w/w)硫代巴比妥酸溶液后,混合均匀,在沸水中水浴15min,冷却后稀释5倍,将可见紫外分光光度计的波长调为532nm,分别测出编号①~⑤的每支试管溶液的吸光度。羟自由基清除率的计算公式如下:
清除率(%)=(Ac-As)/(Ac-A0)×100
式中:Ac:不加壳寡糖的吸光度;As:加壳寡糖的吸光度;A0:试剂空白的吸光度。
1.3.5 还原能力的测定 准确量取0.6mL 200mmol/L的pH6.6磷酸缓冲溶液加入到烧杯中,再分别加入0.6mL一定浓度的壳寡糖溶液(浓度梯度分别为0.2mg/mL、0.4mg/mL、0.6mg/mL、0.8mg/mL、1.0mg/mL)和2.5mL 1%铁氰化钾(质量分数为1%),混合均匀,在50℃水浴锅中水浴20min,快速冷却,加入0.6mL三氯乙酸(质量分数为10%),在离心速度为4000r/min和离心温度4℃条件下离心10min,量取上清夜1mL,分别加入1mL的水和0.2mL三氯化铁(质量分数为0.1%),混匀后静置10min,将可见紫外分光光度计的波长调为700nm,测定吸光度。
2 结果与分析
2.1 单因素试验结果
2.1.1 温度对酶解制备壳寡糖效果的影响 在酶浓度为1600U/g,反应时间2h,pH5.4的酶解条件下,得到壳聚糖酶在不同温度下水解壳聚糖的效果,结果如图2所示。从图2可以看出,还原糖浓度随温度的上升而呈现出先增加后减少的趋势。其中,在30~35℃,还原糖浓度随温度的上升而缓慢增加;在35~40℃,还原糖浓度随温度的上升而急剧增加,且在40℃还原糖浓度达到最高;当温度高于40℃,还原糖浓度开始下降,且随着温度的持续增加,还原糖浓度越来越低。因此,溫度在40℃左右时,制备壳寡糖的效果最好。该酶在酶添加量1600U/g,反应时间2h,pH5.4的酶解条件下的最适温度为40℃。其原因可能是随温度的不断增加,酶的活性也随之增加,酶解的速率加快,提高了还原糖浓度。而当温度高于40℃时,酶的活性开始出现下降趋势,导致还原糖浓度下降。
2.1.2 pH对酶解制备壳寡糖效果的影响 在酶浓度为1200U/g,反应时间2h,温度40℃的酶解条件下,得到壳聚糖酶在不同pH下水解壳聚糖的效果,其结果如图3所示。从图3可以看出,还原糖浓度随pH的增加而呈现出先上升后下降的趋势。其中,在pH3.8~4.2,还原糖浓度随pH的上升而缓慢增加;在pH4.2~5.0,还原糖浓度随pH的上升而急剧增加,并且在pH5.0时还原糖浓度达到最高;当pH超过pH5.0,还原糖浓度开始逐渐下降。因此,pH在5.0左右的范围,酶解效果较好。这说明,pH对酶解制备壳寡糖效果具有极显著的影响,并且壳聚糖酶降解的最适pH为5.0。其可能原因是随pH的增加且未到达最适pH之前,酶活性逐渐增加,反应速率加快;当pH过高,超过最适pH,酶的活性开始下降直至酶失活,酶解速率下降。
2.1.3 反应时间对制备壳寡糖酶解作用的影响 在酶浓度1600U/g,pH5.0,温度40℃的酶解条件下,得到壳聚糖酶在不同反应时间下水解壳聚糖的效果,其结果如图4所示。从图4可以看出,随着反应时间的增加,还原糖浓度也逐渐增加,在1~3h范围内还原糖浓度上升速率较快,而在3~4h范围内上升缓慢,在酶解4h时,降解效果最好,还原糖浓度升到最高,随着酶解时间的不断增加,还原糖浓度有小范围的下降。因此,酶解时间4h为最优选择。
2.1.4 酶添加量对制备壳寡糖酶解作用的影响 在反应时间2h,pH5.0,温度40℃的酶解条件下,得到壳聚糖酶在不同壳聚糖酶浓度下水解壳聚糖的效果,其结果如图5所示。所用壳聚糖酶酶活性为40000U/g,固定底物浓度为2%(w/v),改变壳聚糖酶用量观察酶浓度对酶解效果的影响。从图5可以看出,在400~800U/g,还原糖浓度变化不明显,有缓慢上升;在800~2000U/g,还原糖浓度上升较快;当酶添加量超过2000U/g时,还原糖浓度开始有小范围的下降。由此可见,酶添加量对制备壳寡糖的酶解效果产生了影响,可能的原因是当酶添加量没有达到酶与底物的结合饱和之前,随酶添加量的增加,酶解的反应速率也会加快,还原糖浓度升高,当酶与底物的结合达到饱和后,无论酶添加量再如何增加,还原糖浓度也不会增加。
2.2 正交试验及结果
2.2.1 正交试验设计 根据上述单因素的分析结果,选择温度、反应时间、壳聚糖酶添加量、pH4个因素作为考察因素,各取3个水平,进行[L9]([34])正交试验设计,优化酶解工艺条件,不考虑各因素间的相互影响,正交試验因素水平表如表1所示。
2.2.2 正交试验结果 在单因素试验的基础上,通过正交实验结果分析可得出不同水平的温度、pH、反应时间、酶添加量的组合对壳聚糖酶降解壳聚糖的降解效果不同,其结果见表2。从表2可以看出,在正交试验的9组不同因素组合的实验中,A2B1C2D3组合的酶解效果最好,其酶解液中的还原糖浓度最高。并且由极差结果分析可知影响酶解壳聚糖效果的因素为pH>酶添加量>反应时间>温度。由均值1、均值2、均值3联合分析可知,利用壳聚糖酶降解壳聚糖制备壳寡糖的最优工艺组合为A1B1C2D2,即温度35℃、pH5.0、酶添加量2000U/g、反应时间4h。
对上述正交试验数据进行方差分析,可得方差分析结果如表3所示。从表3可以看出,pH对壳聚糖的酶解效果有着极强的显著性,说明pH对壳聚糖酶法降解的影响极其显著;而壳聚糖酶浓度对壳聚糖的酶解效果有显著性,但不是很强,说明壳聚糖酶浓度对壳聚糖酶法降解的影响显著,但无法与pH相比,温度和反应时间对壳聚糖的酶解效果都无显著性,说明温度和反应时间对壳聚糖酶法降解有一定的影响,但影响较小。
2.3 验证试验 根据正交试验得到的壳聚糖酶法降解的最优工艺条件,与实际可操作条件结合,选取温度35℃,壳聚糖酶浓度2000U/g,反应时间4h,pH5.0条件进行3次平行试验,其结果见表4。从表4可以看出,在上述正交试验结果分析得出的最优的酶解工艺组合A1B1C2D2下,还原糖浓度为0.379mg/mL,壳寡糖产率为1.884%,高于正交试验的第4组实验A2B1C2D3的还原糖浓度0.352mg/mL,且产率稳定,验证了实验的可行性和可重复操作性。
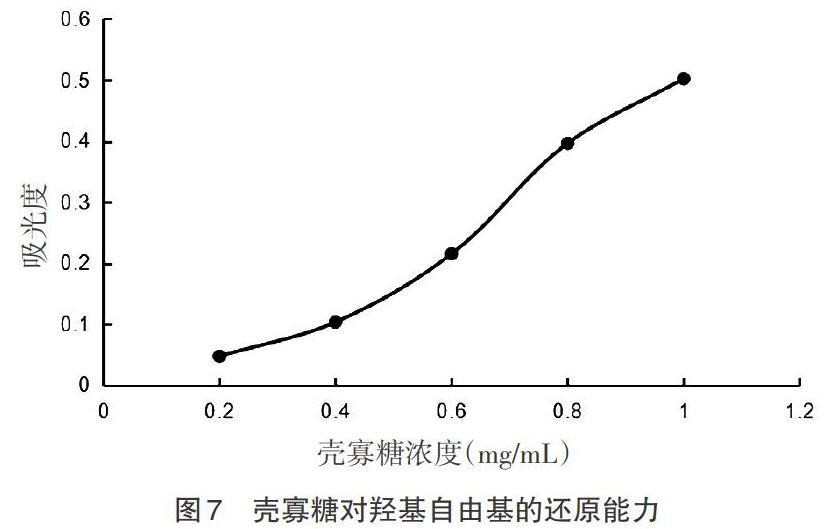
2.4 抗氧化试验 不同浓度的壳寡糖对羟基自由基的清除活性和还原能力如图6和图7所示。从图6可以看出,壳寡糖对羟基自由基具有一定的清除效果,并且清除效果随壳寡糖浓度的上升而不断增强,且呈现一定的剂量效应关系。当壳寡糖浓度为1mg/mL时,清除率为51.52%。
还原能力表示的是抗氧化物质提供电子能力的重要指标[19],可提供可阻断二价铁离子向三价铁离子转变的电子,使自由基变成稳定的物质。因此,可以通过显色反应来判断还原程度,反应后吸光度越大,还原能力越强,抗氧化能力也越强[20]。从图7可以看出,在一定的壳寡糖浓度范围内,壳寡糖的还原能力随着浓度的增加而增大,也进一步说明了壳寡糖具有一定的抗氧化活性。
3 结论
本研究以温度、pH、壳寡糖酶添加量、反应时间为因素,分析了酶解壳聚糖制备壳寡糖的最佳工艺条件。根据单因素试验结果,将温度、pH、壳寡糖酶添加量、反应时间作为考察因素,进行正交试验。由正交试验结果分析可以得出,酶添加量和pH均对酶解壳聚糖制备壳寡糖产生了较大的影响,其中pH的影响最为显著;影响酶解效果的因素主次依次为:pH>酶添加量>反应时间>温度;利用壳聚糖酶降解壳聚糖制备壳寡糖的最优工艺组合为A1B1C2D2,即温度35℃、pH5.0、酶添加量2000U/g、反应时间4h。在此条件下,对最优工艺组合进行验证,证实了优化工艺是合理的,具有可重复操作性。另外,为了研究酶解壳聚糖制备的壳寡糖的体外抗氧化活性,通过其对羟基自由基的有一定的清除能力和还原能力,表明壳寡糖具有一定的抗氧化衰老能力。
参考文献
[1]陈海燕,张彬,何勇松,等.壳寡糖的研究进展和应用前景[J].广东畜牧兽医科技,2007,32(2):17-20.
[2]韩永萍,林强.低聚壳聚糖制备及其生理活性进展[J].化学工业与工程,2007,24(3):272-276 .
[3]魏新林,夏文水.甲壳低聚糖的生理活性研究进展[J].化学工业与工程,2003,19(6):614-617.
[4]钟佳,刘进辉,肖定福,等.壳寡糖及其衍生物的抗氧化活性[J].动物医学进展,2015,36(7):118-121.
[5]孙长华,王静.低分子量壳聚糖制备与应用[J].粮食与油脂,2004(1):44-46.
[6]毛新,赵力超,刘晓娟,等.非专一性酶酶解壳聚糖的最佳工艺研究[J].现代食品科技,2010,26(4):392-395.
[7]谢雨,胡立明.非专一性酶纤维素酶降解壳聚糖的研究[J].河南工业大学学报,2008,29(3):47-50.
[8]Cheng C Y,Li Y-K.An Aspergillus Chitosanase with Potential for Large-scale Preparation of Chitosan Oligosaccharides[J]. Biotech-nol Appl Biochem,2000,32:197-203.
[9]夏秋瑜,黄艳,刘四新,等.酶法制备壳寡糖研究现状[J].保鲜与加工,2003,33(2):7-9.
[10]单晓雪,郑人源,张涛,等.壳聚糖酶的研究进展[J].成都医学院学报,2017,2:3-4.
[11]王振伟,申森.超声波辅助酶法制备壳寡糖及抗氧化活性研究[J].中国食品添加剂,2014,(4):70-75.
[12]张立彦,曾庆孝,李作为.溶菌酶降解壳聚糖条件的研究[J].功能高分子学报,2004,17(3):391-395.
[13]孙婷,余晓斌,李淑瑞.纤维素酶水解壳聚糖条件的研究[J].中国酿造,2009,209(8):34-37.
[14]刘玥,刘晓兰,周利敏,等.DNS法测定D-氨基葡萄糖含量方法的研究[J].中国调味品,2014,39(10):89-93.
(责编:张宏民)

