萆薢分清丸联合别嘌醇治疗痛风患者高尿酸血症的临床疗效和安全性
张卓君 孙 颖 杨晓凌 曹烨民 韩贺东 贺 佳 何东仪 姜林娣△
(1复旦大学附属中山医院风湿免疫科 上海 200032;2上海市光华中西医结合医院风湿病科 上海 200052;3上海中医药大学附属上海市中西医结合医院脉管科 上海 200082;4中国人民解放军海军军医大学卫生统计学教研室 上海 200433)
痛风是尿酸盐结晶沉积在关节滑膜、滑囊、软骨及其他组织中引起的反复发作性炎性疾病,其根本病因是高尿酸血症。因此,痛风治疗的关键是控制血尿酸水平。萆薢分清丸的处方来源于久经验证的古方《丹溪心法》,全方由萆薢、益智仁、石菖蒲、乌药等组成,功效温肾补脾,分清泌浊,是治疗急慢性泌尿系统疾病的著名验方。现代药理研究证明,其有抗菌、消炎、利尿、解痉止痛、提高免疫等作用[1-4]。文献报道萆薢分清丸具有降低血尿酸的作用,服用萆薢分清丸(每天2次,每次9 g)与别嘌醇(每天 1次,每次 100 g)疗效相当[5]。本研究以萆薢分清丸联合别嘌醇用于治疗痛风,观察萆薢分清丸是否具有降低血尿酸的作用,及其联合别嘌醇是否能改善临床症状。
资料和方法
研究设计本研究采用多中心、随机、双盲、安慰剂平行对照的试验设计,计划入组72例痛风患者,分为试验组(36例)和对照组(36例),评价萆薢分清丸联合别嘌醇治疗痛风患者高尿酸血症的有效性及安全性。该研究通过复旦大学附属中山医院、上海市光华中西医结合医院、上海中医药大学附属上海市中西医结合医院伦理委员会批准(批件号:B2016-048、2017-Y-03-03、2016-018-1)。
研究对象本研究纳入2016年11月至2017年9月在复旦大学附属中山医院(中心1)、上海市光华中西医结合医院(中心2)、上海中医药大学附属上海市中西医结合医院(中心3)就诊的痛风患者72例,区组随机分为试验组36例和对照组36例。中心1试验组和对照组各20例,中心2试验组和对照组各14例,中心3试验组和对照组各2例。
入组标准 年龄18~65岁,性别不限;符合1997年美国风湿病学会(ACR)原发性痛风诊断标准,并伴高尿酸血症者;血尿酸≥8.0 mg/dL;自愿参加并签署知情同意书。
排除标准 由肾脏疾病、血液疾病、服用药物、肿瘤放化疗等原因引起的继发性痛风;处于痛风性关节炎急性发作期;由类风湿关节炎、银屑病关节炎、骨肿瘤等引起关节病变;合并严重肺部、心血管、血液和造血系统、中枢神经系统或其他系统疾病;合并恶性肿瘤;谷丙转氨酶或谷草转氨酶高于正常范围上限值1.5倍;血肌酐高于正常范围上限值;在过去3个月内曾进行性激素替代疗法和口服避孕疗法;服用强的松超过10 mg/d或其他等效糖皮质激素;血白细胞计数<4.0×109/L;血小板计数<100×109/L;血红蛋白<90 g/L;有酗酒史或滥用药物史;过敏体质及对别嘌醇或萆薢分清丸任何成分过敏;妊娠、哺乳期妇女或近期有生育计划;入选前3个月内参加过其他临床试验;研究者判断为不适合入组。
研究者决定的退出 在试验过程中出现下列情况之一时,研究者可决定受试者是否退出试验:破盲或紧急揭盲;实验室指标出现以下任一情况,即谷丙转氨酶或谷草转氨酶高于正常上限5倍,血肌酐大于正常值上限2倍,血白细胞计数<3.0×109/L,血小板计数<80×109/L,经复查核实后应立即停药及终止试验;尿蛋白出现++或+++时,应加做24 h尿蛋白定量,再判断是否停药;试验中病情恶化,必须采取紧急措施;发生严重合并症或并发症,不适宜继续接受试验;可能发生或已经出现严重不良事件;无法判断有效性或资料不全等影响有效性或安全性判断;依从性差(服药量<80%或>120%)或未按规定用药。
受试者自行退出试验 受试者有权中途退出试验,或受试者不再接受用药及检测而失访,则视为“退出”。
剔除标准 误纳;试验过程中非正常破盲;资料不全,影响有效性和安全性判断;依从性差;试验期间同时服用可能影响疗效评价的其他药物及使用试验禁忌药物。
随机方法使用SAS统计软件对72例受试者进行分层区组随机化,获得随机数字和试验药物包装表。
盲法设计
编盲和盲底保存 与本试验执行数据管理统计分析无关的统计师在计算机上用SAS 9.2统计软件包,两组按照1∶1的比例用分层分段随机化方法产生随机编码,所选择的block长度和种子数等参数作为保密数据一起密封在盲底中。盲底一式两份密封保存在申办方和主要研究者所属的国家药物临床试验机构。
紧急揭盲 在药品编盲的同时,由产生盲底的统计师为每个药物编号准备一份应急信件。信件内密封保存该药物编号的确实组别,应急信件随相应编号的药物发往各个中心,由该中心研究负责人保存。如发生严重不良事件需要紧急揭盲时,由该中心研究者负责人拆阅相应药物编号的应急信件。应急信件一经拆阅,该病例即作脱落处理。
揭盲 双盲试验部分采用二次揭盲法:经盲态核查后锁定数据,由保存盲底的工作人员第一次揭盲,只给出每个药物编号的所属组别(用A、B两组表达);待统计分析报告、临床试验总结报告完成后,再行第二次揭盲,指明A、B两组分别为哪一个组(试验组或对照组)。
治疗方法
本试验分清洗期和治疗期两个阶段,对于符合入排标准且近2周内未服用过别嘌醇的受试者,不需要经过清洗期可直接进入治疗期,若近2周内曾服用过别嘌醇的受试者,需停药后经过2周的清洗期,符合入排标准,方可进入治疗期。对于首次服用别嘌醇的受试者,试验前需行HLA-B*5801的检测,结果为阴性者方可进入试验。治疗期间,试验组和对照组别嘌醇剂量第1周为100 mg/d,第2周起调整至200 mg/d,直至第12周末;试验组和对照组分别同步使用萆薢分清丸和安慰剂,一天2次,每次9 g。萆薢分清丸(上海雷允上封浜制药有限公司,国药准字:Z31020122),别嘌醇片(上海信谊万象药业股份有限公司,国药准字:H31020334)。
治疗期间禁止使用:试验药物以外的治疗高尿酸血症的药物;影响尿酸代谢的药物,如丙磺舒、磺吡酮、苯溴马隆、雌激素等;与别嘌醇有相互作用的药物,如氯噻酮、依他尼酸、呋塞米、美托拉宗、吡嗪酰胺或噻嗪类利尿药、氨苄西林、6-巯基嘌呤和硫唑嘌呤等。
观察指标主要疗效指标:治疗12周后血尿酸<6.0 mg/dL的患者百分比。次要疗效指标:每次访视血尿酸<6.0 mg/dL的患者百分比;每次访视两组血尿酸水平与基线值相比有所降低的患者百分比;治疗前后两组血尿酸下降幅度均值;试验期间两组痛风新发作次数。安全性指标:观察并记录试验中出现的不良事件,并随访用药前后血常规、尿常规(包括尿蛋白、尿白细胞、尿红细胞)、心电图、肝肾功能(包括谷丙转氨酶、谷草转氨酶、碱性磷酸酶、总胆红素、谷氨酸转肽酶、肌酐、尿素氮)。
统计分析人群全分析集(full analysis set,FAS)是由经随机化分配后至少使用一次试验药物且具有用药评价数据的全部病例构成的集合。符合方案集(per-protocol set,PPS)是由符合入选标准、完成规定治疗期、依从性好(80%<服药量<120%)、治疗期间未使用禁止药物的全部病例构成的集合。安全性分析数据集(safety set,SS)是在安全性与耐受性评价时用于汇总的病例集,该数据集包括所有随机化后至少接受过一次治疗并有一次安全性评价数据的受试者。FAS和PPS分析集中主要指标若有缺失值,采用最接近的一次观察数据进行结转。
统计学方法由独立的第三方承担生物统计工作,参与试验设计、方案实施,负责数据管理及统计分析并完成统计分析报告。统计分析采用SAS 9.4统计分析软件进行计算。所有检验均采用双侧检验,P<0.05为差异有统计学意义。与筛选期基线值进行比较,采用t检验或Wilcoxon秩和检验比较组内差异。计数资料采用频数(构成比)进行统计描述。各组治疗前后的变化采用χ2检验或精确概率法。脱落分析采用χ2检验或精确概率法比较两组总脱落率和由于不良事件导致的脱落率。基线值的均衡性分析采用t检验、χ2检验或精确概率法。有效性分析采用考虑中心分层的CMH-χ2检验比较组间及组内治疗前后的血尿酸达标率。安全性分析采用χ2检验或精确概率法比较组间不良事件发生率、实验室检验结果的变化情况及异常改变与试验药物的关系。
结 果
一般情况对照组35例和试验组35例进入FAS集,对照组28例和试验组31例进入PPS集,对照组35例和试验组35例进入SS集。对照组有5例(13.89%)脱落,试验组有2例(5.56%)脱落;对照组有1例(2.78%)剔除,试验组有1例(2.78%)剔除。两组脱落剔除率差异无统计学意义(P=0.48)。有3例受试者违背方案(对照组1例,试验组2例),经盲态审核,这3例受试者可以纳入PPS。72例受试者中63例完成全部研究,对照组30例,试验组33例。受试者均为汉族男性,对照组和试验组的平均年龄分别为(47.54±11.43)岁和(51.11±11.97)岁,平均身高分别为(171.74±5.62)cm 和(172.14±6.41)cm,平均体重分别为(77.24±10.81)kg和(77.55±10.37)kg。FAS中两组的性别、年龄、身高、体重差异均无统计学意义。
主要疗效指标主要疗效指标为治疗12周时达到血尿酸<6.0 mg/dL的患者百分比,采用考虑中心效应的CMH-χ2检验比较组间差异。FAS分析显示,对照组和试验组分别有3例(8.57%)和10例(28.57%)血尿酸达标,差异有统计学意义(χ2=4.49,P=0.03);PPS分析显示,对照组和试验组分别有3例(10.71%)和10例(32.26%)经过12周治疗后血尿酸<6.0 mg/dL,两组差异有统计学意义(χ2=3.93,P=0.04)。
次要疗效指标
血尿酸达标率 治疗2周后,对照组和试验组分别有3例和8例血尿酸<6.0 mg/dL;治疗4周后,对照组和试验组分别有5例和9例的血尿酸<6.0 mg/dL;治疗8周后,对照组和试验组分别有5例和10例血尿酸<6.0 mg/dL。比较两组各时段的血尿酸达标率,试验组均略高,但差异无统计学意义(表1)。
血尿酸浓度与基线值相比降低的患者比例 治疗2、4、8、12周后,比较两组中血尿酸低于基线值的患者比例。FAS分析显示,各访视点对照组的血尿酸低于基线值的患者比例均高于试验组,但差异均无统计学意义(图1A)。PPS分析显示,2周和4周对照组的血尿酸低于基线值的患者比例高于试验组,但差异均无统计学意义;8周和12周试验组血尿酸低于基线值的患者比例高于对照组,但差异均无统计学意义(图1B)。
治疗前后血尿酸下降幅度 对照组和试验组的血尿酸基线水平分别为(9.94±1.26)mg/dL和(9.93±1.61)mg/dL,差异无统计学意义(t=1.43,P=0.49)。经过2、4、8和 12周治疗后,对照组和试验组的血尿酸水平与基线值相比,均可见明显下降(P<0.01),对照组在第8周时血尿酸水平有轻微的升高(FAS:图2A;PPS:图2B)。试验组在第2、4、8和12周时血尿酸下降值均略高于对照组,但组间差异均无统计学意义(表2)。
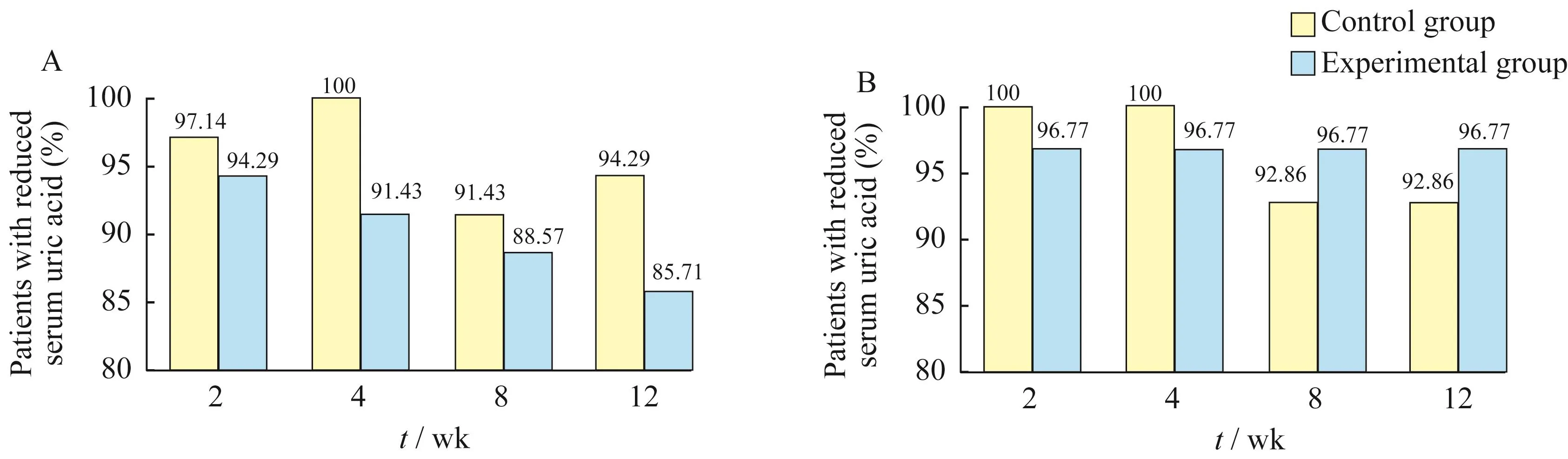
图1 治疗后血尿酸浓度与基线值相比降低的患者百分比Fig 1 Percentage of patients with reduced serum uric acid after treatment
表2 两组各访视点血尿酸下降值比较(独立样本t检验)Tab 2 Comparison of changes in serum uric acid after treatment (±s,mg/dL)

表2 两组各访视点血尿酸下降值比较(独立样本t检验)Tab 2 Comparison of changes in serum uric acid after treatment (±s,mg/dL)
Time Control group(n=35)2.24±1.23 2.75±1.56 2.31±1.57 2.45±1.51 t FAS Experimental group(n=35)2.66±1.51 2.81±1.75 2.72±1.92 2.62±2.11 P t P Week 2 Week 4 Week 8 Week 12 1.27 0.15 0.96 0.39 0.21 0.88 0.34 0.70 Control group(n=28)2.30±1.08 2.89±1.39 2.46±1.54 2.56±1.54 PPS Experimental group(n=31)2.83±1.48 3.09±1.59 3.10±1.67 3.04±1.86 1.58 0.52 1.53 1.07 0.12 0.60 0.13 0.29
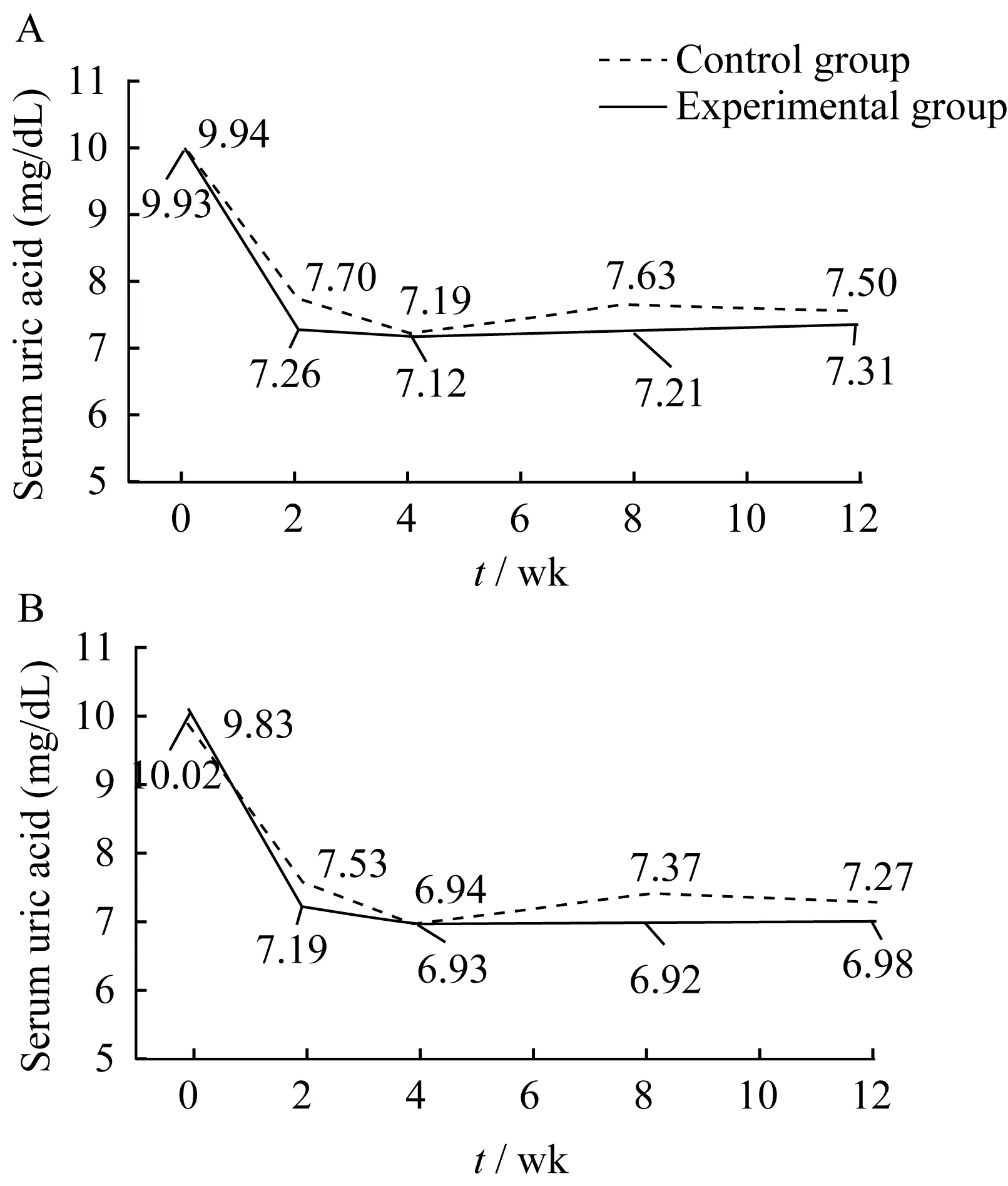
图2 治疗后两组血尿酸浓度变Fig 2 Changes of serum uric acid after treatment in the two groups
治疗期间痛风新发作次数 治疗期间,对照组和试验组分别有9例共15例次和11例共19例次痛风新发作,差异无统计学意义(FAS:25.71%vs.31.43%,χ2=0.28,P=0.60;PPS:32.14%vs.32.26%,χ2=0.000 1,P=0.99)。
安全性分析本研究的安全性分析参考《药物临床试验质量管理规范》。对照组发生20例(57.14%)不良事件,5例(14.29%)不良反应,18例(51.43%)重要不良事件,2例(2.86%)严重不良事件。试验组发生16例(45.71%)不良事件,3例(8.57%)不良反应,16例(45.71%)重要不良事件,未发生严重不良事件。两组间不良事件、重要不良事件、严重不良事件、不良反应发生率的差异均无统计学意义。对照组发生2例严重不良事件,分别为肺炎导致住院以及右足感染导致住院,其中右足感染导致住院判断为与药物相关,为严重不良事件,试验组未发生严重不良事件。两组发生率最高的不良事件均为痛风发作。
在SS及PPS中比较治疗12周和治疗前患者肝功能(包括谷丙转氨酶、谷草转氨酶、碱性磷酸酶、总胆红素和谷氨酸转肽酶)的变化,治疗前后两组各项指标的变化均无统计学意义,且两组间变化幅度差异均无统计学意义。运用CKD-EPI公式计算肾小球滤过率(glomerular filtration rate,GFR),治疗后两组GFR均上升,SS中对照组上升(1.50±14.53)mL·min-1·1.73 m-2(S=110.00,P=0.04),试验组上升(3.14±8.37)mL·min-1·1.73 m-2(S=106.00,P=0.04),两组间变化幅度差异无统计学意义(Z=0.25,P=0.80);PPS中对照组上升(3.93±8.06)mL·min-1·1.73 m-2(t=2.58,P=0.02),试验组上升(3.90±8.26)mL·min-1·1.73 m-2(S=112.50,P=0.01),两 组间变化幅度差异无统计学意义(Z=0.20,P=0.84)。
讨 论
痛风是由于机体产生尿酸过多和/或尿酸排泄能力下降,导致体内尿酸蓄积,尿酸盐结晶在关节沉积所致。痛风的治疗通常采取的手段是促进尿酸排泄和抑制尿酸合成,并予对症治疗。目前用于痛风治疗的主要包括治疗急性痛风性关节炎的药物(如非甾体消炎药、秋水仙碱、糖皮质激素)、促进尿酸排泄的药物(如苯溴马隆)和抑制尿酸生成的药物(如别嘌醇、非布司他)。
痛风的发生是因体内嘌呤代谢紊乱。我国传统医学认为,痛风的发生多因先天禀赋不足或年老脾肾亏虚加之嗜食肥甘醇酒,损伤脾胃或劳倦伤肾而致脾肾功能失调,不能正常运化水谷精微及水液,造成分清泌浊失调,最终导致湿浊内生,湿浊之邪弥散于营血而发生本病。在治疗上要标本兼治,重在治本,以健脾固肾利湿为主。中西医结合治疗日益受到医学界的重视[6-7]。
本研究证实,治疗12周后在别嘌醇基础上联合应用萆薢分清丸可以提高痛风患者的降尿酸达标率。治疗过程中,对照组在第8周时可见血尿酸水平的轻微反弹,而试验组(加用萆薢分清丸)的血尿酸下降趋势更加稳定。各访视点试验组的血尿酸水平达标率均较高,血尿酸下降幅度也略高于对照组,但差异无统计学意义,可能是因为样本量较小。
别嘌醇联合萆薢分清丸相比单用别嘌醇未见不良事件发生率增加,证实了萆薢分清丸对痛风患者的安全性。试验组痛风新发作次数较高,但两组差异无统计学意义。降尿酸治疗初期,易出现痛风发作,且血尿酸下降得越快,越容易诱发痛风急性发作,所以国内外指南均推荐降尿酸药物使用应从小剂量开始,并联合应用预防发作类药物[8-9]。因痛风新发作次数是本研究的次要疗效指标之一,故未常规加用预防发作类药物。试验组的痛风新发作次数较高,可能与治疗过程中血尿酸下降幅度高于对照组相关。
目前规范用药的患者大多能有效控制痛风发作并改善生命质量。痛风患者的治疗依从性差会导致降尿酸治疗达标率降低。担心长期用药的肝肾功能损害是导致患者治疗依从性差的主要原因之一[10]。本研究中,对照组及试验组治疗后均未见肝功能受损表现,而治疗后GFR较治疗前明显上升,提示降尿酸治疗可改善肾功能。
综上所述,别嘌醇联合萆薢分清丸有望提高痛风患者降尿酸治疗的达标率,且安全性较好。对于难治性病例,萆薢分清丸可作为降尿酸治疗的辅助用药,改善患者预后。长期使用萆薢分清丸对改善患者体内嘌呤代谢的作用,还有待更大样本的延长研究来证实。

