1株氟环唑降解菌的分离鉴定及降解特性
申志慧 王亚 李昊聪 卯新蕊 冯发运 任立云 余向阳
摘要:从废弃农药厂周边土壤中分离筛选得到1株以氟环唑为唯一碳源的降解菌,命名为F1。经过对菌落菌体的形态观察、16S rRNA序列相似性及系统发育分析,初步鉴定其为假单胞菌属(Pseudomonas sp.)菌株,其亲缘关系与昆明假单胞菌(Pseudomonas kunmingensis)最近。进一步优化F1降解氟环唑的条件,结果表明,氟环唑初始浓度为20 mg/L、温度为30 ℃、pH值为7.0时,菌株降解氟环唑的效果最佳。在最佳条件下,接入菌悬液使无机盐液体培养基在600 nm处的吸光度(D600 nm)为0.1,培养4 d后,菌株达到生长高峰,培养6 d时氟环唑降解率达90.4%。研究还发现,增加接菌量能明显提高F1对氟环唑的降解效率。
关键词:农药;氟环唑;假单胞菌属;生物修复;影响因子;降解特性
中图分类号: X592;S182文献标志码: A
文章编号:1002-1302(2020)04-0273-05
收稿日期:2019-10-17
基金項目:国家自然科学基金(编号:31772197)。
作者简介:申志慧(1991-),女,河南安阳人,硕士研究生,主要从事微生物降解农药研究。E-mail:1097130928@qq.com。
通信作者:余向阳,博士,研究员,主要从事农产品质量安全研究。E-mail:yuxy@jaas.ac.cn。
氟环唑(epoxiconazole)是一类新型三唑类含氟杀菌剂,具有内吸和残留活性,可以通过抑制麦角甾醇的形成,阻碍病菌的细胞壁形成[1],通常用于防治谷物条锈病等多种病害[2]。由于具有良好的内吸性和杀菌活性,氟环唑在杀菌剂市场中所占的份额日渐增大[2-4],其残留危害也日渐受到关注。Taxvig等发现,高剂量氟环唑对妊娠期和哺乳期的大鼠有生殖毒性,而低剂量的氟环唑可导致大鼠子代体质量增加,另外可通过参与扰乱类固醇激素合成的关键酶对大鼠的胎儿分化及内分泌产生影响[5]。Hester等研究发现,氟环唑能够引起肝细胞肿大,肝癌细胞增殖,且可对谷胱甘肽S-转移酶、细胞色素P450和氧化应激的基因转录等造成影响[6]。在农业生产中,氟环唑等被大量运用于作物病害防治,它在土壤、水体等环境中的滞留期及非生物降解半衰期较长,给农业生态环境及农产品质量带来安全隐患[7-8]。
近年来,有研究表明,利用微生物降解有机污染物,进行环境修复是一种安全有效、易于操作、低成本且无二次污染的生物修复技术[9-10]。国内外关于三唑类杀菌剂的降解研究主要集中于戊唑醇[11-15]、丙环唑[15-17]、烯唑醇[18]、三唑醇[19]、苯醚甲环唑[20-21]等上。微生物降解农药的机制包括酶促反应和非酶促反应,微生物对三唑类农药的降解大多通过酶促反应,包括氧化、羟基化、脱卤及还原等反应过程[22]。此外,温度、湿度、pH值、含氧量等环境因素可能会影响微生物对三唑类农药的降解效率。目前,有关微生物降解三唑类杀菌剂的研究较多,且以往研究筛选到的菌株对几种三唑类杀菌剂均有较好的降解效果[11-21]。然而,作为1种新型三唑类杀菌剂,国内外还未发现氟环唑相关降解菌的筛选及其降解特性研究。
本研究筛选到1株对氟环唑有良好降解效果的假单胞菌,初步分析其对氟环唑的降解特性及影响因素,以期为三唑类农药污染土壤的生物修复提供借鉴和材料。
1 材料与方法
1.1 试验材料
1.1.1 样本来源 土样采自江苏省苏科农化有限责任公司厂区。
1.1.2 主要试剂 95%氟环唑原药,江苏辉丰生物农业股份有限公司;98.5%氟环唑标准品,德国Dr. Ehrensterfer公司;色谱纯乙腈,德国Darmstadt公司;其他试剂除特别说明外均为分析纯。
1.1.3 培养基 无机盐液体培养基:0.4 gMgSO4·7H2O,0.2 g FeSO4·7H2O,0.2 g K2HPO4,0.2 g (NH4)2SO4,0.08 g CaSO4,去离子水定容至1 000 mL,pH值为7.0±0.2。
LB液体培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,去离子水定容至1 000 mL。LB固体培养基分别在上述液体培养基中加琼脂15 g/L,pH值为7.0。以上培养基均在温度为121 ℃条件下,灭菌20 min后,备用。
1.1.4 仪器设备 WH-3微型旋涡混合仪,上海沪西分析仪器厂有限公司;A-1506型紫外可见分光光度计 ,上海奥析科学仪器有限公司;SW-CJ-1D净化工作台,苏州净化设备有限公司;ZQZY-70BF振荡培养箱,上海知楚仪器有限公司;Five go便携式pH计,梅特勒-托利多仪器(上海)有限公司;Agilent LC/MS-1260/6410液相色谱质谱联用仪,美国安捷伦科技有限公司。
1.2 氟环唑降解菌的筛选和纯化
初筛:取5 g土壤,置于LB液体培养基中富集培养24 h后,依次转移至含氟环唑50、100、200 mg/L的无机盐液体培养基中,在30 ℃、200 r/min下培养5 d。利用平板划线法在LB固体培养基上分离纯化菌株,获得纯化菌株8株,分别编号为F1~F8。将菌株F1~F8接种于LB液体培养基中进行富集培养,并将富集的纯菌种保存在30%的甘油中,于-60 ℃ 冰箱中保存待用。
复筛:将初筛得到的F1~F8单菌落分别接种于以氟环唑为唯一碳源的无机盐液体培养基中,在30 ℃、200 r/min 下振荡培养,以不接菌的处理组为对照,每个处理重复3次。培养6 d后取样测定氟环唑含量并计算降解率。选择降解效能高且生长速度快的细菌为目标菌株,进一步研究其降解特性。
1.3 菌株鉴定
细菌16S rRNA的测序与系统发育树的构建基本步骤如下:提取细菌DNA基因组→16S rRNA PCR扩增→PCR产物琼脂糖凝胶电泳及纯化回收→TA克隆→验证(阳性)→测序→NCBI比对同源性。16S rRNA扩增引物为通用引物,正向引物为27F(5′-TTGATCMTGGCTCAG-3′),反向引物为1 492R(5′-GGTTACCTTGTTACGACTT-3′);TA克隆后测序的正向引物为M13F(5′-CGCCAGGGTTTTCCCAGTCACGA-3′),反向引物为M13R(5′-AGCGGATAACAATTTCACACAGGA-3′)。测序方式为双向测序,由南京金斯瑞生物科技有限公司完成。将测序结果在NCBI(http://www.ncbi.nlm.nih.gov/)中与具有相似性的细菌16S rRNA序列进行比对,选择同源性最高(≥97%)的序列,利用ClustalX进行多重序列比对后,用MEGA 6.0软件进行遗传距离计算,邻接法(NJ法)构建细菌的系统进化树。
1.4 生长曲线测定
将菌种接种于100 mL LB液体培养基中,在30 ℃、200 r/min下振荡培养,每隔2 h测定1次培养基在600 nm处的吸光度(D600 nm),连续测定24 h,绘制菌株生长曲线。取处于稳定生长期的液体菌种进行氟环唑降解试验。
1.5 菌株对氟环唑的降解特性
1.5.1 菌悬液制备
将“1.4”节中所得到的菌种接种于LB液体培养基中,放置在30 ℃、200 r/min培养箱中避光培养14 h。取20 mL富集菌液于4 ℃、5 000 r/min 下离心5 min,弃去上清液,用10 mL 无菌水清洗浓缩菌体,重复3次,用5 mL无菌水稀释后配制成菌悬液母液。
1.5.2 菌株对氟环唑的降解特性及其生长规律
将“1.5.1”节中的菌悬液母液接种到50 mL无机盐液体培养基中,调整D600 nm为0.1,添加氟环唑至其质量浓度为20 mg/L,测定初始D600 nm和氟环唑含量。以不接菌(加入与接菌液等体积的无菌水)的培养基作为对照,每处理重复3次。于30 ℃、200 r/min 摇床中避光培养,每天定时取样测定D600 nm及氟环唑残留量。
1.5.3 温度和初始pH值对菌株降解效率的影响
用1 mol/L氢氧化钠或盐酸调节无机盐液体培养基的pH值分别为5、6、7、8、9[培养基中3-(N-吗啉基)丙磺酸(MOPS)缓冲液浓度为5 mmol/L]。灭菌后,将“1.5.1”节中的菌悬液母液接种到50 mL无机盐液体培养基中,调整D600 nm为0.1,添加氟环唑使其质量浓度为20 mg/L,分别置于25、30、35 ℃的摇床(转速为200 r/min)中避光培养6 d后取样测定培养液中氟环唑的残留量。每个处理3次重复。
1.5.4 接菌量对菌株降解效率的影响
将“1.5.1”节中的菌悬液母液接种到50 mL灭菌的无机盐液体培养基(pH值为7.0)中,调整D600 nm分别为0.05、0.10、0.20、0.50,添加氟环唑至其质量浓度为20 mg/L,于30 ℃、200 r/min下避光培养,分别于0、2、4、6 d取样测定培养液中氟环唑残留量。每个处理重复3次。
1.5.5 氟环唑质量浓度对菌株降解效率的影响
将“1.5.1”节中的菌悬液母液接种到50 mL无机盐液体培养基中,调整D600 nm为0.1,添加氟环唑至其初始质量浓度分别为5、10、20、50 mg/L,培养、取样及测定方法同“1.5.4”节。每个處理重复3次。
1.6 氟环唑提取及分析方法
1.6.1 提取及净化
采用Quechers法[23]提取氟环唑:取2 mL样品溶于10 mL乙腈中,添加1 g NaCl涡旋振荡1 min后,在5 000 r/min下离心5 min,吸取上清液0.5 mL置于10 mL离心管中,加3.5 mL乙腈涡旋振荡1 min,最后加入0.05 g N-丙基乙二胺和0.100 g无水硫酸镁进行净化,过0.22 μm有机系滤膜,待测。
1.6.2 仪器检测条件
液相色谱条件:色谱柱为ZORBAX SB-C18(3.5 μm,2.1×150 mm);流动相比例设置为9 ∶1,其中A相为100%色谱乙腈,B相为0.1%甲酸;等梯度洗脱;流速为0.4 mL/min;进样体积为5 μL;柱温为室温。
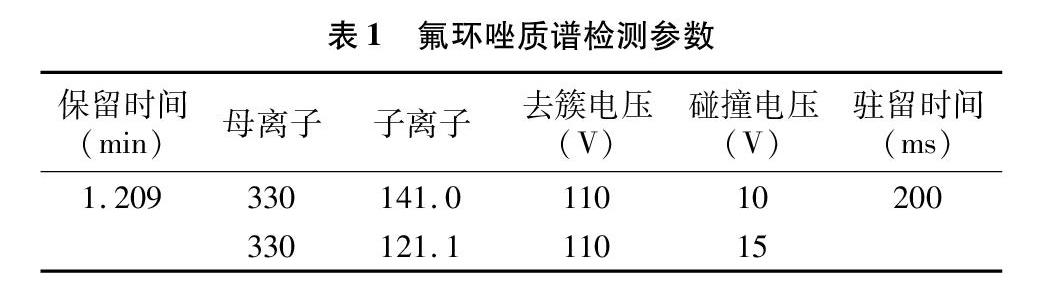
质谱条件:多反应监测扫描模式;电喷雾正离子源;离子化电压为4 000 V;雾化温度为350 ℃;喷雾气压为25 Psi。具体质谱监测参数见表1。
在上述条件下,氟环唑的添加回收率为91.6%~96.5%。
2 结果与分析
2.1 氟环唑降解菌的分离筛选
经过富集培养、梯度驯化、分离纯化等过程,得到8株可在含氟环唑的无机盐液体培养基中生长并可耐受200 mg/L氟环唑的菌株,通过初步降解试验发现,其中1株菌株能够以氟环唑为唯一碳源快速生长,且对氟环唑有较好的降解效果,将其命名为F1。在LB固体培养基上,菌落呈白色突起、圆形、边缘整齐、质地光滑、黏稠。
2.2 菌种鉴定
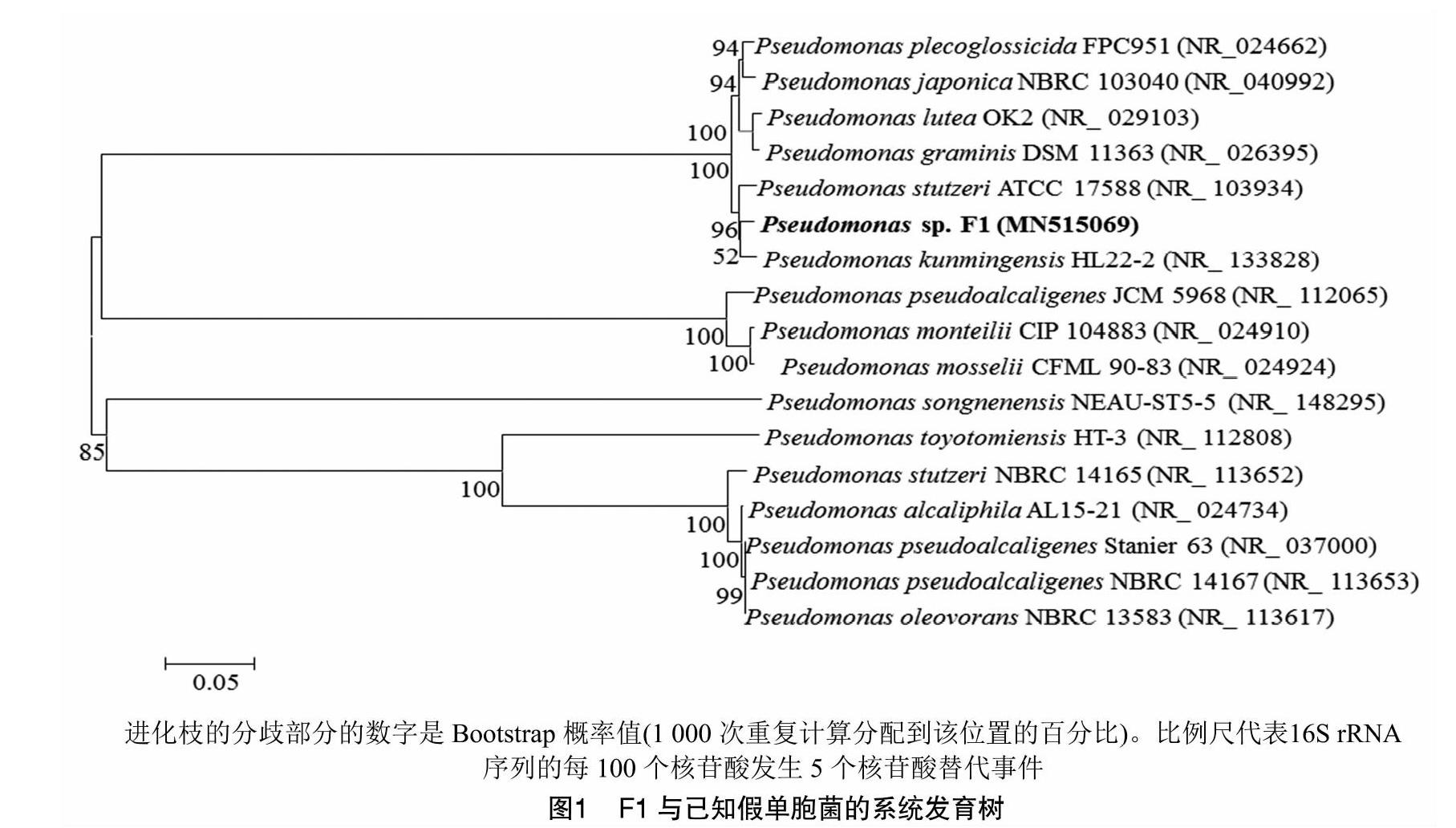
菌株F1的DNA通过PCR扩增得到约1.4 kb的16S rRNA基因片段,对该基因片段进行测序,并将测序结果在NCBI上进行Blast同源性比对,结果表明,该菌株与假单胞菌属(Pseudomonas sp.)相似度达99%,将该菌株的16S rRNA序列提交至GenBank,获得的登录号为MN515069。使用MEGA6.0软件构建系统发育树,结果(图1)发现,该菌株与昆明假单胞菌Pseudomonas kunmingensis HL22-2同源性最为高。
2.3 降解菌的生长曲线
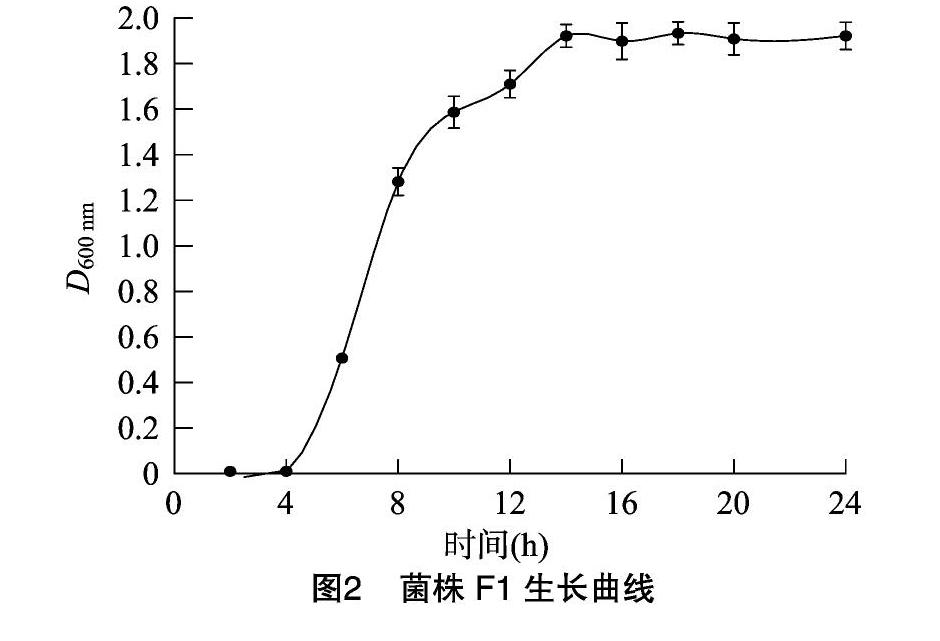
从图2可以看出,F1菌株接入LB液体培养基培养4 h后进入对数生长期,10 h后生长速度减缓,到14 h时达到生长高峰。F1菌株处于稳定生长期的时间为培养后14~18 h。取处于稳定生长期的细菌制备成菌悬液母液,进行下一步氟环唑降解试验。
2.4 菌株F1对氟环唑的降解特性及其生长规律
从图3可以看出,在以20 mg/L氟环唑为单一碳源的无机盐液体培养基中,菌株F1的生长繁殖均以氟环唑为唯一碳源和能源,菌株在培养0~4 d内逐步生长繁殖,同时氟环唑被快速代谢;在培养4 d 后因氟环唑含量降低,菌株生长进入衰退期(数量减少),氟环唑降解速率降低。在培养4 d时菌株F1数量达到最大值,其对氟环唑的降解率达75.3%;至培养6 d时,氟环唑的残留量为1.92 mg/L,降解率达到90.4%,而在未接菌的处理中,氟环唑的自降解率仅为12.8%,表明接菌处理组培养基中氟环唑浓度的下降主要是由于菌株F1的作用。
2.5 菌株F1对氟环唑降解条件的优化
2.5.1 温度和初始pH值对菌株F1降解氟环唑的影响 从图4可以看出,在pH值为6.0~8.0范围内,菌株F1对氟环唑的降解效率较高,最适初始pH值为7.0,pH值过高或者过低均会影响菌株的生长及对氟环唑的降解率。在相同pH值、不同温度(25~35 ℃)条件下,菌株F1在25 ℃下生长较慢,对氟环唑的降解能力也最小;在30 ℃ 下菌株F1对氟环唑降解效率最高,培養6 d后氟环唑降解率达90.1%。
2.5.2 接菌量对菌株F1降解氟环唑的影响 从图5可以看出,在底物氟环唑浓度均是20 mg/L的无机盐液体培养基中,随着初始接菌量的逐渐增加,菌株F1对氟环唑的降解效率明显提高。接菌量(即无机盐培养基的D600 nm)在0.05~0.50范围内时,培养6 d后菌株F1对氟环唑的降解率为22.0%~92.1%;其中当接菌量为0.05时,菌株F1的适应期延长,氟环唑降解缓慢;当接菌量分别为0.10、0.20时,菌株F1在培养4 d内快速降解氟环唑,随后降解速率变缓;而当接菌量为0.50时,菌株F1在培养2 d内快速降解氟环唑,之后降解速率变慢。
2.5.3 氟环唑底物浓度对菌株F1降解氟环唑的影响 从图6可以看出,在菌株F1接菌量为0.10、底物氟环唑的质量浓度为5~50 mg/L时,培养6 d后,随着初始氟环唑浓度的增加,降解率呈现先增加后降低的趋势。当底物浓度为50 mg/L时,推测由于底物浓度较大,菌株F1适应时期较长,导致培养6 d后氟环唑的降解率仅为38%;当底物浓度低于或等于20 mg/L时,菌株F1快速降解氟环唑,培养6 d后降解率均高于80%,表明该菌株对浓度低于或等于20 mg/L的氟环唑有较高的降解效果。
3 结论与讨论
本研究在农药厂区污染土壤中采样,经过以氟环唑为唯一碳源的梯度驯化、分离纯化等步骤,得到1株对氟环唑降解性能较好的菌株F1。经过16S rRNA同源性比较分析,初步鉴定该菌株属于假单胞菌属(Pseudomonas sp.),其亲缘关系与昆明假单胞菌Pseudomonas kunmingensis最为接近。目前已报道的三唑类(戊唑醇[13]、丙环唑[17]、多效唑[24])农药降解菌大多属于假单胞菌属(Pseudomonas sp.)。假单胞菌属细菌是从污染物中分离出的常见菌株,且大部分种属对人类危害较小,有望应用于三唑类农药污染环境的微生物修复。
本研究表明,菌株F1降解氟环唑的最佳环境条件是pH值为6.0~8.0,温度为30 ℃。细菌都具有一定的最适pH值和温度生长范围,其中温度通过控制微生物的酶促反应速率来影响降解菌的生长,进而影响降解菌对农药的降解速率[22]。当氟环唑初始浓度为20 mg/L,接菌量(D600 nm)为0.1,pH值为7.0,温度为30 ℃时,培养6 d后,氟环唑降解率达90.4%。除以上影响因素外,能源物质的添加也可能影响微生物对农药的降解效率。Sarkar等研究表明,葡萄糖作为碳源物质或硝态氮作为氮源物质的加入均能促进微生物对土壤中三唑类杀菌剂的降解作用[17]。在氟环唑的降解过程中是否具有类似的规律,需要进一步研究。
菌株F1是1株降解氟环唑功效良好的降解菌,对主要影响因素适应性良好,但还需进一步研究该菌株介导的氟环唑代谢途径及降解氟环唑过程中起关键作用的酶或控制基因等。另外,该菌株对其他三唑类农药的降解效果如何还需要进一步研究。目前,国内外对氟环唑的生物降解研究尚无报道,本研究为三唑类农药氟环唑的生物降解提供了微生物资源。该降解菌在已被氟环唑污染的化工废水及农田环境的生物修复中可能具有良好的应用前景。
参考文献:
[1]闫立单,顾松山,余 强. 氟环唑的合成新工艺[J]. 中国农药,2012(12):14-16.
[2]王新茹,赵建昌,白 伟,等. 几种三唑类杀菌剂对小麦条锈病的防治效果[J]. 麦类作物学报,2008,28(4):705-708.
[3]邱勇波,张晓蕾. 杀菌剂氟环唑的合成新方法[J]. 化学试剂,2017,39(2):218-220.
[4]刘丽秀,张鲁新,张亚敏. 氟环唑的合成工艺研究进展[J]. 山东化工,2009,38(4):28-30,41.
[5]Taxvig C,Hass U,Axelstad M,et al. Endocrine-disrupting activities in vivo of the fungicides tebuconazole and epoxiconazole[J]. Toxicological Sciences,2007,100(2):464-473.
[6]Hester S,Moore T,Padgett W T,et al. The hepatocarcinogenic conazoles:cyproconazole,epoxiconazole,and propiconazole induce a common set of toxicological and transcriptional responses[J]. Toxicological Sciences,2012,127(1):54-65.
[7]吴文铸,郭 敏,孔德洋,等. 3种三唑类杀菌剂的环境降解特性[J]. 生态与农村环境学报,2016,32(5):837-841.
[8]顾晨凯,陈茜茜,陈 猛,等. 自然条件下水中三环唑、氟环唑和苯醚甲环唑的非生物降解及其影响因素[J]. 环境化学,2014,33(1):30-36.
[9]Singh D K. Biodegradation and bioremediation of pesticide in soil:concept,method and recent developments[J]. Indian Journal of Microbiology,2008,48(1):35-40.
[10]滕 应,骆永明,李振高. 污染土壤的微生物修复原理与技术进展[J]. 土壤,2007,39(4):497-502.
[11]吴红萍,万红艳,王锐萍. 戊唑醇农药降解菌的筛选及其降解效能初探[J]. 農药,2013,52(2):102-104.
[12]侯晓娟,赵巍巍,杨 茜,等. 戊唑醇降解菌B1的培养基优化[J]. 吉林农业大学学报,2019,41(1):23-28.
[13]Obanda D N,Shupe T F. Biotransformation of tebuconazole by microorganisms:evidence of a common mechanism[J]. Wood and Fiber Science,2009,41(2):157-167.
[14]Sehnem N T,Souza-Cruz P,Peralba M D,et al. Biodegradation of tebuconazole by bacteria isolated from contaminated soils[J]. Journal of Environmental Science and Health(Part. B,Pesticides,Food Contaminants,and Agricultural Wastes),2010,45(1):67-72.
[15]Woo C,Daniels B,Stirling R,et al. Tebuconazole and propiconazole tolerance and possible degradation by Basidiomycetes:a wood-based bioassay[J]. International Biodeterioration & Biodegradation,2010,64(5):403-408.
[16]李体文,魏朝俊,贾临芳,等. 丙环唑降解菌筛选的初步研究[C]//农业环境与生态安全——第五届全国农业环境科学学术研讨会论文集,2013.
[17]Sarkar S,Seenivasan S,Premkumar R. Biodegradation of propiconazole by Pseudomonas putida isolated from tea rhizosphere[J]. Plant Soil and Environment,2009,55(5):196-201.
[18]张凤霞,李学德,花日茂,等. 烯唑醇降解菌的分离筛选及降解特性研究[J]. 激光生物学报,2009,18(5):591-595,603.
[19]鹿文红. 三唑醇降解菌的筛选与降解特性研究[D]. 长春:吉林农业大学,2014.
[20]蔡慧敏,曹之富,赵建庄,等. 苯醚甲环唑降解菌BMJHZ-01的分离鉴定及降解影响因素[J]. 农药学学报,2015,17(5):590-595.
[21]郑金伟,何 健,王 哲,等. 苯醚甲环唑降解菌B2的分离、鉴定及其降解特性[J]. 中国环境科学,2009,29(1):42-46.
[22]田春燕,徐 军,董丰收,等. 微生物降解三唑类杀菌剂研究进展[J]. 农药学学报,2016,18(2):141-150.
[23]Annastasiades M,Lehotay S J,tajnbaher D,et al. Easy multiresidue method employing acetonitrile extraction/partitiioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International,2003,86(2):412-413.
[24]Chen J,Xu L,Giesy J P,et al. Biodegradation of paclobutrazol by a microbial consortium isolated from industrially contaminated sediment[J]. Toxicological and Environmental Chemistry,2010,92(8):1487-1494.

