α-Fe2O3、γ-Fe2O3与H2SO4反应的比较
颜齐圣

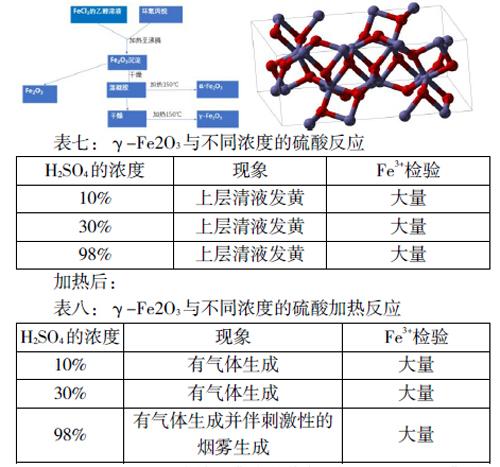
本篇文章對不同构形的Fe2O3与各种浓度H2SO4的反应进行了比较,并对γ-Fe2O3的制备做出一些说明。本文检验三价铁离子的方法是硫氰化钾法。本文分为四个部分:1、研究背景 2、α-Fe2O33、γ-Fe2O3 4、实验总结。由于技术限制笔者没有对制得的三氧化二铁进行XRD(X射线衍射实验)但有关制取方法还是来自一些比较权威并可信的文献。
1 研究背景
笔者在一次实验中,意外发现实验室中的“分析纯Fe2O3 ”并不与各种浓度的H2SO4发生反应,通过查找有关文献,笔者发现了不同构形的Fe2O3化学性质有所区别,α-Fe2O3的化学性质比γ-Fe2O3的化学性质活泼,这是因为α-Fe2O3的空间构型要比γ-Fe2O3致密,对此笔者设计了以下实验来加以验证。
2 α-Fe2O3与H2SO4反应
主要实验药品:分析纯α-Fe2O; 在高温下灼烧过的Fe2O3(根据文献Synthesis and Characterization of Nanometer-Size Fe3o4and γ-Fe2O3Particles所写,高温处理过的Fe2O3绝大多数为α-Fe2O3) ;10%H2SO4;30%H2SO4;98%H2SO4;KSCN溶液 ;盐酸 ;还原铁粉。
实验一:
在三支试管中分别加入0.5克分析纯Fe2O3,加入不同浓度的H2SO4,5毫升充分反应,实验结果如表一
实验三:
在酒精灯下加热久置分析纯的Fe2O3冷却,取少量分别加入三支试管,加入不同浓度H2SO4,充分反应,实验结果如表三:
可见:久置的Fe2O3为大量的α-Fe2O3很难与H2SO4反应,但在加热或者长时间反应之后还是可以反应的;另外在高温下处理过的Fe2O3也很难与H2SO4反应(在高温下Fe2O3的构形转换为了α-Fe2O3)
3 γ-Fe2O3与各种浓度H2SO4的反应
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
2Fe(OH)3=Fe2O3+3H2O
实验四:
分别取3.2g FeCl3,2.4g NaOH,配成2mol/L的溶液,混合沉淀,倒去上层清液,过滤用蒸溜水清洗3次,把Fe(OH)3在蒸发皿中用酒精灯加热约20min,直至固体颜色变成暗红色,后继续加热20min,保证把Fe(OH)3完全变为γ-Fe2O3,冷却后取1.0g分别放入三支试管中,加入不同浓度的硫酸,充分反应,实验结果如表四:
大量
实验五:
在还原铁屑中加入1mol/L的NaCl溶液,在空气中放置一天后,用酒精灯加热至水分蒸干(此时新制的Fe2O3中有少量的Fe没有完全反应,所以会有部分Fe与Fe3+反应生成Fe2+,所以为了排除它所带来的干扰,我们用筛子把Fe2O3分离出来。取少量分别放入三支试管中,加入不同浓度的硫酸,充分反应,实验结果如表六:
表六:加热后的铁锈与不同浓度的硫酸反应
可见:新制的Fe2O3与H2SO4可以反应,只是因为我在加热时所用温度不高而生成的多为γ-Fe2O3。
2、γ-Fe2O3制备:第一种方法(要求较高)
Fecl2+2FeCl3+8OH-------Fe3O4------γ-Fe2O3
取5.2gFecl3与2gFecl2,在PH=10-11 的条件下生成纳米Fe3O4,用强磁沉淀,离心4000 rpm后加500ml 0.01ml ,HCl离心(4000 rpm)得到8.5±1.3mm的Fe3O4.
把得到的Fe3O4调到PH=3.5,在100℃ 下加热30min ,颜色变至棕红色,得到γ-Fe2O3. 离心(4000 rpm),干燥得到γ-Fe2O3固体。
第二种方法(较简单)
Fe2++2Fe3++8OH-=Fe3O4↓ +4H2O
这里用FeSO4+2Fecl3+8NaOH=Fe3O4↓ +8Nacl+4H2O
图二:γ-Fe2O3制备方法

取FeSO41.5g,Fecl33.25g,NaOH3.2g 配成2mol/L溶液,混合,得納米Fe3O4,用强磁沉淀三次,调PH至3.5,酒精与强磁沉淀,将沉淀放入蒸发皿中,在100℃的温度下加热30min,使Fe3O4干燥,后加温至150oC,油浴30min得到干燥的暗红色γ-Fe2O3.固体。
注意:如果不用新制的Fe3O4效果不佳,在酒精灯下加热40min 只有少量的γ-Fe2O3生成,并且对于温度的控制十分重要。
第六组:
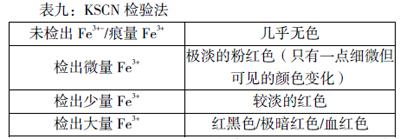
取少量的γ-Fe2O3.放入三支试管, 加入不同浓度的硫酸,充分反应,实验结果如表七:
可见:γ-Fe2O3可以与硫酸反应,并且γ-Fe2O3的反应速度比α-Fe2O3快得多。
4 实验总结
α-Fe2O3用HCL重复部分后发现与H2SO4不易发生反应,所以实验中的Fe2O3不易与H2SO4反应,而新制出的Fe2O3能与H2SO4反应,所以在课堂上老师可以用刚生绣的Fe来做实验,或使用γ-Fe2O3。
γ-Fe2O3有铁磁性,而且可以与H2SO4发生比较强烈的反应,它的性质比α-Fe2O3更活泼,比α-Fe2O3更不稳定。这是因为α-Fe2O3的晶体形状(六方晶系)堆积的比较密集(如下图所示),α-Fe2O3晶格常数为0.5414略小于γ-Fe2O3晶格常数,所以O原子很难与酸结合发生反应;而γ-Fe2O3的疏松结构则更利于与酸反应。
α-Fe2O3
由此可见,同一种物质的不同结构对它的物化性质都有着十分重大的影响,所以结构化学在化学研究中的地位十分重要,未来发展前景非常广阔。
(作者单位:重庆宏帆初级中学)

