铝含量对镍铝青铜合金耐盐水腐蚀的影响
景 媛,黄晓飞,杨 荣,李明芳,辛 钢
(1. 大连理工大学 化学学院,大连 116024; 2. 中国石油天然气股份有限公司 大连石化分公司,大连 116031)
镍铝青铜合金(NAB)具有独特的力学性能,优良的耐磨、耐腐蚀性能,被广泛用作海水泵部件、船用阀门、螺旋桨起落架轴承和衬套[1-4]。铝的加入增强了镍铝青铜合金在海水中的耐蚀性,铝和氯络合后水解形成铝的氢氧化物,会进一步形成铝的氧化物[5-7]。Al2O3的稳定性是Cu2O的十几倍,可有效防止腐蚀[8-12]。商品镍铝青铜合金含有9%~12%(质量分数,下同)Al,其组织及耐蚀性较好。
合金中元素的组成与含量明显影响着材料的耐蚀性[13-14]。BADAWY等[9]研究了含不同量Ni的Cu-Al-Ni合金在中性盐溶液中的腐蚀规律,发现合金的腐蚀速率随着镍含量的增加而增加,随氧化膜厚度的增加而减小,富镍则会导致合金的耐蚀性变差。WHARTON等[4-5]比较了镍铝青铜、铜和铜镍合金在氯化物电解液中的腐蚀过程,认为铝青铜的耐蚀性与合金成分、电解液组成、浸泡时间等有关,生成的Al2O3和Cu2O混合氧化物层有效减缓了腐蚀过程。目前的研究热点多集中于热处理工艺、合金元素种类与含量对镍铝青铜合金耐蚀性的影响[16-20],而铝含量对镍铝青铜合金耐蚀性及其腐蚀层组织演变的影响则鲜见报道。
为了研究铝含量对镍铝青铜合金腐蚀过程的影响,制备了不同铝含量的NAB合金,应用电化学方法分析了合金在盐水中的腐蚀规律,并表征了腐蚀产物成分和组织的变化。通过观察腐蚀层的金相组织,测定了其元素组成及含量,推测了腐蚀的历程,分析了铝含量对镍铝青铜合金耐蚀性的影响,以期为耐蚀镍铝青铜合金的使用提供试验依据。
1 试验
1.1 试样
在无芯感应炉中加热熔化(频率为5 000~6 000 Hz)Cu,Al,Ni金属,冶炼获得镍铝青铜合金(镍的质量分数为5%,铝的质量分数为5%、7%、9%、11%、13%,余量为铜,分别标记为Cu-5Al-5Ni、Cu-7Al-5Ni、Cu-9Al-5Ni、Cu-11Al-5Ni、Cu-13Al-5Ni)。将组织均匀的铸锭切割成1 cm立方体小试块。焊接尾线后用环氧树脂镶嵌试样,留出1 cm2工作面进行测试。测试前用碳化硅砂纸逐级打磨、抛光试样工作面。
1.2 试验方法
1.2.1 电化学试验
采用经典三电极系统,室温下测定试样在3.5%(质量分数,下同)NaCl溶液中的电化学性能。试样为工作电极,饱和甘汞电极(SCE)为参比电极,铂电极为辅助电极。动电位极化曲线扫描范围为-1~1 V(相对于开路电位),扫描速率为5 mV·s-1。电化学阻抗谱测试频率为0.01~104Hz,交流信号为10 mV,利用Zsimpwin软件模拟等效电路,每个试验重复三次。
1.2.2 腐蚀后试样的形貌表征
试样在中性盐水中浸泡不同时间(6,12,18,24,30 d)后,用去离子水清洗并干燥,采用NOVA Nano SEM 450场发射扫描电镜观察表面腐蚀产物的形貌。利用51-XMX0013能谱仪(EDS)分析合金表面层不同区域腐蚀产物的元素组成与含量。
2 结果与讨论
2.1 开路电位
由图1可见:浸泡800 s后,大部分合金试样的开路电位趋于稳定。除了Cu-11Al-5Ni合金,其他合金的开路电位均随浸泡时间的延长逐渐负移,Cu-13Al-5Ni合金的稳定开路电位相比基他合金的最负。
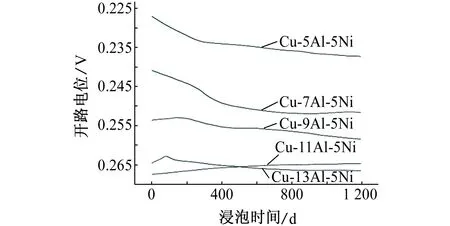
图1 NAB合金的开路电位Fig. 1 Open-circuit potentials of NAB alloys
2.2 动电位极化曲线
由图2可见:浸泡20 min后,合金的极化曲线没有表现出明显差异,拟合获得的腐蚀速率如表1所示,几种NAB合金的腐蚀速率相差不大。经过短时间(20 min)浸泡,合金表面开始形成很薄的腐蚀产物膜层,不致密且氧化物分布不均。
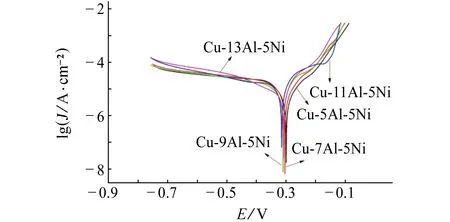
(a) 20 min
随着浸泡时间延长至30d,试样的腐蚀速率大幅度降低,此时合金表面形成了腐蚀阻隔层。不同铝含量NAB合金的腐蚀阻隔层形成快慢不同,试样的极化曲线变化明显,腐蚀电流、电位表现出明显的差异。由表1可见:Cu-9Al-5Ni合金的腐蚀电流密度最小,耐蚀性最佳。铝含量增加到13%时,其腐蚀速率与Cu-5Al-5Ni合金的相似,这表明NAB合金中的铝含量过高反而会降低其耐蚀性。
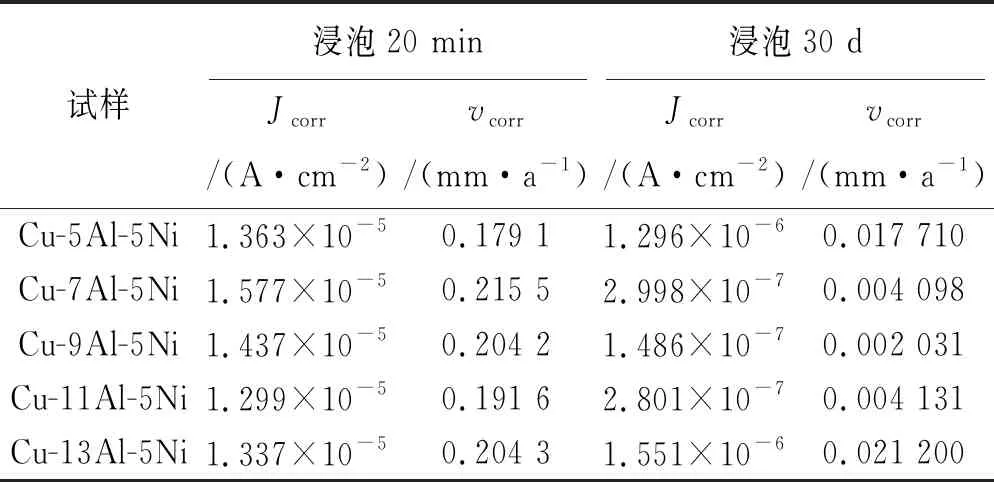
表1 极化曲线拟合结果
镍铝青铜合金在进行动电位扫描时,阴极发生氧还原反应,而阳极发生金属溶解过程[1],见式(1)和式(2)。

(1)

(2)
氧化亚铜通过溶解/沉淀反应形成,见式(3)。

(3)
长时间暴露在氯离子溶液中的氧化亚铜被氧化形成Cu(OH)2和Cu2(OH)3Cl,见式(4)和(5)。

(4)

Cu2O(OH)3Cl+H++2e-
(5)
合金中添加铝将在金属基体上形成氧化层,与Cu2O共同阻挡腐蚀产物的离子迁移。铝与氯离子络合生成四氯合铝离子,水解生成氢氧化铝层,然后逐渐转化成Al2O3保护层[11],见式(6)~(8)。

(6)

(7)

(8)
由于铝与氧的亲和性比铜更大[1],保持镍含量不变,增加铝含量,NAB合金呈现不同的耐蚀性。
2.3 电化学阻抗谱
由图3可见:经过20 min浸泡后,几种NAB合金的总阻抗没有明显差别,都是由高频电容弧和具有Warburg特征的低频阻抗电弧组成。短时间浸泡后,几种NAB合金表面均没有形成稳定的腐蚀产物来影响其耐蚀性,合金表面初步形成单薄的氧化膜,表现出相似的腐蚀情况。
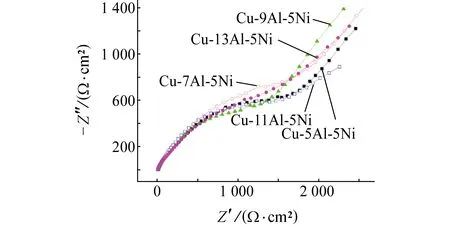
图3 NAB合金在3.5% NaCl溶液中浸泡20 min后的电化学阻抗谱Fig. 3 EIS of NAB alloys after immersion in 3.5% NaCl solution for 20 min
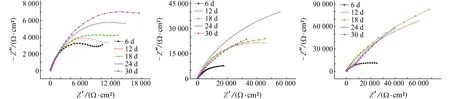
图4所示为几种合金在3.5% NaCl溶液中浸泡不同时间后的电化学阻抗谱。根据阻抗谱特征和相关的电化学知识[15-20],确定NAB合金在3.5% NaCl溶液中的等效电路,如图5所示,其中Rs为电解液的电阻;Cdl为电子双层(EDL)的电容;Q1为金属表面形成的外氧化膜的CPE;Rct为电子双层(EDL)的电荷转移电阻;Q2为电子双层(EDL)的恒相元素(CPE);Rf为在金属表面形成的钝化膜的电阻。图5中的等效电路I通常用来表示单电荷转移反应,引入了W阻抗表示扩散过程[9-10];等效电路II代表单电荷转移反应;等效电路Ⅲ、Ⅳ用来表示有腐蚀产物存在的试样。合金在中性盐水中浸泡不同时间对应的等效电路如表2所示。
(a) Cu-5Al-5Ni (b) Cu-7Al-5Ni (c) Cu-9Al-5Ni
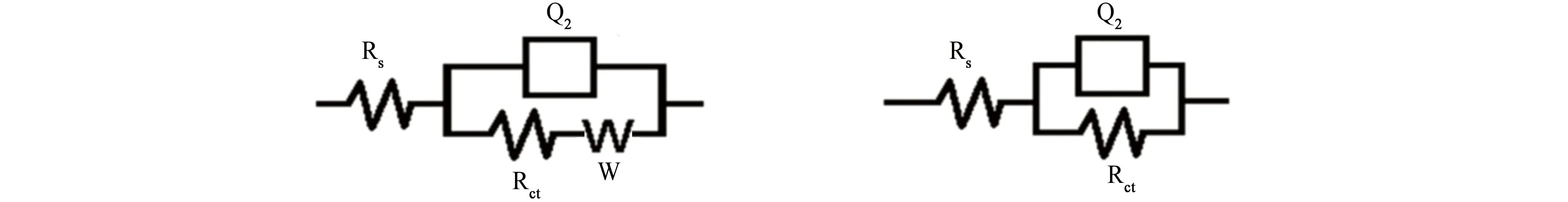
(a) Ⅰ型 (b)Ⅱ型
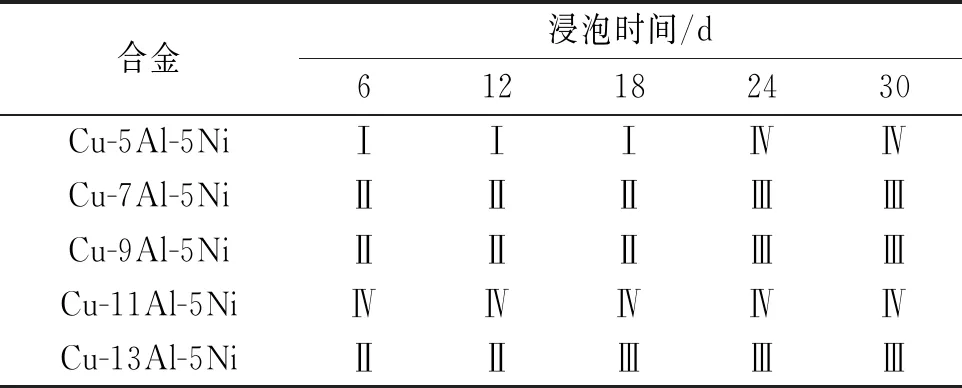
表2 在3.5% NaCl溶液中浸泡不同时间的NAB合金的等效电路
由图4可见:各合金阻抗弧的直径随着浸泡时间的增加逐渐增加。由图6可见:Rct随着浸泡时间的变化出现了不同程度的增加和减少,这是因为不同NAB合金表面腐蚀状况不同。钝化膜的厚度随着浸泡时间逐渐增加[11-12],但表3中Rf却出现减少的趋势,表明随着浸泡时间的增加合金表面钝化膜经历了增长与脱落,最终达到稳定。由图6和表3可知,Cu-9Al-5Ni合金的Rct及Rf明显大于其他NAB合金的,Cu-11Al-5Ni合金的Rf最先引入说明其表面钝化膜最先形成,而含13%铝的NAB合金的Rf较大,Rct却较小,可能是因为其表面除了生成具有保护作用的钝化膜外还形成了非保护性的腐蚀产物层。
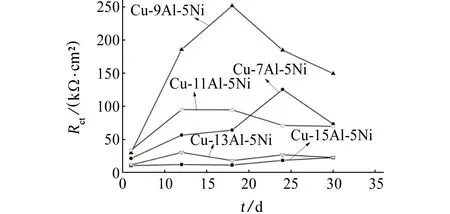
图6 在3.5% NaCl溶液中浸泡不同时间的NAB合金的电荷转移电阻(Rct)Fig. 6 Rct of NAB alloys after immersion in 3.5% NaCl solution for different times
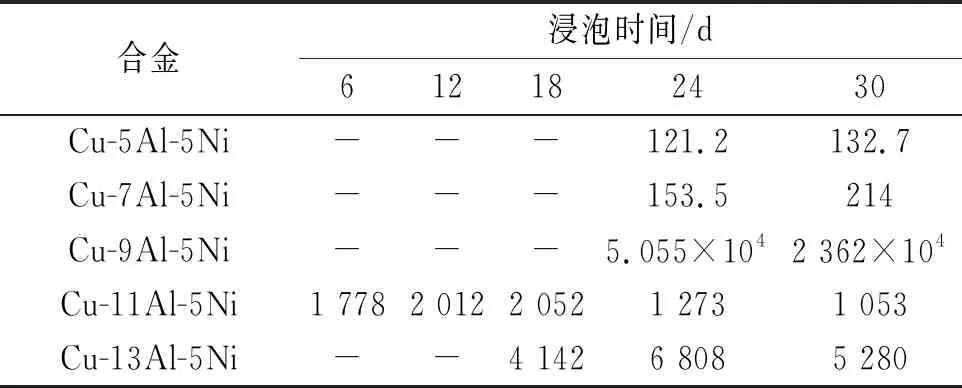
表3 NAB合金在3.5% NaCl溶液中浸泡不同时间后的Rf值
2.4 腐蚀产物形貌表征
由图7可见:经过30 d浸泡后,Cu-5Al-5Ni和Cu-13Al-5Ni合金表面出现颗粒状腐蚀产物,合金发生明显腐蚀;而Cu-9Al-5Ni合金表面膜更致密。
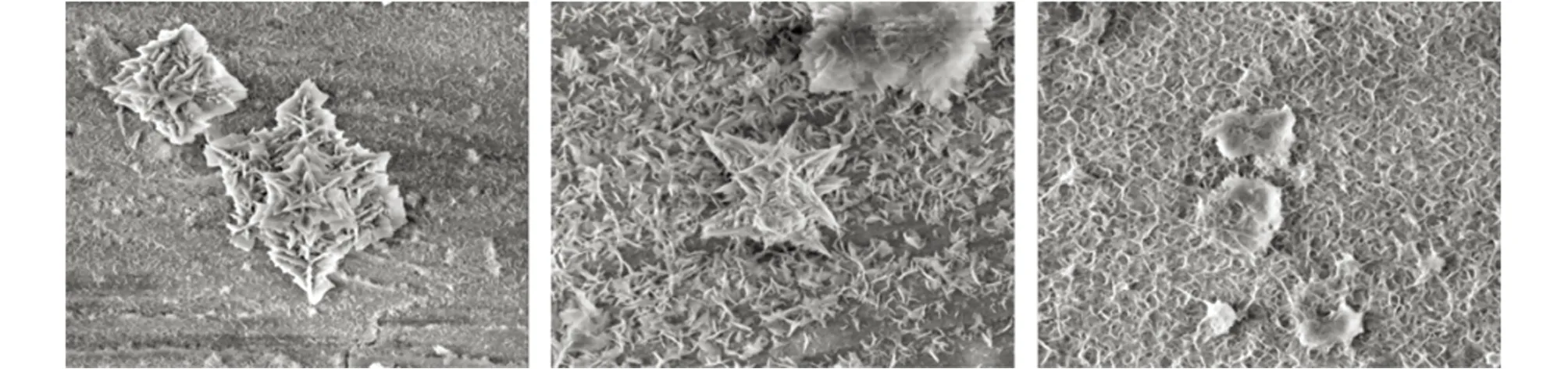
(a) Cu-5Al-5Ni (b) Cu-7Al-5Ni (c) Cu-9Al-5Ni
对Cu-13Al-5Ni合金表面进行进一步表征,分析其表面腐蚀产物的化学组成。EDS分析结果表明:主要腐蚀产物成分(质量分数,下同)为9.23%氯,39.38%氧和36.78%铜。对Cu-5Al-5Ni合金进行形貌及EDS分析,其表面晶体状腐蚀产物主要是由6.24% Cl,40.6% O和32.69% Cu组成的。两者成分相差不大,氧含量都较高,还存在氯元素,推测经过长时间的电解质溶液浸泡后,腐蚀产物最外层形成了保护作用较弱的Cu2(OH)3Cl,这与阻抗谱结果一致。
用15%(质量分数)盐酸清洗经过30 d浸泡后的NAB合金可见,不同铝含量的NAB合金表面表现出不同的腐蚀形貌,低铝试样呈现明显腐蚀沟壑,中铝试样呈现轻微的均匀腐蚀,高铝试样呈现明显点蚀,如图8所示。腐蚀失重变化趋势为Cu-5Al-5Ni>Cu-13Al-5Ni>Cu-11Al-5Ni>Cu-7Al-5Ni>Cu-9Al-5Ni,这与电化学测试结果一致。

(a) Cu-5Al-5Ni (b) Cu-7Al-5Ni (c) Cu-9Al-5Ni
由图9可见:Cu-13Al-5Ni合金经过30 d浸泡后,腐蚀坑内外的微观形貌呈现出明显不同。对腐蚀坑内外的区域进行EDS分析,结果表明腐蚀坑内(区域2)的铝的质量分数为5.23%,远远小于基体表面区域1的,证明在区域2处发生脱铝腐蚀过程,铝的腐蚀速率增加。因此,NAB合金中铝含量高的试样易发生脱铝腐蚀,导致合金的耐蚀性降低。

(a) SEM形貌
NAB合金呈现优异的耐蚀性,可以归因于合金表面形成了Cu2O和Al2O3双重保护层[12]。为了进一步分析合金的耐蚀性机理,采用EDS,对耐蚀性最佳的Cu-9Al-5Ni试样进行成分分析。结果表明:表面致密的网状腐蚀产物主要是由18.98%(质量分数,下同)氧、9.33%铝、55.77%铜,4.23%镍组成,其原子比为氧(34.97%)、铝(10.2%)、铜(25.85%)镍(2.12%),基本符合Cu2O和Al2O3的原子比,说明下表面形成了富铝层,其主要成分为Al2O3,可以防止Cu(I)扩散迁移,从而抑制合金表面铜的溶解,上表面为多孔的富铜层,其主要成分为Cu2O,上下表面共同阻挡了腐蚀产物的离子迁移,阻止了基底的进一步腐蚀。通常认为Cu2O膜是p型半导体,合金中的镍消耗了Cu2O阻挡层中几乎所有的移动阳离子空位,降低了其离子和电子的传导性,合金表面膜的耐蚀性进一步增加[9]。Cu2O和Al2O3氧化膜的形成解释了阳极电流密度减少的原因,而氯铜矿Cu2(OH)3Cl的形成则解释了耐腐蚀性降低的原因。
3 结论
(1) NAB合金的耐蚀性随合金中铝含量的增加会发生一定变化,当铝的质量分数增加到9%时,Cu-9Al-5Ni的腐蚀速率小于其他NAB合金的,表现出最好的耐蚀性;而当铝的质量分数增加到13%时,NAB合金的耐蚀性大幅度降低并发生脱铝坑蚀。铝含量过多或过少都不利于改善NAB合金的耐蚀性。铝含量过少,NAB合金表面产生的保护性氧化膜不够致密,不能够很好地阻挡Cl-对金属基体的侵蚀,而过高的铝含量会产生富铝化进而引发基体脱铝坑蚀。
(2) NAB合金的耐蚀性随着其在盐水中浸泡时间的延长而增强,此间经历了腐蚀产物的增长和脱落并最终达到稳定。
(3) NAB合金具有较好耐蚀性是由于合金表面生成了均匀致密的氧化物薄膜,铜与铝的氧化物在相互协同的作用下能有效阻挡Cl-进入金属基体,从而抑制铜的溶解。

