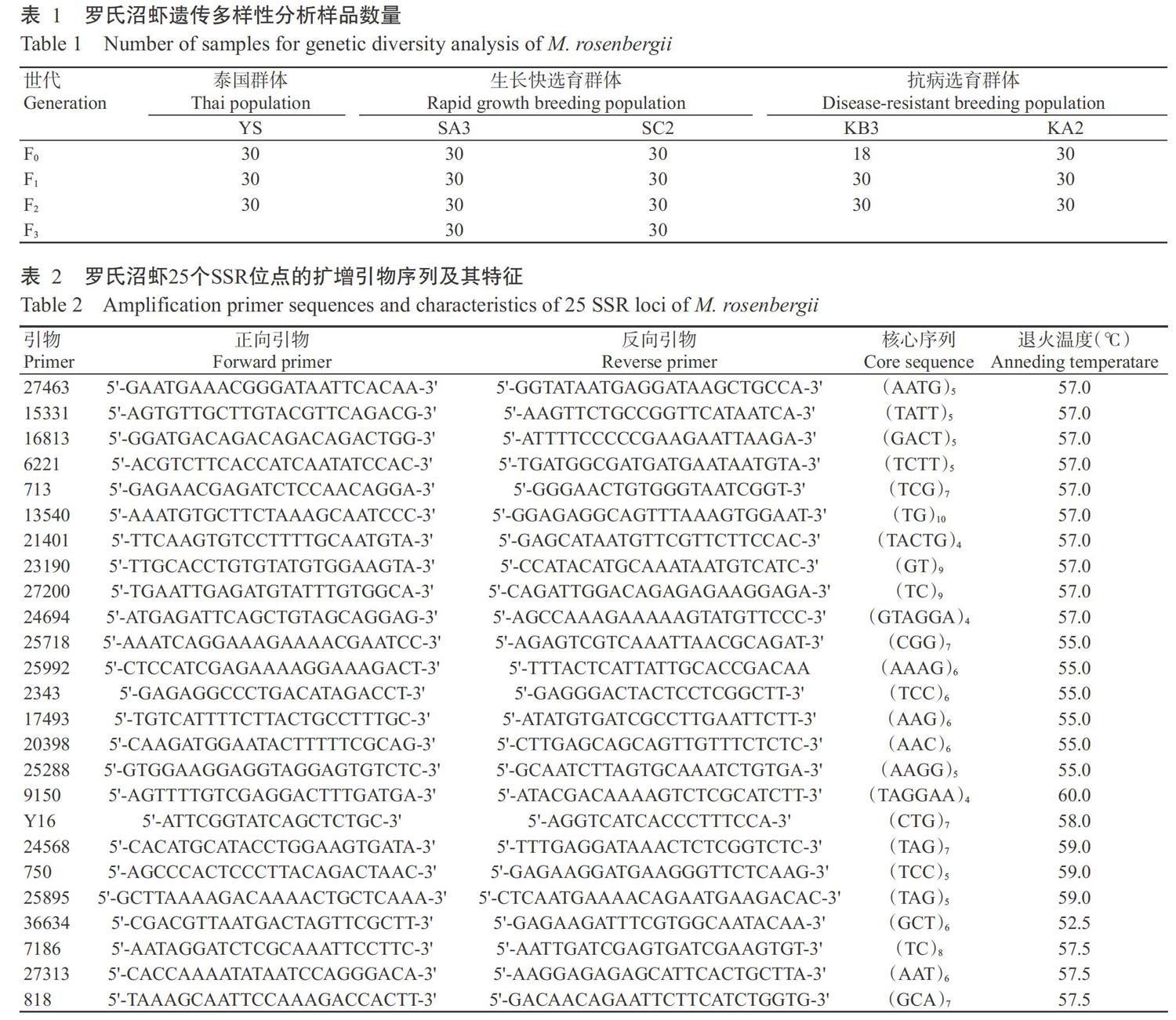
罗氏沼虾不同群体世代遗传多样性的SSR分析
董丁健 戴习林

摘要:【目的】明確罗氏沼虾不同群体世代的遗传多样性,为其专门化选育系的选育及遗传改良提供参考依据。【方法】利用25对多态性良好的SSR分子标记对罗氏沼虾泰国群体、生长快专门化选育群体和抗病专门化选育群体的不同世代进行遗传多样性分析,并基于遗传距离对其进行聚类分析。【结果】泰国群体3个世代的等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)和多态信息含量(PIC)均呈逐代下降趋势。生长快专门化选育系群体(SA3和SC2)4个世代的Na、Ne、He和PIC整体上呈下降趋势,其中,SA3选育系的PIC从0.3827下降至0.2560,SC2选育系的PIC从0.3877下降至0.2557。抗病专门化选育系群体(KB3和KA2)3个世代的Na、Ne、Ho、He和PIC无明显下降趋势,KB3选育系的PIC从0.2952下降至0.2845,KA2选育系的PIC从0.3721下降至0.2974。除Ho外,泰国群体各项遗传参数均高于同期的生长快专门化选育群体和抗病专门化选育群体,抗病专门化选育系(KB3和KA2)F2世代的各项遗传参数也均高于同期的生长快专门化选育系(SA3和SC2)F3世代。泰国群体与生长快专门化选育群体和抗病专门化选育群体的遗传距离较远,其3个世代独立聚类成一支;生长快专门化选育群体和抗病专门化选育群体的各世代则聚类成另一支。【结论】生长快专门化选育系的选育方向会使某些基因趋于纯合,而抗病专门化选育系的选育方向会使某些基因趋于杂合,因此,在罗氏沼虾专门化品系选育过程中要保证足够的群体数量防止近亲杂交现象发生,或及时引入新的泰国群体对选育群体进行引种复壮。
关键词: 罗氏沼虾;遗传多样性;泰国群体;专门化选育系;SSR分子标记
中图分类号: S917.4 文献标志码: A 文章编号:2095-1191(2020)02-0421-08
SSR analysis on genetic diversity in different populations and generations of Macrobrachium rosenbergii
DONG Ding-jian1,2,3, DAI Xi-lin1,2,3*
(1National Demonstration Center for Experimental Fisheries Science Education(Shanghai Ocean University), Shanghai 201306; 2Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources(Shanghai Ocean University),Shanghai 201306; 3Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding(Shanghai Ocean University), Shanghai 201306)
Abstract:【Objective】This research explored the genetic diversity of different populations at various generations of Macrobrachium rosenbergii,providing a theoretical basis of the breeding and genetic improvement for specialized bree-ding lines. 【Method】The research used 25 pairs of SSR molecular markers with good polymorphism to analyze the gene-tic diversity of different generations of M. rosenbergii of Thai population, fast-growing population and disease-resistant specialized breeding line population. And cluster analysis was conducted based on genetic distance to study the genetic diversity and genetic relationship of different populations and generations of M. rosenbergii. 【Result】The results of the Thai population showed a down trend in number of alleles(Na), effective number of alleles(Ne), observed heterozygosity(Ho), expected heterozygosity(He) and polymorphism information content(PIC) of the three generations from generation to generation. The results of fast-growing specialized breeding lines populations(SA3 and SC2) at four generations demonstrated downtrend of Na, Ne, He and PIC, PIC of SA3 line dropped from 0.3827 to 0.2560, SC2 decreased from 0.3877 to 0.2557. The results of the specialized disease resistance lines(KB3 ans KA2) did not showed a obviously down trend in Na, Ne, Ho, He and PIC of the three generations from generation to generation.PIC of KB3 decreased from 0.2952 to 0.2845, KA2 decreased from 0.3721 to 0.2974. The genetic parameters of the Thai population were higher than those of the fast-growing specialized breeding lines population and disease resistance breeding lines which been bred at the same time, except Ho. Meanwhile, the genetic parameters of F2 generation of disease resistance breeding lines (KB3 and KA2) were higher than those of F3 generation of fast-growing specialized breeding lines (SA3 and SC2) at the same time. The genetic distance of the Thai population was far from the fast-growing specialized breeding lines population and the disease resistance breeding lines population, and the three generations of the population cluster into one branch. Each generation of the fast-growing specialized breeding lines population and the disease resistance breeding lines population clustered into another branch. 【Conclusion】The breeding direction of fast-growing specialized breeding lines cause some genes to become homozygous, and the breeding direction of disease resistance breeding lines make some genes tend to be heterozygous. Therefore, in the breeding process of specialized strain of M.rosenbergii, sufficient population number should be ensured to prevent inbreeding, or the introduction of new Thai population in time can make rejuvenation for breeding population.
Key words: Macrobrachium rosenbergii; genetic diversity; Thai population; specialized breeding line; SSR mole-cular marker
Foundation item: Shanghai Shrimp Industrial Technology System Construction Project(Hunongkechan〔2014〕No.5)
0 引言
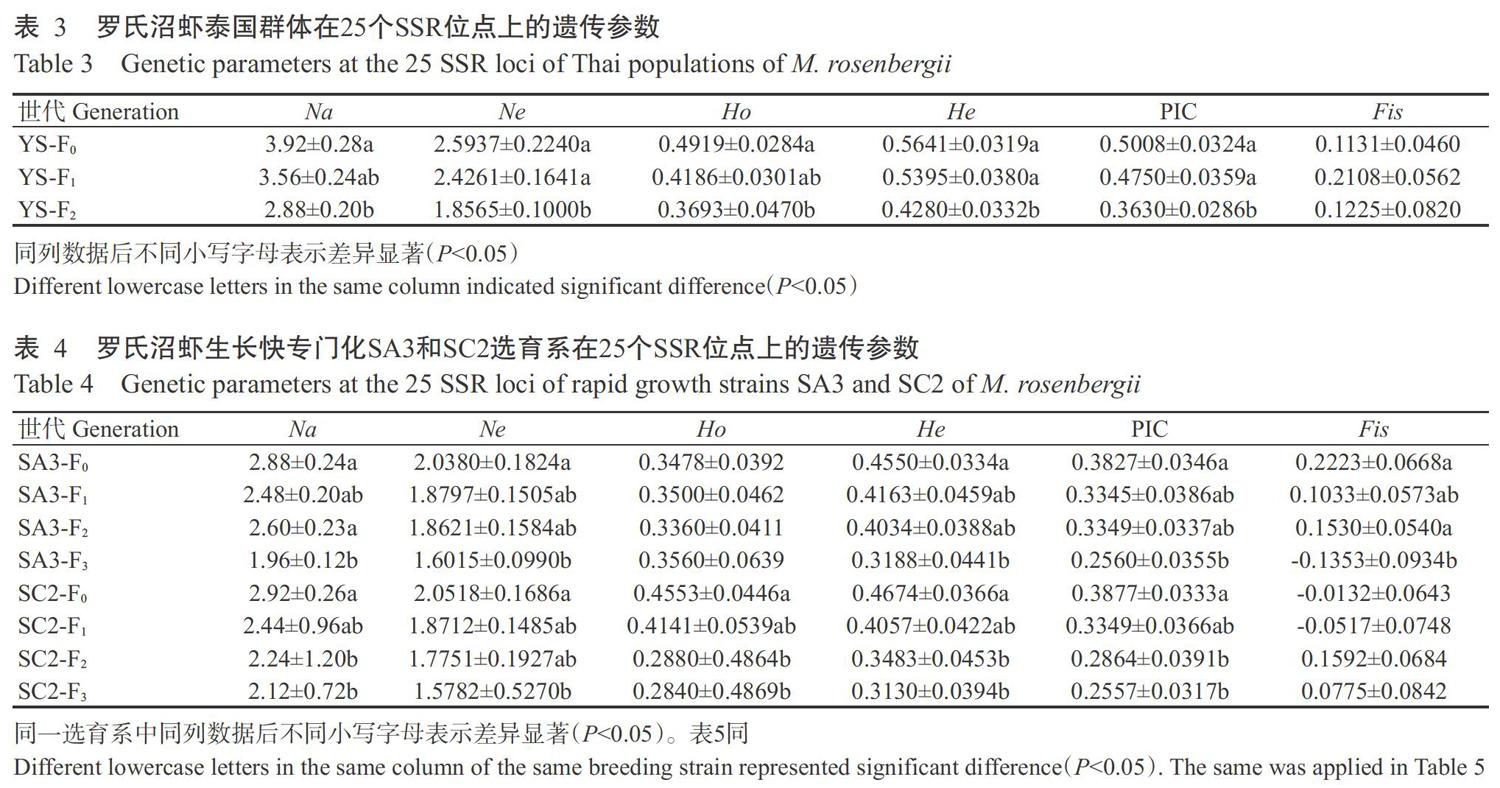
【研究意义】罗氏沼虾(Macrobrachium rosenbergii)又称马来西亚大虾,隶属于节肢动物门(Arthropoda)甲壳纲(Crustacea)十足目(Decapoda)长臂虾科(Palaemonidae)沼虾属(Macrobrachium)(徐洋等,2012;董学洪和陈正兴,2015),具有个体大、肉质鲜、生长快、易养殖等优点,但经过多年累代人工繁殖,已出现病害增多、个体小型化、生长速率缓慢、性成熟时间提前及抗病能力下降等现象(刘杰,2012;徐洋等,2012;张瑞祺,2015)。配套系选择育种是通过小群闭锁繁育以优化和提纯亲本系,采用完全双列杂交进行各选育系杂交试验,经过配合力和遗传相关参数测定,选择杂种优势水平高的杂交组合,并将具备较好配合力的配套系进行扩繁(武英等,2007;唐首杰等;2016;韩文明等,2019)。微卫星(Microsatellite)又称简单序列重复(Simple sequence repeats,SSR),作为第二代分子标记已广泛应用于分子标记辅助育种及物种遗传结构分析(赵广泰等,2010;熊良伟等,2018;Kumari et al.,2018;赵彦花等,2019)。因此,利用SSR分子标记分析选育群体的遗传关系及其遗传多样性,有利于及时调整选育工作,对加速选育群体亲本选择及遗传改良也具有重要意义。【前人研究进展】2009年,戴习林等提出将目前主要在畜禽业广泛应用的配套系选育技术应用于罗氏沼虾选育,现已完成专门化品系组建,并取得一定进展;邓平平(2012)在此基础上挑选并组建了6个专门化品系的基础群体;各基础群体内部自由交配繁殖,世代选留,最终确定了罗氏沼虾专门化品系组建路线。此外,邹卫丽(2012)对筛选出的生长专门化选育系子代进行溶藻弧菌(Vibrio alginolyticus)注射感染试验,从存活虾中挑选个体大、活力强、体表无损伤的健康罗氏沼虾作为抗病选育的基础群体,初步建立了罗氏沼虾抗病专门化品系选择前系;蒋飞等(2014)应用SSR分子标记对罗氏沼虾5个选择系F2代的遗传多样性和遗传分化进行研究,结果显示5个选择系的多态信息含量(PIC)排序为C(0.4340) 1 材料与方法 1. 1 试验材料 罗氏沼虾样品均来自上海海洋大学产学研基地上海申漕特种水产开发有限公司,分别是泰国群体(YS)、生长快专门化选育群体(SA3和SC2)和抗病专门化选育群体(KB3和KA2)(表1)。其中,泰国群体包括2015年引进的200尾野生虾(YS-F0)及闭锁继代繁育的子一代(YS-F1)和子二代(YS-F2);生长快专门化选育群体包括以连续15年闭锁繁育的391尾上海养殖群体为原始群体的专门化选育系基础群体(F0)及连续闭锁选育的F1、F2和F3世代;抗病专门化品系选育群体包括通过溶藻弧菌注射感染生长快专门化选育系F1世代获得的基础群体(F0)及连续闭锁选育的F1和F2世代。采集的肌肉组织保存在无水乙醇中,-80 ℃保存备用。 1. 2 试验方法 1. 2. 1 DNA提取 每个样品选取20 mg肌肉组织,采用海洋動物组织基因组DNA提取试剂盒[天根生化科技(北京)有限公司]提取其DNA,1.0%琼脂糖凝胶电泳检测DNA提取效果。 1. 2. 2 SSR引物合成 采用戴习林等(2017)研发的25对SSR引物(表2)进行遗传多样性分析,引物委托生工生物工程(上海)股份有限公司合成。 1. 2. 3 PCR扩增 参照戴习林等(2012)的方法进行PCR扩增。PCR反应体系10.0 μL:DNA模板(20~50 ng/μL)0.4 μL,MasterMix(0.1 U Taq DNA聚合酶,500 μmol/L dNTP each,20 mmol/L Tris-HCl,100 mmol/L KCl,3 mmol/L MgCl2,pH 8.3)5.0 μL,正、反向引物(5 μmol/L)各0.3 μL;超纯水4.0 μL;加入1滴石蜡油防止蒸发。扩增程序:95 ℃预变性5 min;94 ℃ 30 s,退火30 s,72 ℃ 1 min,进行30个循环;72 ℃延伸10 min;4 ℃保存。 1. 2. 4 PCR扩增产物检测 PCR扩增产物采用1.0%琼脂糖凝胶进行电泳检测,并置于凝胶成像仪中拍照检测DNA浓度;同时以8%聚丙烯酰胺凝胶进行电泳,银染显色后用GelPro32 4.0进行数据采集,根据扩增片段长度和进行等位基因分型。 1. 3 统计分析 使用GelPro32 4.0读取微卫星目标条带,利用GREATE、PopGen32和MEGA 3.0等分析Na、有效等位基因数(Ne)、Ho、期望杂合度(He)、PIC及计算群体间的遗传距离和遗传相似系数,并以UPGMA法构建系统发育进化树。采用SPSS 20.0进行试验数据显著性分析。 2 结果与分析 2. 1 罗氏沼虾各群体不同世代的遗传多样性比较 泰国群体3个世代的Na、Ne、Ho、He和PIC均随世代的增加而呈下降趋势(表3),其中,Na范围为2.88~3.92、Ne范围为1.8565~2.5937、Ho范围为0.3693~0.4919、He范围为0.4280~0.5641,PIC范围为0.3630~0.5008。泰国群体YS-F0世代与YS-F1世代的各项遗传参数无显著差异(P>0.05,下同),但YS-F0世代与YS-F2世代的Na、Ne、Ho、He和PIC存在显著差异(P<0.05,下同)。YS-F0世代的近交系数(Fis)最小(0.1131),YS-F1世代的最大(0.2108)。PIC等遗传参数逐代降低,说明可能已出现近交衰退现象,即泰国群体的小群体闭锁继代繁育可能引起近亲杂交。 生长快专门化选育系群体(SA3和SC2)4个世代的Na、Ne、He和PIC变化趋势如表4所示。SA3选育系的Na范围为1.96~2.88、Ne范围为1.6015~2.0380、Ho范围为0.3360~0.3560、He范围为0.3188~0.4550,PIC范围为0.2560~0.3827;SA3-F0世代与SA3-F1世代、SA3-F2世代的各遗传参数无显著差异,但SA3-F0世代与SA3-F3世代的Na、Ne、He和PIC存在显著差异。SC2选育系的Na范围为2.12~2.92、Ne范围为1.5782~2.0518、Ho范围为0.2840~0.4553、He范围为0.3130~0.4674,PIC范围为0.2557~0.3877;SC2-F0世代与SC2-F1世代的各项遗传参数无显著差异,SC2-F0世代与SC2-F2世代的Na、Ho、He和PIC存在显著差异,SC2-F0世代与SC2-F3世代的Na、Ne、Ho、He和PIC存在显著差异。在SA3选育系中,SA3-F0世代的Fis最大(0.2223)、SA3-F3世代的最小(-0.1353);在SC2选育系中,SC2-F2世代的Fis最大(0.1592)、SC2-F1世代的最小(-0.0517),SC2-F0世代和SC2-F1世代的Fis为负值,表明近交程度较轻。 抗病专门化选育系群体(KB3和KA2)3个世代的Na、Ne、Ho、He和PIC無明显下降趋势(表5)。KB3选育系的Na范围为2.04~2.16、Ne范围为1.6594~1.7322、Ho范围为0.3050~0.4413、He范围为0.3580~0.3816、PIC范围为0.2845~0.2952;KB3-F0世代与KB3-F1世代、KB3-F2世代的各项遗传参数均无显著差异。KA2选育系的Na范围为2.28~2.52、Ne范围为1.6808~1.9865、Ho范围为0.2733~0.3959、He范围为0.3602~0.4541,PIC范围为0.2974~0.3721;KA2-F0世代与KA2-F1世代、KA2-F2世代的Na、He和PIC无显著差异,但KA2-F0世代与KA2-F2世代的Ne和Ho存在显著差异。在KB3选育系中,KB3-F0世代的Fis最大(0.1476)、KB3-F1世代的最小(-0.2289);在KA2选育系中,KA2-F0世代的Fis最大(0.1132)、KA2-F2世代的最小(-0.2285)。抗病专门化选育系群体(KB3和KA2)F1世代和F2世代的Fis均为负值,表明尚未出现近交现象。 2. 2 罗氏沼虾不同群体间的遗传多样性比较 由于抗病专门化选育系是通过溶藻弧菌注射感染生长快专门化选育系F1世代而获得基础群体(F0),因此基于相同年份开展罗氏沼虾不同群体间的遗传多样性比较分析。其中,2014年筛选获得生长快专门化选育群体F0世代,2015年选育出生长快专门化选育群体的F1世代和抗病专门化选育群体的F0世代及引进泰国群体F0世代,2016年选育出生长快专门化选育群体F2世代及泰国群体和抗病专门化选育群体的F1世代,2017年选育出生长快专门化选育群体的F3世代及泰国群体和抗病专门化选育群体F2世代。由表6可知,除Ho外,泰国群体各项遗传参数均高于同期的生长快专门化选育群体和抗病专门化选育群体,抗病专门化选育系(KB3和KA2)F2世代的各项遗传参数也均高于同期的生长快专门化选育系(SA3和SC2)F3世代。具体表现为:YS-F0世代的Na、Ne和PIC显著高于生长快专门化选育系(SA3和SC2)F1世代和抗病专门化选育系(KB3和KA2)F0世代,而生长快专门化选育系(SA3和SC2)F1世代与抗病专门化选育系(KB3和KA2)F0世代间的各项遗传参数均无显著差异;YS-F2世代的Na和PIC显著高于生长快专门化选育系(SA3和SC2)F3世代和抗病专门化选育系(KB3和KA2)F2世代,生长快专门化选育系(SA3和SC2)F3世代与抗病专门化选育系(KB3和KA2)F2世代间的He和PIC存在显著差异。 2. 3 不同群体间的亲缘关系及聚类分析结果 罗氏沼虾泰国群体、生长快专门化选育群体和抗病专门化选育群体间的遗传距离和遗传相似系数详见表7。由于抗病专门化选育群体的KB3-F0世代样本量较少,因此未列入聚类分析中。采用MEGA 3.0对泰国群体、生长快专门化选育群体和抗病专门化选育群体共16个世代进行聚类分析,结果(图1)显示,泰国群体遗传距离与生长快专门化选育群体和抗病专门化选育群体的遗传距离较远,3个世代(YS-F0、YS-F1和YS-F2)独立聚类成一支;抗病KB3选育系和抗病KA2选育系各世代先聚类成一分支,然后与生长快SC2选育系聚类,再与生长快SA3选育系聚类成一支。可见,各专门化选育系不同世代间的遗传相似性较高,亲缘关系较近;而抗病专门化选育群体与泰国群体的遗传相似性较低,亲缘关系较远。 3 讨论 本课题组构建的罗氏沼虾专门化选育系经多年选育而来,通过选择性状优良、生长快、抗病强的个体进行繁殖,与常规选育的苗种相比,在生长速率、个体大小及抗病力存活率方面具有明显优势;但通过专门化选育进行选择也可能会造成群体世代间遗传多样性降低。随着世代选育的进行,目标性状相关基因得以保留,不利基因则被淘汰,但与目标相关基因的纯合在一定程度上会降低位点多样性,导致群体的适应性下降(张进等,2014)。根据Botstein等(1980)的判断标准,当PIC>0.50时,为高度多态性;当0.25 罗氏沼虾泰国群体通过小群体继代繁育,3个世代的遗传多样性呈逐代下降趋势,YS-F0世代与YS-F2世代的Na、Ne、Ho、He和PIC存在显著差异,在未进行人工定向选育和保证足够群体数的情况下,泰国群体出现近交衰退的现象,其种质资源退化。生长快专门化选育群体(SA3和SC2)4个世代的遗传多样性整体上呈下降趋势,其中,SA3选育系的PIC从0.3827下降至0.2560,SA3-F0世代与SA3-F3世代的Na、Ne、He和PIC存在显著差异;SC2选育系的PIC从0.3877下降至0.2557,SC2-F0世代与SC2-F3世代的Na、Ne、Ho、He和PIC存在显著差异。由遗传多样性指数的变化规律可知,2个生长快专门化选育系SA3和SC2的遗传多样性随选育世代的递增整体上呈下降趋势。在SA3选育系中,25718位点的Ne从2.3591下降至1.0689,He从0.5859下降至0.0655,PIC从0.4890下降至0.0620;17493位点的Ne从1.3846下降至1.0000,He从0.2825下降至0,PIC从0.2390下降至0;25288位点的Ne从2.0385下降至1.6838,He从0.5181下降至0.4130,PIC从0.3960下降至0.3240;表明25718和17493位点经选育其基因型已达纯合。由此可判断,25718、17493和25288位点为生长快专门化选育群体SA3选育系的生长关联性位点;6221、23190、Y16(SUGbp8-103b)和36634位点为生长快专门化选育群体SC2选育系的生长关联性位点。在抗病专门化选育群体(KB3和KA2)中,3个世代的Na、Ne、Ho、He和PIC无明显下降趋势。KB3-F0世代与KB3-F1世代、KB3-F2世代的各项遗传参数均无显著差异,KA2-F0世代与KA2-F1世代、KA2-F2世代的Na、He和PIC无显著差异,但KA2-F0世代与KA2-F2世代的Ne和Ho存在显著差异。由此可知,生长快专门化选育系的选育方向会使某些基因趋于纯合,而抗病专门化选育系的选育方向会使某些基因趋于杂合。抗病专门化选育系的选育效果需结合感染存活率和养殖成活率等其他评价标准。 通过人工选育手段对选育群体进行定向选择,其选育过程通常是在小群体范围内,一定程度上会发生近交现象,造成群体遗传多样性的降低。Fis是衡量群体间基因分化相对程度的重要指标之一。在本研究中,罗氏沼虾泰国群体、生长快专门化选育群体和抗病专门化选育系群体在选育过程中均出现一定程度的近亲杂交现象。在泰国群体中,YS-F1世代的Fis最大(0.2108)、YS-F0世代的最小(0.1131),说明泰国群体在小群继代繁育中已出现近亲杂交。在生长快专门化选育群体中,SA3-F0世代的Fis最大(0.2223)、SA3-F3世代的最小(-0.1353);SC2-F2世代的Fis最大(0.1592)、SC2-F1世代的最小(-0.0517),且该选育系F0和F1世代的Fis均为负值,表明近亲杂交程度较轻。在抗病专门化选育群体中,KB3、KA2选育系F1和F2世代的Fis均为负值,表明抗病专门化选育系随着世代的进行不会出现近亲杂交。因此,在罗氏沼虾选育过程中要保证足够的群体数量防止近亲杂交现象发生,而导致选育群体遗传多样性下降及种质资源退化,或及时引入新的泰国群体对选育群体进行引种复壮(史建华等,2001)。 不同的选育目标和选育手段会造成选育群体遗传多样性存在明显差异。罗氏沼虾泰国群体经小群体的保种选留,其遗传多样性仍然高于以地方群体为基础的专门化选育群体,与张进等(2014)的研究结果一致。本研究结果表明,除Ho外,泰国群体各项遗传参数均高于同期的生长快专门化选育群体和抗病专门化选育群体,抗病专门化选育系(KB3和KA2)F2世代的各项遗传参数也均高于同期的生长快专门化选育系(SA3和SC2)F3世代。由于罗氏沼虾泰国群体尚未进行定向选育,仍保持着较高的杂合度和较多的生长形状,而具有丰富的基因型及更高的遗传潜力,与冯建彬等(2010)、夏建海等(2014)的研究结果一致。抗病专门化选育系(KB3和KA2)F2世代的He(0.3580和0.3602)显著高于同期生长快专门化选育系(SA3和SC2)F3世代的He(0.3188和0.3131),与朱其建等(2013)的研究结论一致,即抗病较强的群体遗传多样性明显高于抗病力低的群体,表明抗病专门化选育系在选育过程中需要保证一定的基因杂合度。因此,抗病专门化选育系的选育目标应保证群体具有稳定遗传的杂合基因。 4 结论 罗氏沼虾泰国群体和抗病专门化选育群体具有较丰富的遗传多样性,生长快专门化选育群体的遗传多样性较低。生长快专门化选育系的选育方向会使某些基因趋于纯合,而抗病专门化选育系的选育方向会使某些基因趋于杂合,因此,在罗氏沼虾专门化品系选育过程中要保证足够的群体数量防止近亲杂交现象发生,或及时引入新的泰国群体对选育群体进行引种复壮。 参考文献: 戴习林,邓平平,施永海,何安元,蒋飞,丁福江. 2012. 罗氏沼虾SSR标记再开发及其影响因素初探[J]. 生物技术通报,(10):142-149. [Dai X L,Deng P P,Shi Y H,He A Y,Jiang F,Ding F J. 2012. A preliminary study on re-developing of Macrobrachium rosenbergii microsatellite marekers and influence factors[J]. Biotechnology Bulletin,(10):142-149.] 戴习林,刘洁,李晶晶,江宗冰,明磊,蒋飞. 2017. 罗氏沼虾种群SSR分析中样本量及标记量对遗传多样性指标的影响[J]. 水产学报,41(7):1083-1095. [Dai X L,Liu J,Li J J,Jiang Z B,Ming L,Jiang F. 2017. Effects of sample size and loci number on genetic diversity index in Macrobrachium rosenbergii with microsatellite markers[J]. Journal of Fisheries of China,41(7):1083-1095.] 戴习林,臧维玲,马海娟,王永涛,丁福江. 2009. 罗氏沼虾育苗废水净化再利用技术研究[J]. 上海海洋大学学报,18(6):721-727. [Dai X L,Zang W L,Ma H J,Wang Y T,Ding F J. 2009. Study on technique of wastewater treatment and reuse for breeding Macrobrachium rosenbargii[J]. Journal of Shanghai Ocean University,18(6):721-727.] 鄧平平. 2012. 罗氏沼虾快速生长专门化品系选择前系的组建[D]. 上海:上海海洋大学. [Deng P P. 2012. The structuring of Macrobrachium rosenbergiis rapid growth of specialized strain[D]. Shanghai:Shanghai Ocean University.] 董学洪,陈正兴. 2015. 罗氏沼虾养殖中常见病害及防治[J]. 水产养殖,(11):46-48. [Dong X H,Chen Z X. 2015. Common diseases and prevention in cultivation of Macrobrachium rosenbergii[J]. Aquaculture,(11):46-48.] 冯建彬,吴春林,丁怀宇,华雪铭,李应森,李家乐. 2010. 洪泽湖日本沼虾9个野生群体遗传多样性微卫星分析[J]. 中国水产科学,17(2):218-227. [Feng J B,Wu C L,Ding H Y,Hua X M,Li Y S,Li J L. 2010. Microsatellite ana-lysis of genetic diversity in 9 wild stocks of oriental river prawn Macrobrachium nipponense in Hongze Lake[J]. Journal of Fishery Sciences of China,17(2):218-227.] 韩文朋,杨宁,孙皓,王建华,石凤英,李光奇,李花妮,闫奕源,赵丽红,王志强,吴桂琴. 2019. 肉鸡“WOD168”配套系的培育[J]. 中国家禽,41(4):67-70. [Han W P,Yang N,Sun H,Wang J H,Shi F Y,Li G Q,Li H N,Yan Y Y,Zhao L H,Wang Z Q,Wu G Q. 2019. The breeding of broiler “WOD168” specialized strain[J]. China Poultry,41(4):67-70.] 蒋飞,戴习林,朱其建,过正乾,苏建,鞠波,丁福江. 2014. 罗氏沼虾5个专门化品系生长比较及其遗传结构分析[J]. 上海海洋大学学报,23(3):329-337. [Jiang F,Dai X L,Zhu Q J,Guo Z Q,Su J,Ju B,Ding F J. 2014. Comparison of growth performance and analysis of genetic structure of 5 specialized strains of Macrobrachium rosenbergii[J]. Journal of Shanghai Ocean University,23(3):329-337.] 刘杰. 2012. 患病罗氏沼虾幼体可疑病原核酸随机克隆技术的探索[D]. 上海:上海海洋大学. [Liu J. 2012. The exploration of random cloning technology for suspicious pathogen nucleic acid in suffering Macrobrachium rosenbergii larvae[D]. Shanghai:Shanghai Ocean University.] 史建华,肖雨,徐琴英. 2001. 罗氏沼虾引种复壮技术的研究[J]. 水产科技情报,28(2):64-67. [Shi J h,Xiao Y,Xu Q Y. 2001. Studies on the introductional rejuvenated technique of Macrobrachium rosenbergii[J]. Fisheries Scien-ce & Technology Information,28(2):64-67.] 唐首杰,毕详,张飞明,张友良,张云平,王成辉. 2016. 团头鲂9个配套组合在2龄至3龄阶段的生长性能比较[J]. 水产科技情报,43(6):313-317. [Tang S J,Bi X,Zhang F M,Zhang Y L,Zhang Y P,Wang C H. 2016. Growth performance comparison of 9 matched groups from age 2 to age 3 of Megalobrama amblycephala[J]. Fisheries Scien-ce & Technology Information,43(6):313-317.] 武英,郭建凤,张安志,呼红梅,王怀中,杨玉芝. 2007. 优质肉猪配套系专门化父系(ZFY系)选育研究[J]. 山东农业科学,(4):109-112. [Wu Y,Guo J F,Zhang A Z, Hu H M,Wang H Z,Yang Y Z. 2007. The selection of specialized sire line(ZFY) of high-quality pig synthetic lines[J]. Shandong Agricultural Sciences,(4):109-112.] 夏建海,范武江,王晓清,马晓,戴振炎,王璐明. 2014. 3个不同地理日本沼虾天然群体遗传多样性的SSR分析[J]. 湖南师范大学自然科学学报,37(4):23-28. [Xia J H,Fan W J,Wang X Q,Ma X,Dai Z Y,Wang L M. 2014. Genetic diversity in three different natural populations of Macrobrachium nipponense revealed by SSR markers[J]. Journal of Natural Science of Hunan Normal University,37(4):23-28.] 熊良偉,王帅兵,岳丽佳,王建国,陶桂庆,徐亮,王权. 2018. 宽体金线蛭基因组SSR序列特征分析及其分子标记开发[J]. 南方农业学报,49(11):2298-2303. [Xiong L W,Wang S B,Yue L J,Wang J G,Tao G Q,Xu L,Wang Q. 2018. SSR sequence characters for genome of Whitmania pigra Whitman and development of molecular markers[J]. Journal of Southern Agriculture,49(11):2298-2303.] 徐洋,沈锦玉,姚嘉赟,潘晓艺,郝贵杰,尹文林. 2012. 罗氏沼虾主要病害研究概况[J]. 生物学杂志,29(6):74-76. [Xu Y,Shen J Y,Yao J Y,Pan X Y,Hao G J,Yin W L. 2012. Main diseases of the giant fresh water prawn Macrobrachium rosenbergii:A review[J]. Journal of Biology,29(6):74-76.] 张进,梁旭方,杨敏,陈敦学,刘灿洪,巫绍明,李永锋. 2014. 2个鳜鱼选育群体遗传多样性分析[J]. 水产科学,33(7):447-450. [Zhang J,Liang X F,Yang M,Chen D X,Liu C H,Wu S M,Li Y F. 2014. Genetic structure and gene-tic diversity analysis of artificial selection population of mandarin fish Siniperca chuatsi[J]. Fisheries Science,33(7):447-450.] 张瑞祺. 2015. 工厂化循环水处理技术在罗氏沼虾苗种繁育中的应用[D]. 上海:上海海洋大学. [Zhang R Q. 2015. Application of recirculating water treatment technology in the breeding of Macrobrachium rosenbergii[D]. Shanghai:Shanghai Ocean University.] 赵广泰,刘贤德,王志勇,蔡明夷,姚翠鸾. 2010. 大黄鱼连续4代选育群体遗传多样性与遗传结构的微卫星分析[J]. 水产学报,34(4):500-507. [Zhao G T,Liu X D,Wang Z Y,Cai M Y,Yao C L. 2010. Genetic structure and genetic diversity analysis of four consecutive breeding ge-nerations of large yellow croaker(Pseudosciaena crocea) using microsatellite markers[J]. Journal of Fisheries of China,34(4):500-507.] 赵彦花,区又君,温久福,李加儿,周慧. 2019. 基于转录组测序技术的黄唇鱼SSR分子标记筛选[J]. 南方农业学报,49(11):2078-2087. [Zhao Y H,Ou Y J,Wen J F,Li J E,Zhou H. 2019. Development of SSR markers in Bahaba flavolabiata by transcriptome sequencing[J]. Journal of Southern Agriculture,49(11):2078-2087.] 朱其建,戴習林,邹卫丽,蒋飞,苏建,过正乾,王海洋,丁福江. 2013. 罗氏沼虾抗病选育群体的抗病性能及其遗传多样性分析[J]. 水产学报,37(10):1468-1478. [Zhu Q J,Dai X L,Zou W L,Jiang F,Su J,Guo Z Q,Wang H Y,Ding F J. 2013. Disease resistance and genetic diversity analysis in selected populations of Macrobrachium rosenbergii[J]. Journal of Fisheries of China,37(10):1468-1478.] 邹卫丽. 2012. 罗氏沼虾抗病专门化品系选择前系的选育研究[D]. 上海:上海海洋大学. [Zou W L. 2012. The primary research on specialized strain of Macrobrachium rosenbergii in disease-resistant[D]. Shanghai:Shanghai Ocean University.] Botstein D,White R L,Skolnick M H,Davis R. 1980. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. The American Journal of Human Genetics,32(3):314-331. Chand V,De Bruyn M,Mather P B. 2005. Microsatellite loci in the eastern form of the giant freshwater prawn (Macrobrachium rosenbergii)[J]. Molecular Ecology Notes,5(2):308-310. Kumari A,Shahi S,Kumari R,Mandal S S,Sahay S. 2018. Genetic diversity analysis of maize(Zea mays L.) using SSR markers[J]. Journal of Pharmacognosy and Phytochemistry,(S1):1116-1120. Supungul P,Sootanan P,Klinbunga S,Kamonrat W,Jarayabhand P,Tassanakajon1 A. 2000. Microsatellite polymor-phism and the population structure of the black tiger shrimp(Penaeusm onodon) in Thailand[J]. Marine Biotechnology(New York),2(4):339-347. Suwit W,Prajuab L,Apichart V,Somvong T. 2003. Development of microsatellite markers in black tiger shrimp (Penaeus monodon Fabricius)[J]. Aquaculture,224(1):39-50.

