虾虹彩病毒TaqMan-MGB探针荧光定量PCR检测方法的建立
韦信贤 陈孝宇 贾鹏 王瑞 谭红连 杨慧赞 童桂香 黄光华


摘要:【目的】建立檢测虾虹彩病毒(SIV)的TaqMan-MGB探针荧光定量PCR,为实现虾虹彩病毒病(SIVD)快速诊断及疫情监测提供一种新的技术手段。【方法】根据SIV的MCP基因保守序列设计特异性引物和TaqMan-MGB探针,将目的片段克隆至pMD18-T载体制备重组质粒pMD18-T-MCPSIV;优化反应体系及扩增条件后建立检测SIV的TaqMan-MGB探针荧光定量PCR,以pMD18-T-MCPSIV为标准品绘制标准曲线,并通过特异性、敏感性、重复性试验及临床应用验证其实用性。【结果】制备的重组质粒(pMD18-T-MCPSIV)DNA稳定性好,满足作为标准品的要求;标准品起始模板范围为2.0×101~2.0×109拷贝/反应时,建立的标准曲线具有良好线性关系。优化后的TaqMan-MGB探针荧光定量PCR灵敏度高,对重组质粒的检测灵敏度可达20拷贝/反应,对虾组织SIV的检测灵敏度约10拷贝/mg,其临床检测的敏感性与套式PCR相当;与虾类其他常见病原无交叉反应,组内和组间变异系数分别为0.27%~0.54%和0.61%~0.95%,且扩增与产物分析同步完成,整个检测过程仅需1 h左右。采用建立的TaqMan-MGB探针荧光定量PCR与目前农业农村部推荐的套式PCR同时对276份临床虾样品进行SIV检测,结果显示,两种方法的大部分检测结果一致,符合率为98.6%,但检测低拷贝数样品时前者具有更高的灵敏度。2018和2019年广西虾样品的SIV阳性检出率分别为19.7%和7.5%,且养殖凡纳滨对虾、罗氏沼虾和红螯螯虾均检测到SIV阳性。【结论】基于SIV MCP基因保守序列建立的TaqMan-MGB探针荧光定量PCR检测方法具有灵敏度高、特异性强、重复性好、定量范围宽及简单快速等优点,适用于虾类样品SIV检测,可为SIVD快速诊断及疫情监测提供一种新的技术手段。
关键词: 虾虹彩病毒(SIV);MCP基因;TaqMan-MGB探针;荧光定量PCR;套式PCR
中图分类号: S945.4 文献标志码: A 文章编号:2095-1191(2020)02-0404-08
Development of TaqMan-MGB probe fluorescence quantitative PCR for detection of shrimp iridescent virus
WEI Xin-xian1, CHEN Xiao-yu2, JIA Peng3, WANG Rui1, TAN Hong-lian1,
YANG Hui-zan1, TONG Gui-xiang1*, HUANG Guang-hua1*
(1Guangxi Academy of Fishery Sciences/Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture, Nanning 530021, China; 2Technology Center of Wuhan Customs, Wuhan 430050, China; 3Shenzhen Customs/State Key Quarantine Laboratory of Aquatic Animal Diseases, Shenzhen, Guangdong 518045, China)
Abstract:【Objective】The TaqMan-MGB probe fluorescence quantitative PCR detection method for shrimp iridescent virus(SIV) was developed in order to provide a new detection technology for clinical diagnosis and epidemic monitoring of shrimp iridescent virus disease(SIVD). 【Method】A pair of specific primers and a fluorogenic-labeled TaqMan-Minor Groove Binder(TaqMan-MGB) probe were designed based on the conserved sequence of MCP gene in SIV, and the target fragments were cloned into the pMD18-T vector to construct pMD18-T-MCPSIV recombinant plasmids. Then the TaqMan-MGB probe fluorescence quantitative PCR detection method was developed after optimizing reaction system and amplification, the standard curve was established for quantitative analysis with pMD18-T-MCPSIV as standards and the specificity, sensitivity, reproducibility tests and detection of clinical samples were carried out to evaluate the applicability of this method. 【Result】The prepared recombinant plasmid DNA of pMD18-T-MCPSIV had good stability and could meet the requirements of the standards, and the standard curve showed a good linear relationship with quantitative range from 2.0×101 to 2.0×109 copies/reaction. The optimized TaqMan-MGB probe fluorescence quantitative PCR method had a high sensitivity with the detection limit as low as to 20 copies/reaction for the pMD18-T-MCPSIV and approximately 10 copies/mg for the shrimp tissue samples, and its clinical detection sensitivity was comparable to nested PCR. It had no cross reaction with common shrimp pathogens, the variation coefficients of intra-group and inter-group were 0.27%-0.54% and 0.61%-0.95%, amplification could be completed together with products analysis and the entire detection could be completed within 1 h for a single sample. The TaqMan-MGB probe fluorescence quantitative PCR and nested PCR method recommended by Ministry of Agriculture and Rural Affairs were adopted to detect 276 clinical samples, the results showed that most of the results were the same with coincidence rate of 98.6%. But TaqMan-MGB probe fluorescence quantitative PCR had better sensitivity in detecting samples with low copies SIV. The SIV positive rates of Guangxi were 19.7% in 2018 and 7.5% in 2019, respectively. SIV positive samples were detected in aquaculture Litopenaeus vannamei, Macrobrachium rosenbergii and Cherax quadricarinatus. 【Conclusion】The TaqMan-MGB probe fluorescence quantitative PCR assay based on MCP gene conservative sequence in SIV developed in the study is fast, sensitive, specific, reproducible and of wide quantitative range, making it an ideal method for detecting SIV in shrimp clinical samples and a new technique for the diagnosis and monitoring of SIVD.
Key words: shrimp iridescent virus(SIV); MCP gene; TaqMan-MGB probe; fluorescence quantitative PCR; nes-ted PCR
Foundation item:Guangxi Innovation Driven Development Project(Guike AA17204081-4); Guangxi Key Research and Development Project(Guike AB16380035); Independent Project of Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture(19-A-03-03); Scientific Research Project of Wuhan Customs(2019WK003)
0 引言
【研究意义】虾血细胞虹彩病毒(Shrimp hemocyte iridescent virus,SHIV)是近年发现的一种新型虹彩病毒,与红螯螯虾虹彩病毒(Cheraxquadricarinatus iridovirus,CQIV)的基因组序列相似性达99%,但现有的检测方法尚无法将二者区分,故统称为虾虹彩病毒(Shrimp iridescent virus,SIV)(Xu et al.,2016;Li et al.,2017;Qiu et al.,2017,2018b)。SIV可感染凡纳滨对虾、罗氏沼虾、红螯螯虾和中国对虾等多种经济养殖虾类并引起大规模死亡,还能感染浮游生物、河虾、鲫、螺蛳及河蟹等常见水生生物成为传染源传播病毒(Xu et al.,2016;王甘翔等,2018;Qiu et al.,2019)。近年来,从我国沿海多个省(市)的虾类监测样品中检测出SIV,检出品种包括凡纳滨对虾、罗氏沼虾、中国对虾、红螯螯虾和克氏原螯虾等主要养殖虾类品种,表明SIV已成为我国虾类养殖业面临的新威胁(李清和陈家永,2017)。目前针对病毒病尚无有效的治疗方法,主要采取避免接触感染的预防措施,而这又依赖于病毒传染源的快速检测。因此,建立一种快速、准确的SIV检测方法,可为亲虾筛选、虾苗检疫及疫情监测等提供重要技术手段,对有效防控SIV感染引起的虾类病害具有重要意义。【前人研究进展】随着SIV基因组序列测定的完成与发布及SIV检测的需求(Li et al.,2017),SIV快速检测技术如套式PCR、TaqMan探针定量PCR和LAMP等相继问世(Qiu et al.,2017,2018a;郑晓叶等,2018)。在实际检测工作中,套式PCR虽敏感性高,但需两轮PCR及电泳,操作繁琐,检测耗时长且多次开盖极易交叉污染;TaqMan探针定量PCR由于探针长度太长,敏感性不够理想;LAMP具有灵敏、快速的特点,但在实验室条件下易出现假阳性。TaqMan-MGB探针是在TaqMan探针3'端连上不发光的淬灭基团MGB(Minor groove binder)结合物,与TaqMan探针相比具有探针长度短、稳定性好及分辨率高等特点(Letertre et al.,2003;施开创等,2018;童桂香等,2019),凭借其技术优势在各种病原体检测中已得到广泛应用。刘俊等(2009)建立的一步TaqMan-MGB荧光定量PCR能有效鉴别猪瘟野毒株和HCLV疫苗株,且特异性好、灵敏度高;刘毅等(2014)基于犬细小病毒(CPV)VP2基因的保守區域建立了快速检测CPV的TaqMan-MGB荧光定量PCR检测方法;聂福平等(2017)建立了可鉴别牛结节性皮肤病病毒(LSDV)的TaqMan-MGB荧光定量PCR检测方法;施开创等(2018)建立针对黏菌素耐药基因mcr-1的TaqMan-MGB荧光定量PCR检测方法,为临床监控mcr-1基因携带细菌提供了技术支持;孙菲等(2018)建立了快速检测耐药结核分枝杆菌的多重TaqMan-MGB探针检测体系,可同时检测6个结核突变位点。在水生生物病毒检测方面,马冬梅等(2011)建立了检测大口黑鲈溃疡综合征病毒(LBUSV)的TaqMan-MGB探针荧光定量PCR;韦信贤等(2011a)建立了检测对虾桃拉综合征病毒(TSV)的TaqMan-MGB探针荧光定量RT-PCR;童桂香等(2019)建立了检测致对虾急性肝胰腺坏死病副溶血弧菌(VpAHPND)的TaqMan-MGB探针荧光定量PCR。【本研究切入点】鉴于现有SIV检测方法的不足及TaqMan-MGB探针应用于荧光定量PCR的优势,将TaqMan-MGB探针应用于SIV检测有助于实现虾虹彩病毒病(SIVD)的快速诊断及有效防控,但至今未见采用TaqMan-MGB探针荧光定量PCR检测SIV的相关报道。【拟解决的关键问题】建立并优化针对SIV的TaqMan-MGB探针荧光定量PCR检测方法,提高SIV的检测效率和敏感性,为实现SIVD快速诊断及疫情监测提供一种新的技术手段。
1 材料与方法
1. 1 试验材料
SIV、白斑综合征病毒(WSSV)、传染性皮下和造血器官坏死病毒(IHHNV)、虾肝肠胞虫(EHP)及VpAHPND等阳性材料均由广西水产遗传育种与健康养殖重点实验室鉴定并保存(童桂香等,2013,2014,2019);健康无SIV感染凡纳滨对虾采自国家级广西SPF凡纳滨对虾良种场;276份虾样品主要采自广西钦州、北海、防城港、南宁和来宾等地的养殖场,品种有凡纳滨对虾、罗氏沼虾、红螯螯虾和克氏原螯虾,其中2018年收集142份样品、2019年收集134份样品。
动物组织基因组DNA快速提取试剂盒、2×F8 FastLong PCR MasterMix、DL2000 DNA Marker、氨苄青霉素、大肠杆菌DH5α感受态细胞、琼脂糖凝胶回收试剂盒及质粒小量提取试剂盒购自北京艾德莱生物技术有限公司;pMD18-T载体克隆试剂盒和Probe qPCR Mix购自宝生物工程(大连)有限公司;琼脂糖购自英韦创津生物科技有限公司;其他试剂均为国产分析纯。荧光定量PCR仪(Mx3005P)购自安捷伦科技有限公司。
1. 2 TaqMan-MGB探针荧光定量PCR检测方法的建立
1. 2. 1 引物与TaqMan-MGB探针设计及合成 SIV主衣壳蛋白(Major capsid protein,MCP)基因中含有许多高度保守的结构域(Tidona et al.,1998),故本研究以SIV的MCP基因为检测靶基因。采用Primer Express v3.0按荧光定量PCR引物和TaqMan-MGB探针的设计原则,在MCP基因(KY681039)保守区域设计多组特异性的扩增引物和TaqMan-MGB探针,其中,TaqMan-MGB探针5'端标记荧光染料FAM、3'端标记MGB基团,并通过NCBI数据库进行BLAST同源性比对分析后,委托生工生物工程(上海)股份有限公司合成。经试验初筛,选择一套效果较好的引物及TaqMan-MGB探针(表1)用于SIV荧光定量PCR检测方法的建立。
1. 2. 2 病原DNA提取及重组质粒标准品制备 取50 mg阳性病料组织,按照动物组织基因组DNA快速提取试剂盒说明提取虾类常见病原SIV、WSSV、IHHNV、EHP和VpAHPND的DNA,然后加入50 μL洗脱缓冲液(EB)溶解DNA,-20 ℃保存备用。参照韦信贤等(2011b)的研究方法制备重组质粒(pMD18-T-MCPSIV)标准品,提取重组质粒DNA,采用核酸蛋白分析仪测定其浓度并转换为拷贝数;将重组质粒DNA以10倍梯度稀释至1.0×100 ~1.0×109拷贝/μL作为标准品,-20 ℃保存备用。
1. 2. 3 荧光定量PCR反应条件优化 选用3个梯度(1.0×109、1.0×105、1.0×101拷贝/μL)的标准品DNA为模板,按试剂说明在56~64 ℃范围内,采用1 ℃的温度梯度进行荧光定量PCR扩增,以获得较低阈值循环数(Ct)和较高相对荧光强度增加值(ΔRn)时的温度为最佳退火温度。同时,以3个梯度(1.0×109、1.0×105、1.0×101拷贝/μL)的标准品DNA为模板,采用不同的引物终浓度(0.1、0.2、0.3、0.4、0.5、0.6、0.7和0.8 μmol/L)与TaqMan-MGB探针终浓度(0.1、0.2、0.3、0.4和0.5 μmol/L)组合进行荧光定量PCR扩增,以获得较低Ct和较高ΔRn时的浓度组合为最佳引物和探针浓度组合。
1. 2. 4 标准曲线建立及敏感性试验 以10个梯度(1.0×109 ~1.0×100拷贝/μL)的标准品DNA为模板,采用优化后的TaqMan-MGB探针荧光定量PCR进行扩增;利用仪器自带的数据分析软件进行分析,建立起始模板拷贝数(x)对数与Ct(y)间的标准曲线和线性回归方程,并根据各标准品DNA扩增结果判断该方法的定量范围和敏感性。
1. 2. 5 特异性试验 分别以SIV、WSSV、IHHNV、EHP和VpAHPND的DNA为模板,采用优化后的TaqMan-MGB探针荧光定量PCR进行检测,评价其特异性。
1. 2. 6 重复性试验 选取3个梯度(1.0×107、1.0×106、1.0×105拷贝/μL)的标准品DNA为模板,在间隔第7和第14 d分别进行重复试验,每个梯度设3个平行,记录各次试验的Ct,并统计分析组内和组间的变异系数,以检测标准品的稳定性及该方法的重复性。变异系数(CV)=标准偏差(SD)/平均数(MN)。
1. 3 TaqMan-MGB探针荧光定量PCR与套式PCR的敏感性比较
按1.2.2提取SIV阳性病料组织的DNA,以10倍梯度进行稀释(100~10-5),取2 μL各梯度DNA为模板,进行TaqMan-MGB探针荧光定量PCR和套式PCR扩增(农业农村部SIV监测计划推荐方法),比较二者的敏感性。
1. 4 临床样品检测试验
按1.2.2提取临床样品总DNA,分别采用TaqMan-MGB探针荧光定量PCR和套式PCR对276份临床样品(凡纳滨对虾、红螯螯虾、罗氏沼虾和克氏原螯虾)进行SIV检测,比较检测结果以检验TaqMan-MGB探针荧光定量PCR的临床实用性。
2 结果与分析
2. 1 重组质粒标准品制备
采用PCR扩增SIV的MCP基因,获得的目的条带大小与预期结果一致(图1)。回收纯化目的片段后克隆至pMD18-T载体,即获得重组质粒pMD18-T-MCPSIV。以重组质粒pMD18-T-MCPSIV转化DH5α感受态细胞,经扩大培养后进行PCR鉴定及测序分析,确定所得的目的基因序列与GenBank已公布MCP基因部分序列的同源性达100%,说明MCP基因片段已正确连接至pMD18-T载体上。取阳性克隆菌液提取质粒,测定其浓度并转换为拷贝数,重组质粒pMD18-T-MCPSIV浓度为4.62×109拷贝/μL,满足标准品的要求。
2. 2 TaqMan-MGB探針荧光定量PCR反应条件的优化结果
经比较不同退火温度及不同引物和TaqMan-MGB探针浓度组合的扩增效果,最终确定TaqMan-MGB探针荧光定量PCR反应体系20.0 μL:Probe qPCR Mix(2×)10.0 μL,ROX Reference DyeⅡ0.2 μL,上、下游引物SIV-qF1/SIV-qR1(10 μmol/L)各0.8 μL,TaqMan-MGB探针(5 μmol/L)1.6 μL,DNA模板2.0 μL,以灭菌ddH2O补足至20.0 μL。扩增程序:95 ℃预变性30 s;95℃ 5 s,58 ℃ 45 s,进行40个循环;在58 ℃结束时收集荧光信号。
2. 3 TaqMan-MGB探针荧光定量PCR扩增标准曲线及其敏感性
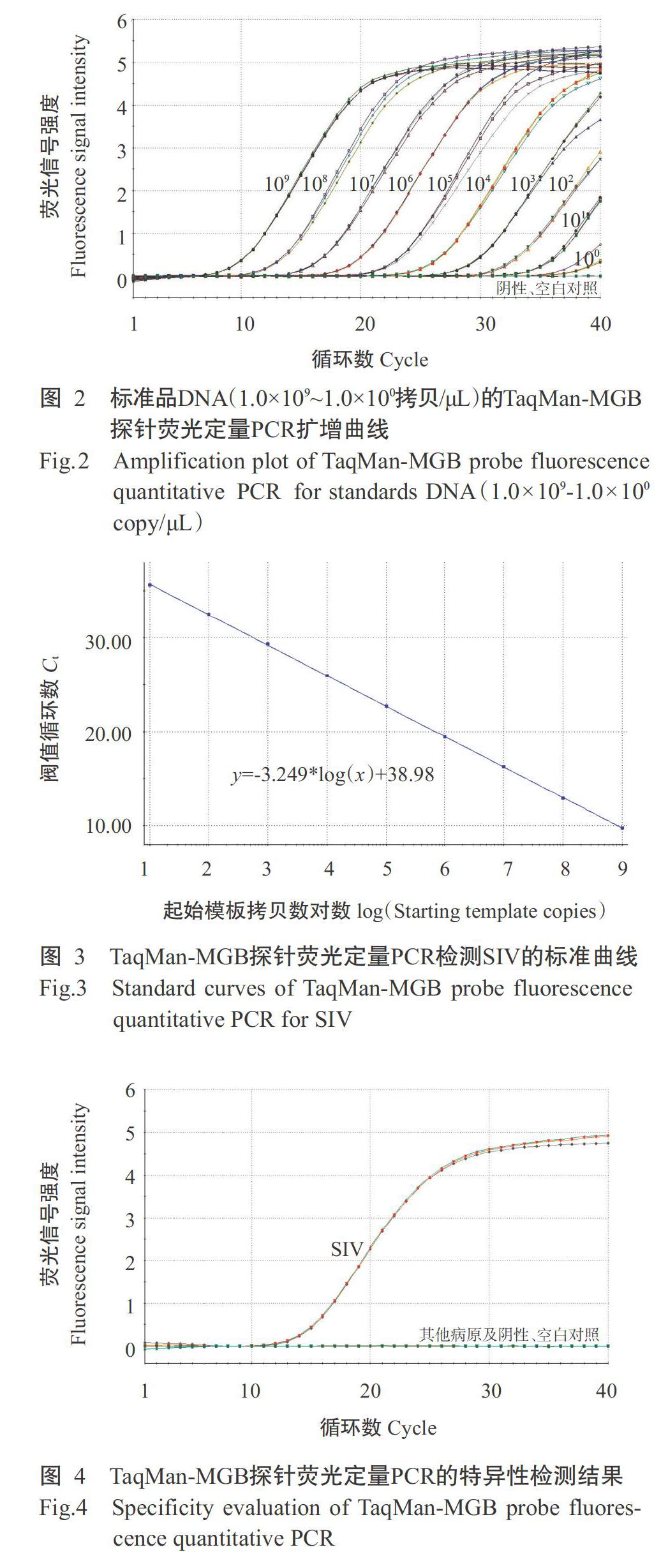
以10倍梯度稀释的标准品DNA为模板进行TaqMan-MGB探针荧光定量PCR扩增,结果(图2)显示,高浓度标准品(1.0×109~1.0×104拷贝/μL)的扩增曲线呈明显S形,低浓度标准品(1.0×103~1.0×100拷贝/μL)的扩增曲线因未达扩增平台期呈半S形,各梯度标准品DNA的扩增曲线重复性好、荧光强度增量明显、间距均匀;标准品DNA浓度为1.0×109~1.0×101拷贝/μL时,建立的标准曲线线性关系良好(图3),对应的线性回归方程为y=-3.249*log(x)+38.98,Eff.(扩增效率)和RSq(相关系数方值)分别为103.1%和1.000。可见,建立的TaqMan-MGB探针荧光定量PCR对标准品的扩增效率高,起始模板范围为2.0×101~2.0×109拷贝/反应时,其标准曲线能准确反映目的产物的扩增结果,可用于定量分析。
经分析发现,标准品DNA为20拷贝/反应时,3个重复的Ct分别为34.91、35.04和35.04,仍有明显的扩增曲线(图2),且重复性好;标准品DNA为2拷贝/反应时,3个重复的Ct分别为37.47、38.85和38.98,重复性较差。因此,确定TaqMan-MGB探针荧光定量PCR的灵敏度约20拷贝/反应。为确保检测结果的准确性,使用该方法检测SIV时建议以35.00为Ct的临界值,若检测样品的Ct小于或等于35.00,且有扩增曲线,则判为SIV阳性;Ct大于35.00,且有扩增曲线,需重复1次,如结果一致则判为SIV阳性;Ct大于35.00,重复结果未出现扩增曲线,则判为SIV阴性。
2. 4 TaqMan-MGB探针荧光定量PCR的特异性
采用建立的TaqMan-MGB探针荧光定量PCR对虾类常见病原(SIV、WSSV、IHHNV、EHP和VpAHPND)的DNA进行检测,结果显示只有SIV出现扩增曲线(图4),Ct分别为15.78、15.82和15.84,判为阳性;而其他病原均未出现扩增曲线,判为阴性。说明建立的TaqMan-MGB探针荧光定量PCR对SIV检测具有很强的特异性。
2. 5 TaqMan-MGB探针荧光定量PCR的重复性
1.0×107、1.0×106、1.0×105拷贝/μL 3组标准品的重复性试验结果见表2,其组内变异系数为0.27%~0.54%,组间变异系数为0.61%~0.95%,表明建立的TaqMan-MGB探针荧光定量PCR重复性和重现性均很好,检测结果稳定可靠;同时说明本研究制备的重组质粒DNA稳定性好,可作为标准品和阳性对照使用。
2. 6 TaqMan-MGB探针荧光定量PCR与套式PCR的敏感性比较
采用TaqMan-MGB探针荧光定量PCR和套式PCR分别对10倍梯度稀释的SIV阳性DNA(100~10-5)进行检测,结果(图5和图6)显示,两种方法均可检测到10-4稀释度的阳性DNA,即TaqMan-MGB探针荧光定量PCR可达到套式PCR的敏感度。
2. 7 TaqMan-MGB探针荧光定量PCR和套式PCR检测临床样品的结果比较
分别采用TaqMan-MGB探针荧光定量PCR和套式PCR对276份临床虾样品进行检测,检测结果见表3。其中,有34份虾样品的两种检测结果均呈阳性,Ct为18.95~34.29,根据线性回归方程y=-3.249*log(x)+38.98計算可知,其SIV拷贝数在2.76×101~1.46×106 拷贝/反应,虾样品组织中的SIV含量为1.38×101~7.30×105 拷贝/mg;有3份虾样品的TaqMan-MGB探针荧光定量PCR检测呈阳性而套式PCR检测呈阴性,Ct为35.87~36.42,其SIV拷贝数在9.06×100~6.14×100拷贝/反应,虾样品组织中的SIV含量为4.53×100~3.10×100 拷贝/mg;有238份虾样品的两种检测结果均为阴性。说明在实际检测工作中进行40个循环时,采用TaqMan-MGB探针荧光定量PCR检测虾组织SIV的灵敏度约10拷贝/mg。2018和2019年广西虾样品的SIV阳性检出率分别为19.7%(28/142)和7.5%(10/134),且养殖凡纳滨对虾、罗氏沼虾和红螯螯虾均检测到SIV阳性。
3 讨论
SIV感染养殖凡纳滨对虾、罗氏沼虾、红螯螯虾等虾类可造成较高的死亡率,给虾类养殖业造成巨大经济损失。SIV具有多种易感宿主,且存在明显的跨物种传播趋势,给其防控带来极大挑战(陈形,2019)。虽然SIVD至今尚未被世界动物卫生组织(OIE)收录,但我国从2017年起已将其纳入《国家水生动物疫病监测计划》。因此,快速、准确检测SIV感染对有效防控SIVD流行具有重要意义。目前,OIE和国内均未发布SIV检测的相关标准,仅农业农村部在SIVD监测计划中推荐采用套式PCR进行检测。在实际检测工作中,套式PCR存在操作繁琐、检测耗时长、不可定量等缺点,尤其在PCR分区条件有限的实验室极易形成气溶胶污染环境而出现假阳性。TaqMan-MGB探针荧光定量PCR不仅能发挥荧光定量PCR的优势而克服套式PCR的缺点,其探针的MGB基团相对于TaqMan探针还有利于提高方法的灵敏度,非常适用于对灵敏度要求高的病原体定量检测(Afonina et al.,1997)。
本研究根据SIV MCP基因的保守性及TaqMan-MGB探针的优势,在MCP基因保守序列设计特异性引物及TaqMan-MGB探针,制备重组质粒pMD18-T-MCPSIV标准品,并对引物和探针使用浓度及退火温度进行优化,建立了检测SIV的TaqMan-MGB探针荧光定量PCR。结果表明,制备的重组质粒DNA稳定性好,满足作为标准品和阳性对照的要求;起始模板范围为2.0×101~2.0×109拷贝/反应时,建立的标准曲线具有良好的线性关系,能准确反映目的产物的扩增结果;优化后的TaqMan-MGB探针荧光定量PCR灵敏度高,对重组质粒的检测灵敏度可达20拷贝/反应,对虾组织SIV的检测灵敏度约10个拷贝/mg,其临床检测的敏感性与套式PCR相当;特异性强,与虾类其他常见病原无交叉反应;重复性好,组内和组间变异系数均小于1.00%;且扩增与产物分析同步完成,整个检测过程仅需1 h左右。可见,本研究建立的TaqMan-MGB探针荧光定量PCR不仅能满足临床上对SIV检测技术高灵敏度的需求,还具有操作简单、检测快速及可定量分析等优点。
采用建立的TaqMan-MGB探针荧光定量PCR与目前农业农村部推荐的套式PCR同时对276份临床虾样品进行检测,结果显示,两种方法的大部分检测结果一致,符合率为98.6%,同为阳性检测结果的虾样品含SIV拷贝数较高,而检测结果不一致的虾样品含SIV拷贝数均较低(低于10拷贝/mg);TaqMan-MGB探针荧光定量PCR的阳性检出率较套式PCR稍高,即发挥出TaqMan-MGB探针提高扩增效率及灵敏度的优势。说明采用建立的TaqMan-MGB探针荧光定量PCR检测SIV高拷贝数样品时准确性高,而检测低拷贝数样品时较套式PCR具有更高的灵敏度,可为SIVD临床诊断及疫情监测提供一种新的技术手段。此外,从养殖虾样品的检测结果来看,2018和2019年广西虾样品的SIV阳性检出率分别为19.7%和7.5%,且养殖凡纳滨对虾、罗氏沼虾和红螯螯虾均检测到SIV阳性,与实际调研发现2018—2019年广西出现多例养殖凡纳滨对虾和红螯螯虾因暴发SIVD引起大量死亡的情况相符,说明SIV已成为危害广西养殖虾类的主要病原之一,尤其是SIV在虾体中携带和潜伏感染情况应引起有关部门及相关从业者的高度重视。
4 结论
基于SIV MCP基因保守序列建立的TaqMan-MGB探针荧光定量PCR检测方法具有灵敏度高、特异性强、重复性好、定量范围宽及简单快速等优点,适用于虾类样品SIV检测,可为SIVD快速诊断及疫情监测提供一种新的技术手段。
参考文献:
陈形. 2019. 十足目虹彩病毒1(DIV1)的易感宿主调查[D]. 上海:上海海洋大学. [Chen X. 2019. Susceptible host survey of decapod iridescent virus 1(DIV1)[D]. Shanghai:Shanghai Ocean University.]
李清,陈家永. 2017. 2017年我国水生动物重要疫病病情分析[M]. 北京:中国农业出版社:187-204. [Li Q,Chen J Y. 2017. Analysis of important aquatic animal diseases in China in 2017[M]. Beijing:China Agriculture Press:187-204.]
刘俊,王琴,范学政,徐璐,赵启祖,黄伟,汤波,沙莎,周远成,陈蕾,邹兴启. 2009. 猪瘟病毒野毒株TaqMan-MGB荧光定量PCR鉴别方法的建立与应用[J]. 中国农业科学,42(12):4366-4371. [Liu J,Wang Q,Fan X Z,Xu L,Zhao Q Z,Huang W,Tang B,Sha S,Zhou Y C,Chen L,Zou X Q. 2009. Differentiation of wild-type viruses and HCLV vaccine of classical swine fever virus by one-step fluorescent quantitative PCR using TaqMan-MGB probe techno-logy[J]. Scientia Agricultura Sinica,42(12):4366-4371.]
刘毅,吴志明,闫若潜,赵明军,王东方,赵雪丽,刘梅芬,程俊贞,薛晓,李宁. 2014. 犬細小病毒TaqMan-MGB荧光定量PCR检测方法的建立及应用[J]. 中国畜牧兽医,41(6):68-73. [Liu Y,Wu Z M,Yan R Q,Zhao M J,Wang D F,Zhao X L,Liu M F,Cheng J Z,Xue X,Li N. 2014. Establishment and application of TaqMan-MGE fluorescent-quantitative PCR assay for detection of canine parvovirus[J]. China Animal Husbandry & Veterinary Medicine,41(6):68-73.]
马冬梅,白俊杰,邓国成,李胜杰,张莉莉. 2011. 大口黑鲈溃疡综合征病毒TaqMan-MGB探针荧光定量PCR检测方法的建立[J]. 华南农业大学学报,32(2):99-102. [Ma D M,Bai J J,Dend G C,Li S J,Zhang L L. 2011. Development of a TaqMan-MGB real time PCR assay for largemouth bass ulcerative syndrome virus detection[J]. Journal of South China Agricultural University,32(2):99-102.]
聂福平,王昱,黄秋华,杨俊,韩雪清,唐昌杰,袁曾壮,王国民,候长军,李应国. 2017. 牛结节性皮肤病病毒TaqMan-MGB荧光PCR检测方法的建立[J]. 中国兽医科学,47(9):1129- 1134. [Nie F P,Wang Y,Huang Q H,Yang J,Han X Q,Tang C J,Yuan Z Z,Wang G M,Hou C J,Li Y G. 2017. Establishment of TaqMan-MGB real-time fluo-rescent PCR for rapid detection of lumpy skin disease virus[J]. Chinese Veterinary Science,47(9):1129-1134.]
施开创,尹彦文,温丽霞,屈素洁,王海清,胡杰. 2018. 黏菌素耐药基因mcr-1 TaqMan-MGB荧光定量PCR检测方法的建立[J]. 南方农业学报,49(7):1447-1452. [Shi K C,Yin Y W,Wen L X,Qu S J,Wang H Q,Hu J. 2018. Establishment of TaqMan-MGB fluorescent quantitative PCR for detection of colistin resistance gene mcr-1[J]. Journal of Southern Agriculture,49(7):1447-1452.]
孙菲,易松林,李丹,戴佩希,彭飞武,唐连飞. 2018. 耐药结核分枝杆菌多重TaqMan-MGB探针检测方法的建立[J]. 广东医学,39(4):511-515. [Sun F,Yi S L,Li D,Dai P X,Peng F W,Tang L F. 2018. Establishment of multiple TaqMan-MGB probe detection method for drug resistant Mycobacterium tuberculosis[J]. Guangdong Medical Journal,39(4):511-515.]
童桂香,黎小正,韋信贤,叶欣宇,吴明媛,秦振发,兰柳春,周靓婧. 2014. 凡纳滨对虾白斑综合征病毒广西株变异区基因的比较分析[J]. 病毒学报,30(1):51-56. [Tong G X,Li X Z,Wei X X,Ye X Y,Wu M Y,Qin Z F,Lan L C,Zhou J J. 2014. Comparative analysis of variable region of white spot syndrome virus genome in penaeus vannamei in Guangxi,China[J]. Chinese Journal of Viro-logy,30(1):51-56.]
童桂香,黎小正,吴祥庆,黄鸾玉,黄光华,韦信贤. 2019. TaqMan-MGB探针荧光定量PCR检测致对虾急性肝胰腺坏死病副溶血弧菌[J]. 湖南农业大学学报(自然科学版),45(4):405-411. [Tong G X,Li X Z,Wu X Q,Huang L Y,Huang G H,Wei X X. 2019. TaqMan-MGB probe real-time PCR for detection of Vibrio parahaemolyticus causing acute hepatopancreas necrosis disease in shrimps[J]. Journal of Hunan Agricultural University(Natural Scien-ces),39(4):405-411.]
童桂香,韦信贤,吴伟军,吴祥庆,黄国秋,黄玉柳,叶欣宇,黎小正. 2013. 广西凡纳滨对虾IHHNV感染情况的调查与分析[J]. 南方农业学报,44(12):2089-2093. [Tong G X,Wei X X,Wu W J,Wu X Q,Huang G Q,Huang Y L,Ye X Y,Li X Z. 2013. Investigation and analysis of infectious hypodermal and hematopoietic necrosis virus infection in Penaeus vannamei in Guangxi[J]. Journal of Southern Agriculture,44(12):2089-2093.]
王甘翔,彭頔,宋之琦,杨庆,都月娥,沈佳健. 2018. 浙江省平湖市南美白对虾虹彩病毒病初步调查及防控措施[J]. 水产科技情报,45(3):141-143. [Wang G X,Peng D,Song Z Q,Yang Q,Du Y E,Shen J J. 2018. Preliminary investigation and prevention and control measures for shrimp iridescent virus disease of Litopenaeus vannamei in Pinghu City,Zhejiang[J]. Fisheries Science & Technology Information,45(3):141-143.]
韦信贤,童桂香,谢宗升,黎小正,吴祥庆,廖永志,黄国秋. 2011a. TaqMan-MGB 探针法快速检测对虾Taura综合征病毒的研究[J]. 海洋科学,35(9):37-42. [Wei X X,Tong G X,Xie Z S,Li X Z,Wu X Q,Liao Y Z,Huang G Q. 2011a. TaqMan-MGB probe real-time fluorescence quantitative RT-PCR for rapid detection of taura syndrome virus in shrimps[J]. Marine Sciences,35(9):37-42.]
韦信贤,童桂香,谢宗升,吴祥庆,黄国秋,黄玉柳,廖永志,黎小正. 2011b. TaqMan-LNA探针荧光定量PCR快速检测对虾传染性皮下及造血组织坏死病毒[J]. 南方农业学报,42(12):1545-1549. [Wei X X,Tong G X,Xie Z S,Wu X Q,Huang G Q,Huang Y L,Liao Y Z,Li X Z. 2011b. Rapid detection o f infectious hypodermal and hematopoietic necrosis virus in shrimps using TaqMan-LNA probe real-time PCR[J]. Journal of Southern Agriculture,42(12):1545-1549.]
郑晓叶,郑天伦,黄俊. 2018. 对虾血细胞虹彩病毒(SHIV)荧光LAMP检测方法的建立[C]//浙江省科学技术协会. 2018年(第十三届)浙江渔业科技论坛论文摘要集. [Zheng X Y,Zheng T L,Huang J. 2018. Establishment of fluorescence Loop-Mediated isothermal amplification for decting shrimp hemocyte iridescent virus (SHIV)[C]// Zhejiang Fishery Science and Technology. Proceedings of 2018(the 13th) Zhejiang Fishery Science and Technology Forum.]
Afonina I,Zivarts M,Kutyavin I,Lukhtanov E,Gamper H,Meyer R B. 1997. Efficient priming of PCR with short oligonucleotides conjugated to a minor groove binder[J]. Nucleic Acids Research,25(13):2657-2660.
Letertre C,Perelles,Dilasser F,Arar K,Fach P. 2003. Evaluation of the performance of LNA and MGB probes in 5'-nuclease PCR assays[J]. Molecular and Cellular Probes,17(6):307-311.
Li F,Xu L M,Yang F. 2017. Genomic characterization of a novel iridovirus from redclaw crayfish Cherax quadrica-rinatus:Evidence for a new genuswithin the family Iridoviridae[J]. Journal of General Virology,98(10):2589-2595.
Qiu L,Chen M M,Wan X Y,Li C,Zhang Q L,Wang R Y,Cheng D Y,Dong X,Yang B,Wang X H,Xiang J H,Huang J. 2017. Characterization of a new member of Iridoviridae,shrimp hemocyte iridescent virus(SHIV),found in white leg shrimp(Litopenaeus vannamei)[J]. Scientific Reports,7(1):11834. doi:10.1038/s41598-017-10738-8.
Qiu L,Chen M M,Wan X Y,Zhang Q L,Li C,Dong X,Yang B,Huang J. 2018a. Detection and quantification of shrimp hemocyte iridescent virus by TaqMan probe based real-time PCR[J]. Journal of Invertebrate Pathology,154:95-101.
Qiu L,Chen M M,Wang R Y,Wan X Y,Li C,Dong X,Yang Bing,Xiang J H,Huang J. 2018b. Complete genome sequence of shrimp hemocyte iridescent virus(SHIV) isolated from white leg shrimp,Litopenaeus vannamei[J]. Archives of Virology,163(3):781-785.
Qiu L,Chen X,Zhao R H,Li C,Gao W,Zhang Q L,Huang J. 2019. Description of a natural infection with decapod iridescent virus 1 in farmed giant freshwater prawn,Macrobrachium rosenbergii[J]. Viruses,11(4). doi:10.3390/v11040354.
Tidona C A,Schnitzler P,Kehm R,Darai G. 1998. Is the major capsid protein of iridoviruses a suitable target for the study of viral evolution?[J]. Virus Genes,16(1):59-66.
Xu L M,Wang T T,Li F,Yang F. 2016. Isolation and preliminary characterization of a new pathogenic iridovirus from redclaw crayfish Cherax quadricarinatus[J]. Diseases of Aquatic Organisms,120(1):17-26.

