生物源碳酸钙对污水中Pb(II)和甲基橙吸附行为的研究
杜旭东, 唐城元, 杨小丽, 程建波, 贾玉珂, 杨树斌
生物源碳酸钙对污水中Pb(II)和甲基橙吸附行为的研究
杜旭东1, 唐城元1, 杨小丽2, 程建波1, 贾玉珂1, 杨树斌1
(1. 烟台大学 化学化工学院, 烟台 264005; 2. 华北水利水电大学 环境与市政工程学院, 郑州 450045)
实验采用廉价的牡蛎壳制备绿色、高效的生物源碳酸钙(bio-CaCO3)吸附材料, 用于去除污水中的Pb(II)和甲基橙(MO)。通过扫描电子显微镜(SEM), 热重分析(TGA), X射线荧光光谱分析(XRF)等表征方法对材料形貌、组成、结构等进行了分析。采用宏观吸附行为和微观表征研究bio-CaCO3对水体中Pb(II)和MO的吸附过程并阐明机理。研究发现, bio-CaCO3对MO的去除效率约为45% (sorbent/solvent0.2 g/L, [MO]initial=60 mg/L), SEM分析结果表明bio-CaCO3吸附MO后, 表面形貌发生了明显的变化。bio-CaCO3对Pb(II)的饱和吸附量高达1775 mg/g (pH=5.0,=298 K), 优于传统的皂土、活性炭等吸附材料。bio-CaCO3吸附Pb(II)的主要吸附机理是CaCO3+Pb(II)→PbCO3, 该过程的Δθ=–7.64 kJ/mol, Δθ=–17.92 J/(mol·K), Δθ=–2.30 kJ/mol(pH=5.0,=298 K), 吸附Pb(II)后产生大量形貌更加规则的四棱柱结构。研究表明实验制备的bio-CaCO3对Pb(II)和MO均具有良好的吸附性能, 是一种环境友好型高效吸附剂。
生物源碳酸钙; Pb(II); 甲基橙; 吸附
工业化的快速发展产生了大量成分复杂的工业废水, 其中含有重金属和有机染料的废水是非常常见的工业废水类型。铅(Pb)是一种常见的重金属, 进入人体后会对人的神经系统、消化系统、生殖系统等造成严重的伤害[1-2]。我国染料废水排放量大[3], 并且染料废水的色度大、降解难、毒性高, 对人体和环境都具有严重的破坏性[4]。因此, 有效治理重金属和有机染料污水对环境的保护和人类健康有着重要意义。
化学沉淀法、吸附法、光催化降解、膜分离技术等是目前使用较多的污水净化方法[5-8], 而这些处理方法也存在许多不足。例如化学沉淀法处理低浓度污染物时会稍显逊色[9]; 膜分离技术存在易于堵塞和成本较高的缺点[10]。吸附法具有易操作、 高效、经济等优点, 是治理重金属和有机染料污水方法的重要选择, 尤其是对低浓度重金属废水的处理[11]。吸附法的关键是吸附剂的选择, 绿色、廉价、高效的天然吸附材料无疑是最理想的污水治理吸附剂[12]。
碳酸钙(CaCO3)是自然界中广泛存在的一种矿物质, 按来源可分为生物源碳酸钙和矿物源碳酸钙[13]。与矿物源CaCO3相比, 生物源 CaCO3如贝壳、蛋壳等没有经受去有机化作用和高温高压的石化作用, 形成周期短, 具有环保和可再生特性, 近年来在复合材料的应用方面受到广泛关注[14]。由于廉价和绿色环保的特性, CaCO3还被广泛应用到水处理领域。Zhou等[13]对比了生物源和矿物源CaCO3对污水中Pb(II)的吸附性能, 发现生物源CaCO3具有更高的吸附效率。
牡蛎是我国重要的海产品经济贝类之一, 也是一种重要的生物源CaCO3。目前中国牡蛎的养殖产量超过世界牡蛎总量的89%, 位居世界第一[13]。但随着大规模牡蛎养殖, 大量废弃牡蛎堆积是备受关注的固废污染问题, 且牡蛎壳堆积腐化过程中还会释放难闻的气体, 降低周围居民的生活质量[15-16]。用牡蛎壳制备水处理吸附剂, 既可以为废水处理提供廉价原料, 又可实现牡蛎养殖废弃物的资源化利用。已经有研究者将牡蛎壳应用到废水处理领域, 并取得了不错的净水效果[17-20]。但是, 人们对牡蛎的研究大多停留在单一污染物上, 对多种污染物, 特别是对含有重金属和有机染料的复合废水的探究工作少有报道, 去除效果与吸附机理也尚不明确。
本工作通过煅烧牡蛎壳制备生物源碳酸钙(bio-CaCO3)吸附材料, 以Pb(II)和MO为吸附质, 通过宏观吸附和微观表征来研究bio-CaCO3对不同类型污染物的去除效果, 考虑不同环境因素对 bio- CaCO3的吸附影响, 并详细阐明吸附机理。同时对比常用的吸附材料, 评价该bio-CaCO3的吸附性能及其在水污染治理中的应用前景。
1 实验方法
1.1 Bio-CaCO3的制备
实验所用乳山牡蛎(Rushan oyster)购于海鲜市场。将清洗干净的牡蛎壳置于100 ℃下干燥2 h, 再将牡蛎壳初步粉碎, 放入马弗炉中, 在600 ℃下煅烧2 h, 充分去除牡蛎壳表面的有机质。冷却后研磨、过筛、装瓶, 得到煅烧的牡蛎壳粉即bio-CaCO3材料。
1.2 Bio-CaCO3结构表征
通过SEM (JEOL, JSM-7900F)观察材料的形貌特征以及材料吸附Pb(II)和MO前后的形貌变化。通过XRF (Rigaku, Supermini200)对乳山牡蛎壳中无机组分进行定性和定量分析, 并利用TGA (NETZSCH, STA449 F5)和XRD (Rigaku, Smartlab3)确定材料的主要组分。利用BET (Quantachrome, NOVA3000)分析材料的比表面积和孔径大小。
1.3 吸附性能测定
取0.25 g制备的bio-CaCO3粉末置于广口瓶中, 加入100 mL水, 摇匀, 放入超声清洗机中进一步溶解, 得到2.5 g/L的吸附剂溶液。在聚乙烯管中依次加入一定量的吸附剂溶液、硝酸铅或MO溶液, 以及高氯酸钠离子强度调节剂。通过改变溶液的pH和添加高氯酸钠的量分析吸附过程pH和离子强度影响, 最后用极少量的氢氧化钠或高氯酸溶液调节混合液的pH。然后将聚乙烯管放入恒温振荡器中, 连续振荡24 h后, 将聚乙烯管放入高速离心机中以12000 r/min的转速离心5 min, 再取上清液, 用原子吸收光谱仪(Shimadzu, AA-6880F)检测铅离子或用紫外分光光度计(PerkinElmer, UV/Vis Lambda 365)检测溶液中MO浓度, 并计算去除百分率()[21], 分配系数(d,L/g)和吸附量(,mg/g)[21], 公式如下:
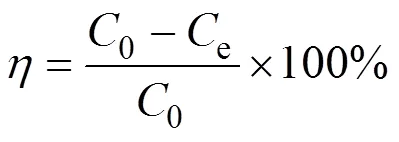
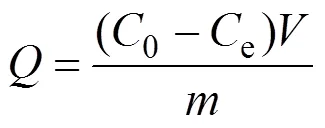
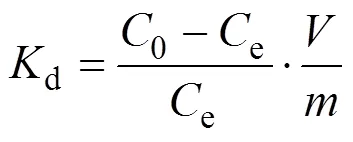
式中,0e为体系中吸附质的初始浓度(mg/L)、平衡浓度,为溶液体积(L),为吸附剂的质量(g)。
吸附动力学研究: 研究不同吸附时间下Pb(II)和MO在bio-CaCO3上的吸附百分数, 分析溶液中未被吸附的Pb(II)和MO浓度与吸附时间的变化关系, 并利用假一级和假二级动力学模型以及颗粒扩散模型分析Pb(II)在bio-CaCO3上的吸附动力学过程。
吸附热力学研究: 对比bio-CaCO3吸附Pb(II)在25、35和50 ℃时的吸附百分数和吸附分配系数, 并用Langmuir和Freundlich对实验数据进行拟合, 分析吸附机理, 同时计算bio-CaCO3吸附Pb(II)吸附过程的热力学参数(Δ、Δ和Δ)。
2 结果与讨论
2.1 乳山牡蛎壳的组成和结构分析
通过 XRF对乳山牡蛎壳中无机组分进行定性和定量分析, 结果如表1所示。牡蛎壳含有的主要无机组成元素为Ca, 质量分数为97.43%, 同时还有少量的Na, Sr, Mg, S, Cl等元素。为了分析牡蛎壳中的有机质成分, 对牡蛎壳进行了热重分析(TGA)。由图1(A)可知, 牡蛎壳在150 ℃以下的失重率为0.2wt%, 基本无质量损失, 这是由于牡蛎壳在煅烧前已经过充分干燥, 含有的水分很少。在233~500 ℃的失重率为1.64wt%, 对应于牡蛎壳中有机质成分的分解。当温度升到600 ℃时, 开始出现明显的失重, 在600~800 ℃范围内, 失重约为42.66wt%。由XRD (图1(B))分析可知, 牡蛎壳主要成分为碳酸钙, 因此上述阶段的质量损失主要是由CaCO3分解造成的。
为了进一步确认牡蛎壳的主要成分, 对乳山牡蛎壳和600 ℃煅烧的牡蛎壳进行XRD分析。从图1(B)可知, 牡蛎壳煅烧前后均在2=29.4°存在一个强峰, 对应方解石的(104)特征衍射峰(JCPDS 05-0586)[5,14]。对比发现牡蛎壳煅烧前后主要成分是方解石型CaCO3[22], 且煅烧后的XRD衍射峰明显峰型尖锐, 证明煅烧后的牡蛎壳粉结晶性能好[12]。
为了分析材料的比表面积和孔径大小, 对煅烧前后的牡蛎壳进行N2-BET表征分析, 结果如表2所示。煅烧后牡蛎孔径变小, 粒径明显增大, 比表面积也相应增加了14.1% (表2)。因此, 通过600 ℃的煅烧, 不仅可去除牡蛎壳表面的有机质, 还可以增大比表面积, 更利于吸附[6]。通过Zeta电位仪分析得到煅烧牡蛎壳粉的平均粒径为4.2 μm, 表明样品的粒径较大, 为微米级材料, 同时牡蛎壳的表面电位为–19.1 mV, 为电负性, 更有利于样品吸附金属阳离子。
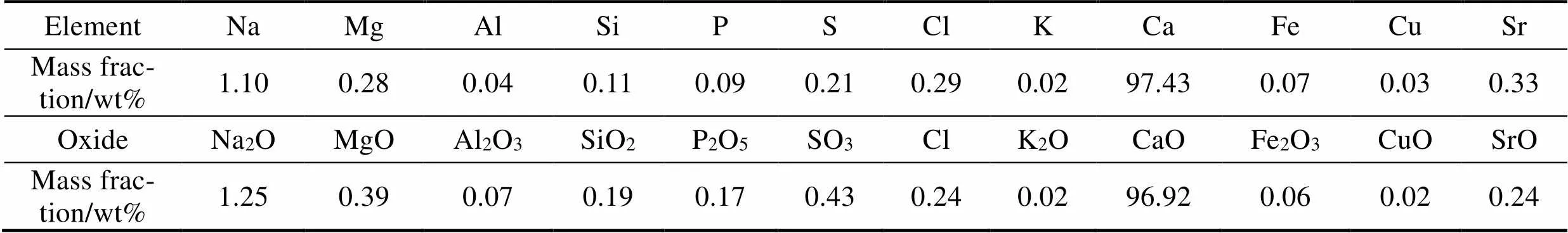
表1 牡蛎壳的XRF分析结果
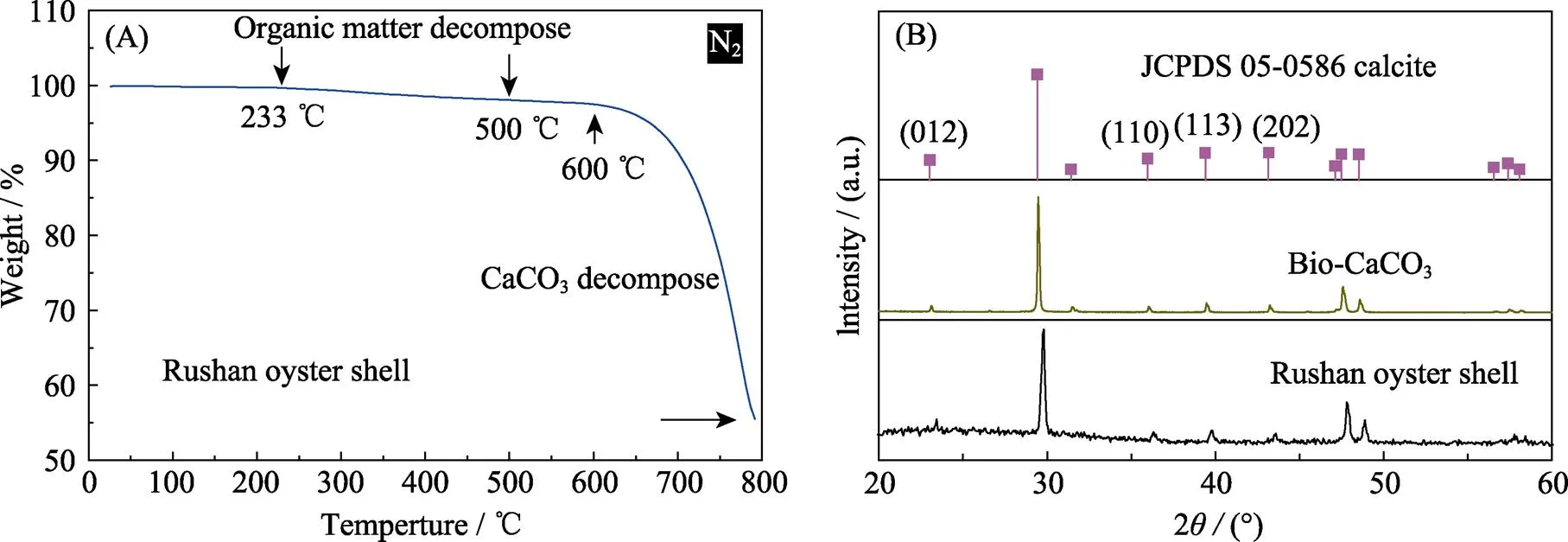
图1 牡蛎壳的热重曲线图(A)和牡蛎壳煅烧前后的XRD图谱(B)
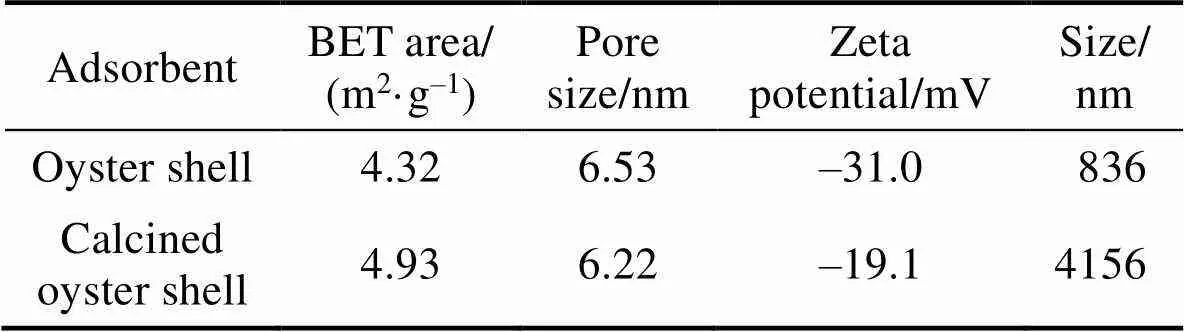
表2 牡蛎壳煅烧前后的物理特性
2.2 吸附时间的影响
将600 ℃煅烧的牡蛎壳作为生物源碳酸钙(bio-CaCO3)吸附材料, 用于去除污水中的重金属离子和有机污染物。为了研究bio-CaCO3的吸附性能, 本实验探讨了不同溶液pH、离子强度、吸附温度、反应时间等条件下bio-CaCO3对Pb(II)和MO的吸附行为和吸附机理。
反应时间对Pb(II)和MO在bio-CaCO3上的吸附效果有明显的影响。从图2(A)可知, 3 h内Pb(II) 的去除率随吸附时间的延长而快速增大, 后趋于稳定, 最终在约5 h时达平衡, 吸附率为52%。产生上述现象的原因是在反应初期, Pb(II)与CaCO3快速反应, Pb(II)的去除率快速上升; 随着bio-CaCO3剩余量不断减少, 反应速率逐渐下降直至为零。由图2(B)可知, MO的去除率也是先快速增加后逐渐变缓, 约在0.5 h时达到平衡, 去除率为20%, 吸附量为25 mg/g。反应初期, bio-CaCO3表面有充足的吸附位点, 保证了MO的快速吸附, 随着接触时间的延长, 吸附位点逐渐被占据, 吸附速率降低, 最后达到动力学吸附平衡。
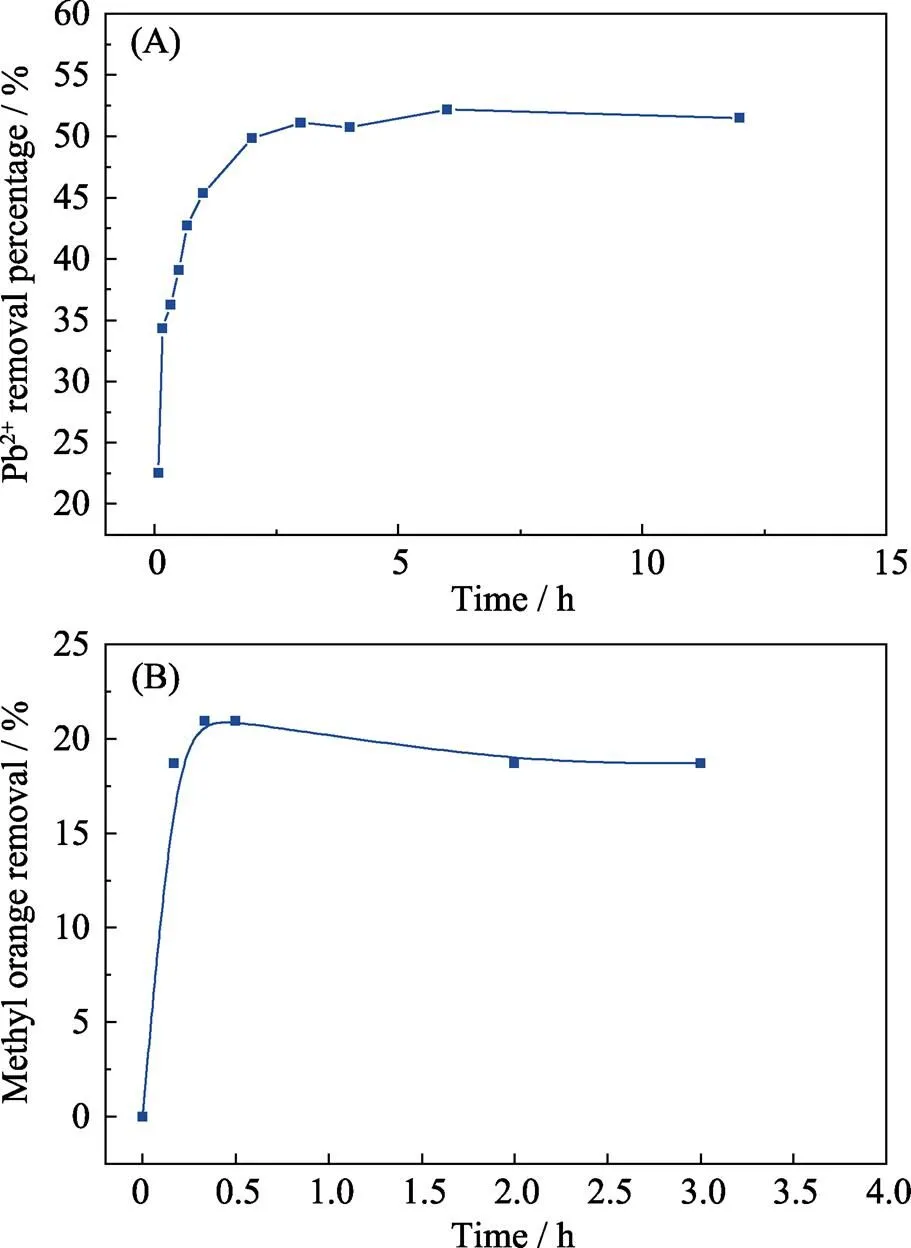
图2 吸附时间对Pb(II)(A)和MO(B)在bio-CaCO3上吸附的影响
=25 ℃, [Pb(II)]initial=753×10–6,/=0.2 g/L, and [NaClO4]=0.01 mol/L, pH=5.0
2.3 吸附动力学
为了研究bio-CaCO3对Pb(II)吸附的反应速率常数, 本工作还对Pb(II)在bio-CaCO3上的吸附进行了动力学分析[13], 具体的动力学拟合方程如下:
假一级动力学方程:
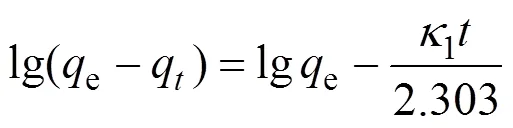
假二级动力学方程:
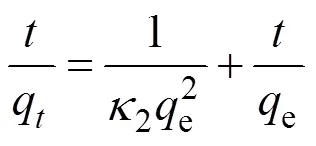
颗粒扩散模型:
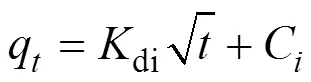
其中,e(mg/g)为平衡吸附量,q(mg/g)为时刻吸附量,1(min–1)和2(g/(mg·min))分别为假一级和假二级动力学速率常数。di(mg/(g∙h1/2))为颗粒内扩散速率常数,C可计算边界层厚度。
图3(A~C)分别是Pb(II)在bio-CaCO3上吸附的假一级、假二级和颗粒扩散模型的动力学拟合曲线。对比可以看出假二级动力学模型拟合得更好,2为0.998 (表3), 表明bio-CaCO3吸附Pb(II)的过程为化学吸附[13]。采用颗粒扩散模型对数据进行拟合 (图3(C)), 相应的拟合参数如表4所示。由图3(C)发现吸附过程分为三个步骤: 第一步是Pb(II)在材料表面的外扩散[13], 此过程由于溶液中Pb(II)具有较高浓度, 在5 min内反应速率很快; 第二步是Pb(II)与bio-CaCO3中的CaCO3的反应阶段[13], 反 应速率相对降低; 第三步是吸附平衡过程, 溶液 中Pb(II)残余浓度较低, 反应放缓, 吸附逐渐达到 平衡。
2.4 pH和离子强度影响
溶液pH可以改变吸附剂的表面电荷、金属离子的不同形态等, 进而影响化学吸附过程。由图4(A)可知, 随着溶液pH的增大, Pb(II)去除率先快速升高后达到平衡, 最后再下降。当pH<5时, 溶液中含有大量的H+离子, CaCO3与H+反应, 使吸附剂含 量下降, Pb(II)的去除量降低[5]。随着pH的增大, 牡蛎表面的电负性增强, 由于静电相互作用, 更利于带正电Pb(II)的吸附去除。当pH=6~10时, Pb(II)主要是以Pb(OH)+的形式存在[1], Pb(II)与bio-CaCO3充分反应直到平衡。当pH>11时, 溶液中的Pb(II)以Pb(OH)2和Pb(OH)3–的形式存在, 产生沉淀, 同时Pb(OH)3–与带负电的bio-CaCO3有排斥作用, 不利于吸附[23]。
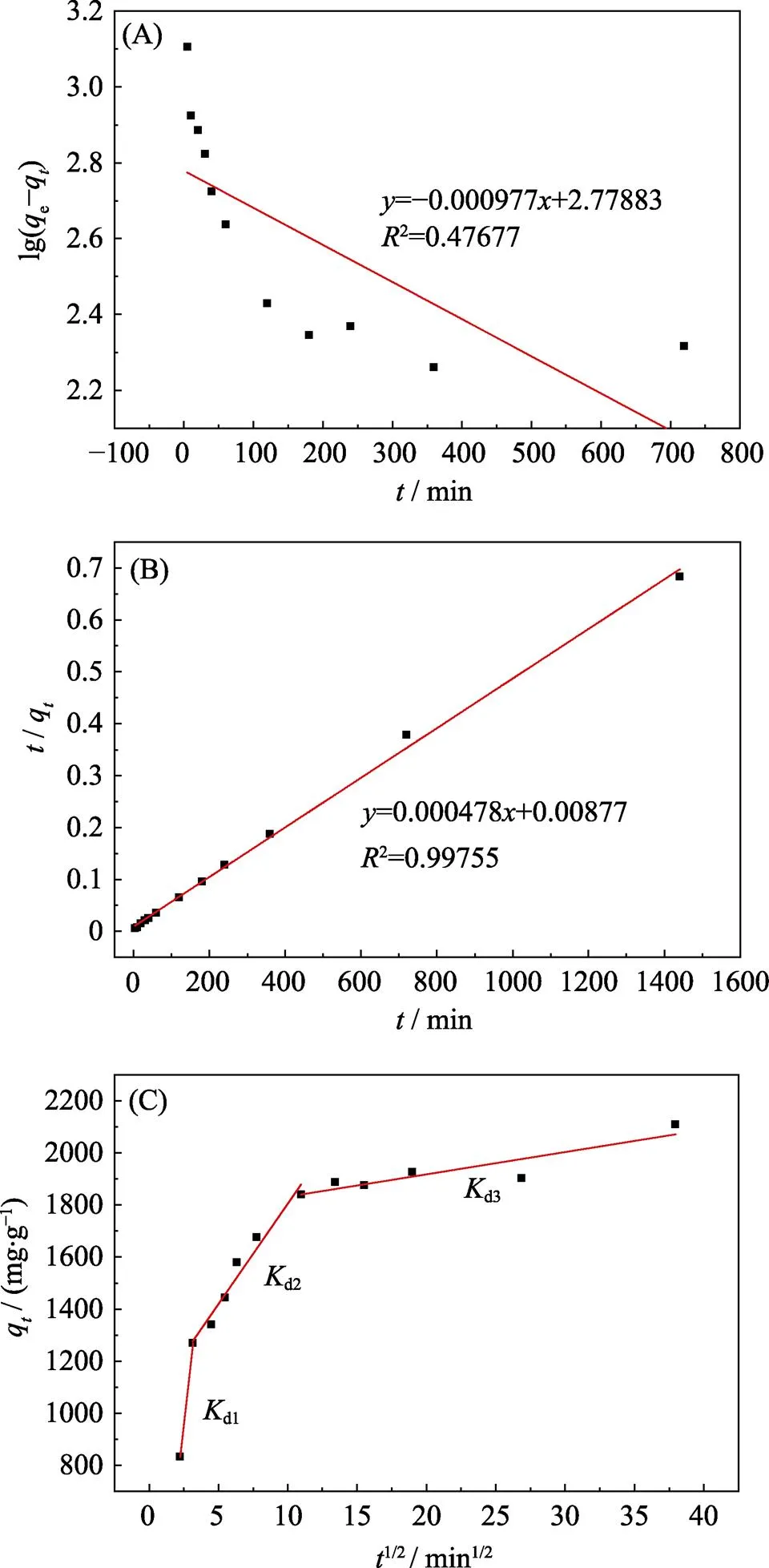
图3 Bio-CaCO3吸附Pb(II)的假一级(A)、假二级(B)和颗粒扩散模型(C)的动力学拟合曲线
=25 ℃, [Pb(II)]initial=753×10–6,sorbent/solvent=0.2 g/L, and [NaClO4]= 0.01 mol/L
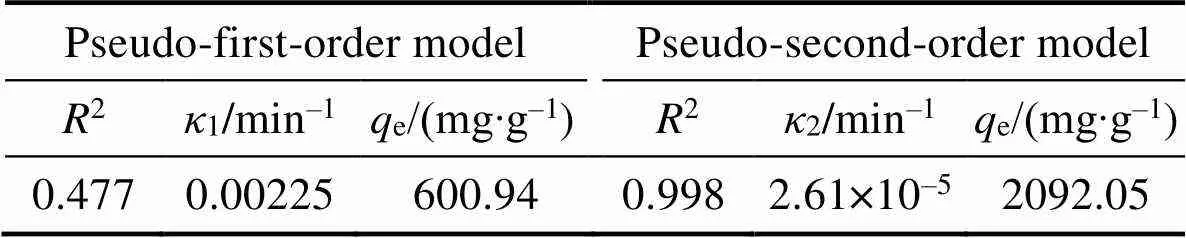
表3 Bio-CaCO3吸附Pb(II)的动力学参数
离子强度可以直接影响金属离子在溶液中的活度。本实验以不同浓度的NaClO3为离子强度调节剂, 研究离子强度对bio-CaCO3吸附Pb(II)的影响。由图4(B)可知, 当离子强度为0.001 mol/L时, Pb(II)去除率最大, 达到93%, 这主要是由于在低离子强度时, 低浓度的Na(I)与Pb(II)竞争吸附位点的作用较小导致的。当离子强度增大时, Pb(II)吸附率逐渐降低, 离子强度为0.3 mol/L时仍然达到90%的吸附率。离子强度对牡蛎壳吸附Pb(II)的作用较小, 尽管Pb(II)吸附随着离子强度的增大而降低。吸附过程以Pb(II)与CaCO3的反应为主, Na(I)竞争bio-CaCO3上的吸附位点作用较小。
2.5 吸附热力学
吸附等温线对于判定牡蛎壳对Pb(II)的吸附容量和吸附过程的本质非常重要。为了更深入地探讨牡蛎壳对Pb(II)的吸附机理, 采用分析吸附过程最常用的两种等温线模型: Langmuir[24](式(7))和Freundlich[7](式(8))模型, 对实验数据进行分析。这两种吸附等温模型的表达式为:
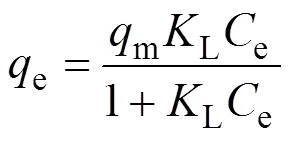
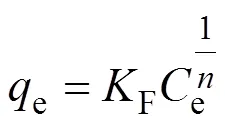
其中,e是平衡浓度(mg/L),e是平衡吸附量(mg/g),m是饱和吸附量(mg/g),L是Langmuir吸附常数(L/mg),F是Freundlich吸附常数(mg∙g–1)。
Langmuir吸附等温线对实验数据的拟合比Freundlich模型好(见图5和表5), 证明Langmuir吸附等温模型能够更好地解释本实验的吸附过程, 而且bio-CaCO3对Pb(II)的吸附机理更趋向于均相介质表面的单分子层吸附[25]。同时, 通过Langmuir模型计算吸附剂的最大吸附量, 不同温度下牡蛎对Pb(II)的饱和吸附量为1775.33 (25 ℃)>1415.94 (35 ℃)>1237.35 (50 ℃), mg/g。饱和吸附量随着温度的升高而降低, 证明此吸附过程为放热反应。

表4 Bio-CaCO3吸附Pb(II)的颗粒扩散模型参数
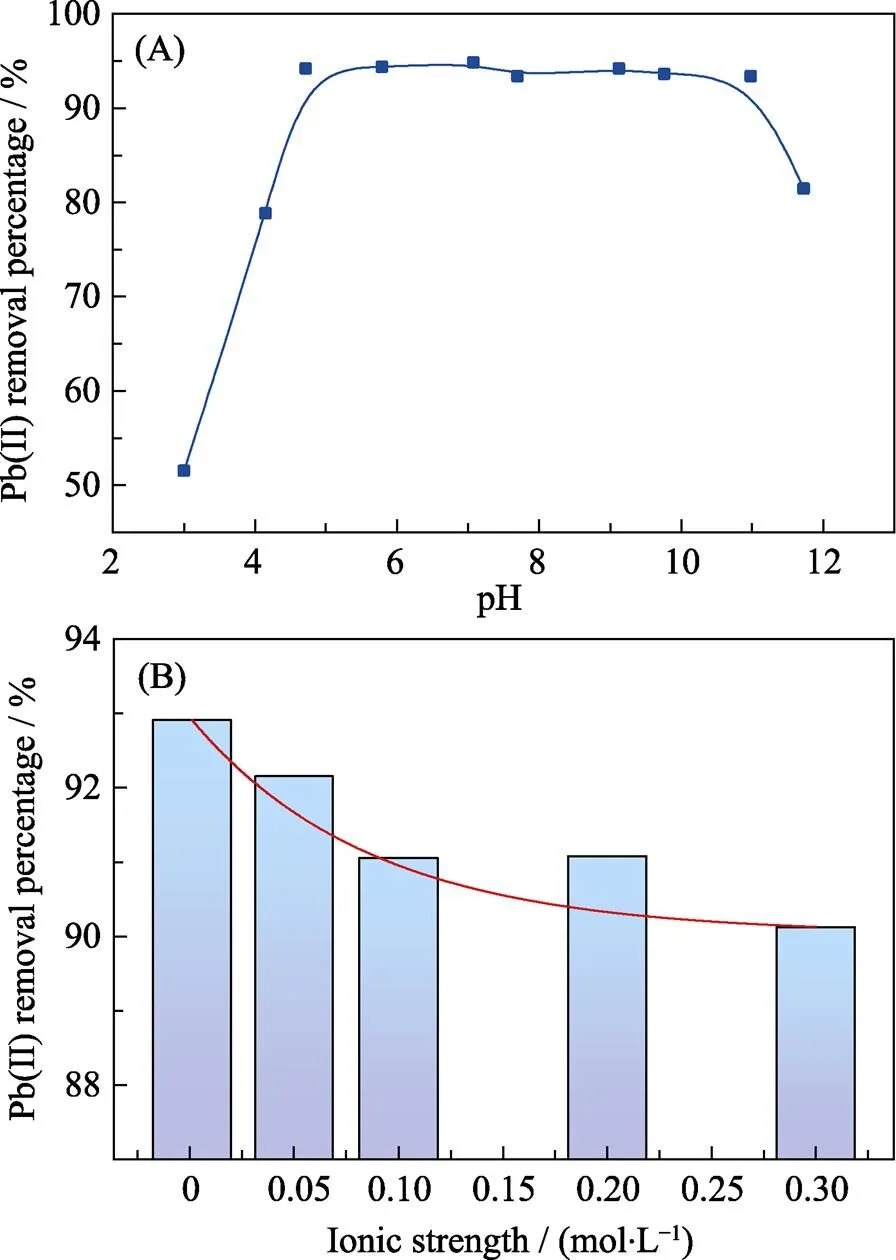
图4 pH (A)和离子强度(B)对bio-CaCO3吸附Pb(II)的影响
=25 ℃, [Pb(II)]initial=10×10–6, pH=5.0,/=0.2 g/L
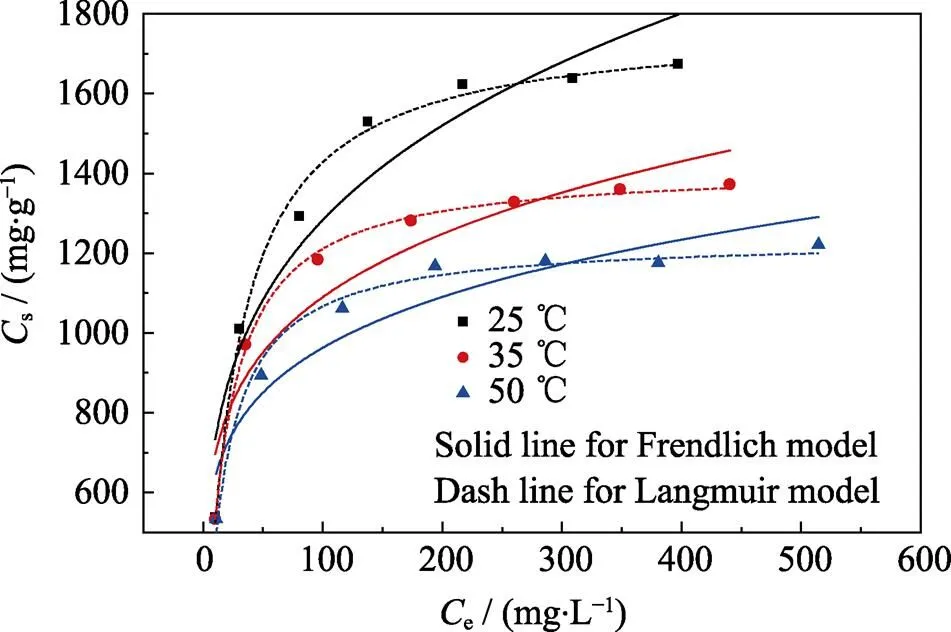
图5 Bio-CaCO3对Pb(II)的吸附等温线
pH=5.0,/= 0.2 g/L and [NaClO4] = 0.01 mol/L
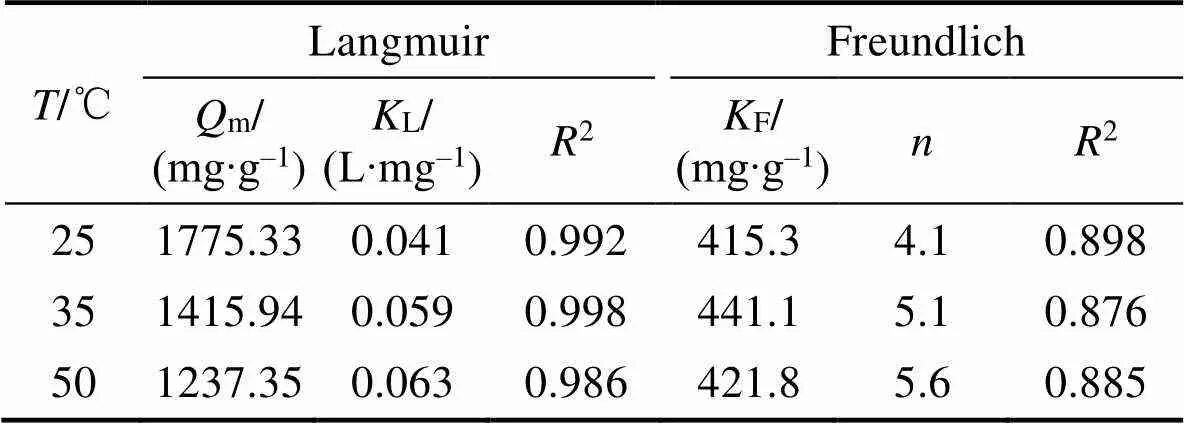
表5 Bio-CaCO3吸附Pb(II)的Langmuir和Freundlich模型参数
为进一步理解bio-CaCO3对Pb(II)吸附过程的热力学过程, 通过热力学方程(式(9)和式(10))[26], 计算bio-CaCO3吸附Pb(II)过程的热力学参数:
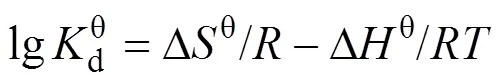
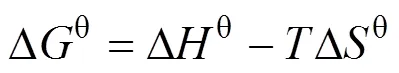
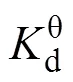
另外, 由表6可知, 此反应过程的Δθ= –17.92 J/(mol·K), 也为负值, 表明此吸附反应为混乱度减小的过程, 产物具有更有序的晶型结构。这一现象与Pb(II)在Fe2O3, Co-Fe2O3和Ni-Fe2O3材料上吸附过程正的Δθ有明显的区别[29], 这与bio-CaCO3吸附Pb(II)前后明显的形貌变化(图8)有关。吸附前bio-CaCO3呈现不规则的岩石块状结构, 大小形状不一, 且表面含有孔径为100~300 nm的孔道结构, 如图8(A)所示。这种孔道结构增大了材料的比表面积, 吸附Pb(II)后材料表面产生大量形貌更加规则的四棱柱结构。
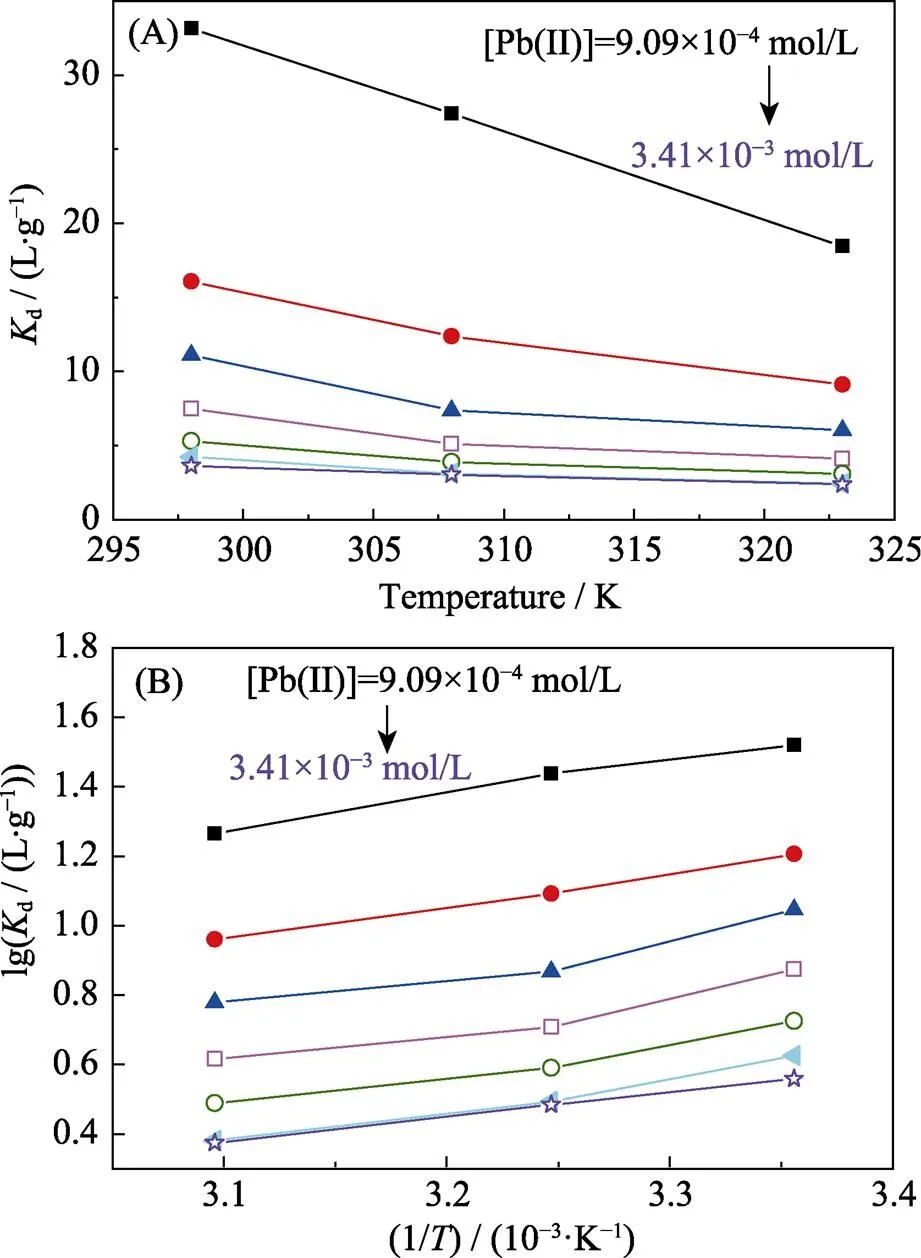
图6 Bio-CaCO3吸附不同浓度Pb(II)的分配系数与温度的变化曲线
pH=5.0,/= 0.2 g/L and [NaClO4]= 0.01 mol/L
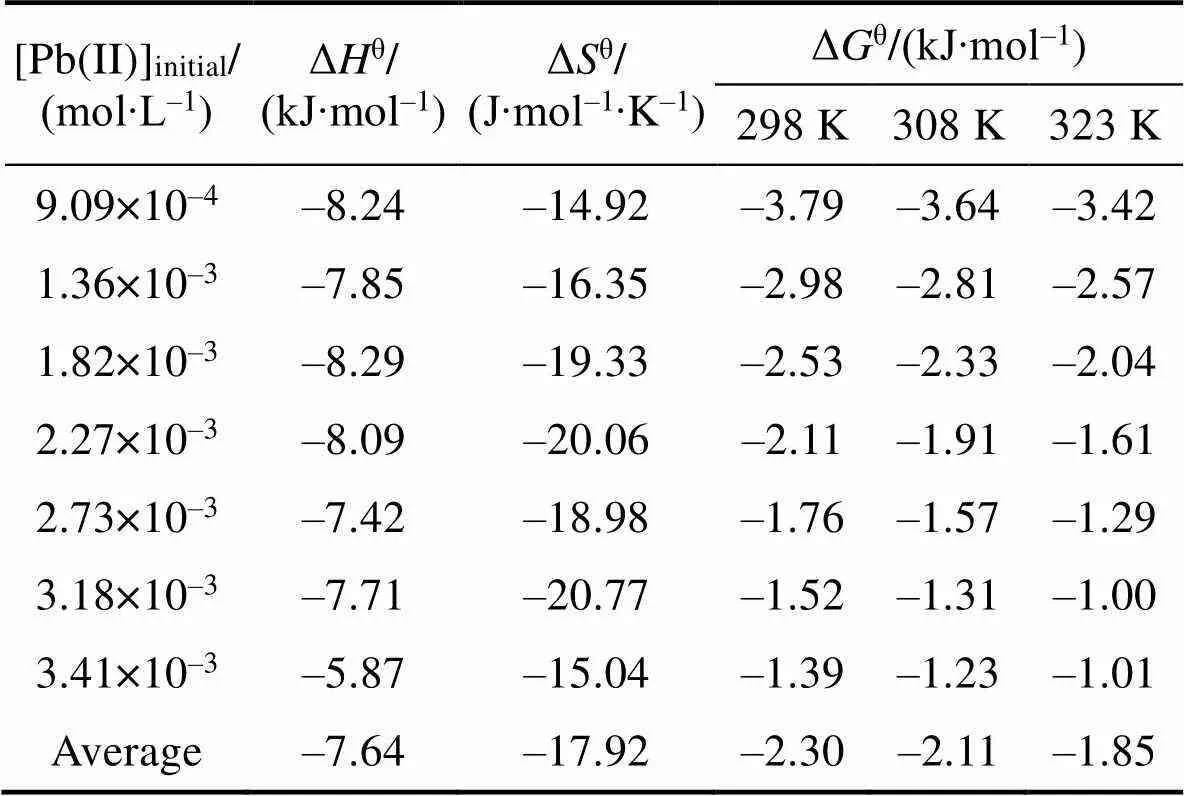
表6 Bio-CaCO3吸附Pb(II)的热力学参数
2.6 吸附性能对比
实验对比了bio-CaCO3与其它吸附材料对Pb(II)的吸附性能。298 K时, 此bio-CaCO3对Pb(II)的饱和吸附量高达1775 mg/g, 约为氧化石墨烯的1.9倍, 明显优于常用的活性炭、氧化石墨烯、皂土等吸附材料(表7)。而且基于乳山牡蛎制备的bio-CaCO3(4.93 m2/g)吸附材料也明显优于天津和广州(2.49 m2/g)的牡蛎壳, 这可能与其较大的比表面积和结构有关。
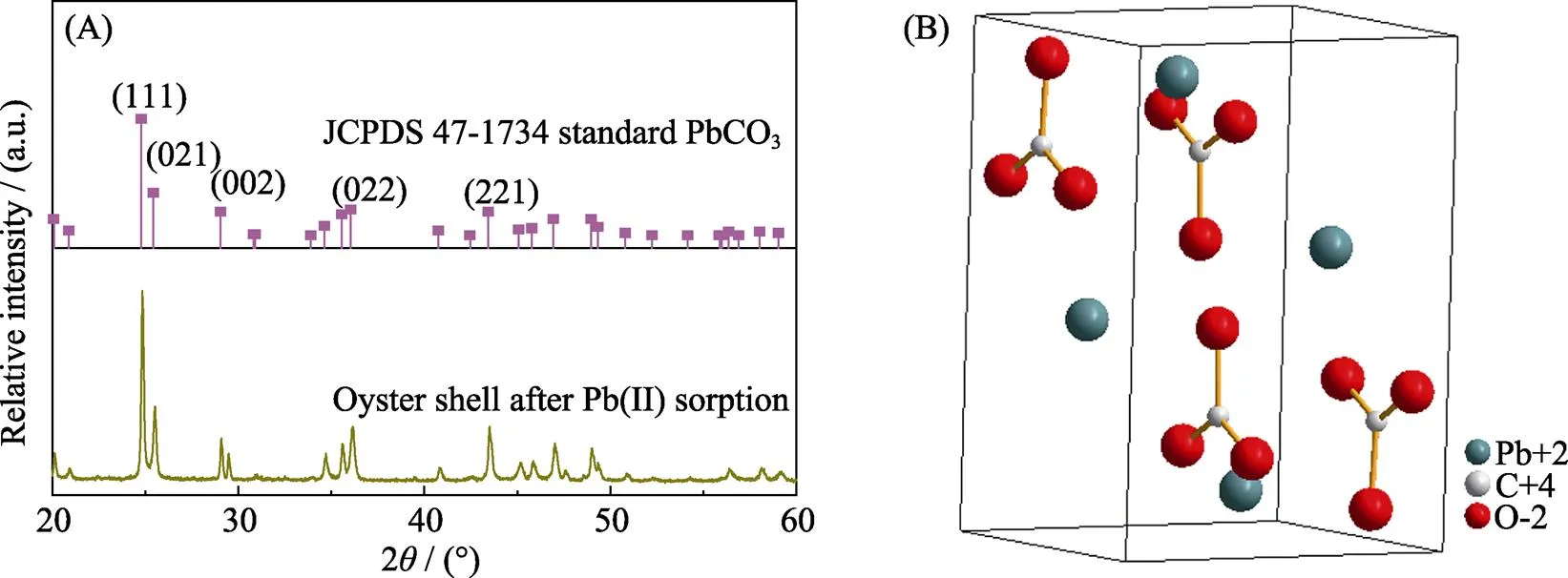
图7 Bio-CaCO3吸附Pb(II)后的XRD图谱(A)和白铅矿PbCO3结构图(B)

图8 Bio-CaCO3吸附Pb(II)前(A)和吸附后(B, C)的SEM照片
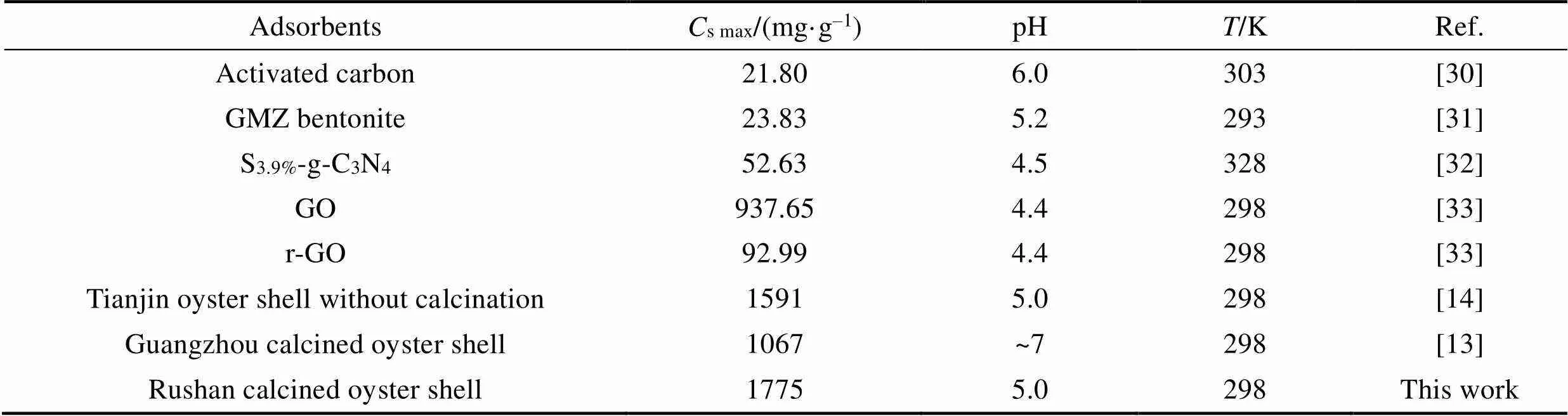
表7 Bio-CaCO3对Pb(II)吸附能力与其他吸附剂的比较

图9 Bio-CaCO3与活性炭对MO的去除效率

图10 Bio-CaCO3吸附MO前(A)和吸附后(B)的SEM照片
对于初始浓度为60 mg/L的MO, bio-CaCO3的去除效率约为45%, 活性炭的去除效率为48%(图9), 表明bio-CaCO3也具有一定的有机物吸附性能。通过SEM (图10)对比发现, bio-CaCO3吸附MO后, 材料表面产生了一些具有褶皱形貌的物质。以上结果表明该生物源碳酸钙对重金属Pb(II)和MO有机物均具有良好的吸附能力。
3 结论
本实验通过煅烧牡蛎壳制备生物源碳酸钙吸附材料, 用于去除污水中的重金属Pb(II)离子和有机物MO。通过宏观吸附和微观表征研究了bio-CaCO3对Pb(II)和MO的去除效果, 并考察了不同环境因素对bio-CaCO3吸附污染物的影响。研究发现, bio-CaCO3对Pb(II)和MO均具有良好的吸附性能, 298 K下, 对Pb(II)的饱和吸附量为1775 mg/g。结合热力学、动力学和SEM表征分析, bio-CaCO3吸附Pb(II)生成具有规则四棱柱结构的PbCO3, 且该吸附过程Δθ= –7.64 kJ/mol, Δθ= –17.92 J/(mol·K), Δθ= –2.30 kJ/mol (pH=5.0,=298 K)。通过对比常见的吸附材料, 所制备的bio-CaCO3吸附剂具有高效、廉价、环保等优点, 在水污染治理中具有潜在的应用前景。
[1] YANG S B, HU J, CHEN C L,Mutual effects of Pb(II), and humic acid adsorption on multiwalled carbon nanotubes/polyacrylamide composites from aqueous solutions.,2011, 45(8): 3621–3627.
[2] LIU X L, MA R, WANG X X,Graphene oxide-based materials for efficient removal of heavy metal ions from aqueous solution: a review.,2019, 252: 62–73.
[3] REDDY K R, HASSAN M, GOMES V G. Hybrid nanostructures based on titanium dioxide for enhanced photocatalysis.,2015, 489: 1–16.
[4] ZHU Y, MURALI S, CAI W,Graphene and graphene oxide: synthesis, properties, and applications.,2010, 22(35): 3906–3924.
[5] DENG Q, LU L X, ZHANG R R. Adsorption property of oyster shell powder to Cu2+.,2016, 44(23): 63–65.
[6] XU CONG-BIN, YANG WEN-JIE, SUN HONG-LIANG,Performance and mechanism of Pb(II) removal by expanded graphite loaded with Zero-valent iron.,2018, 33(01): 41–47.
[7] SUN Q, QI Q, ZHANG J,Structure and adsorption property of magnetic ZnFe2O4-halloysite composite material.,2018, 33(4): 390–396.
[8] WANG N, PANG H W, YU S J,Investigation of adsorption mechanism of layered double hydroxides and their composites on radioactive uranium: a review.,2019, 77(2): 143–152.
[9] YANG S, HAN C, WANG X,Characteristics of cesium ion sorption from aqueous solution on bentonite- and carbon nanotube- based composites.,2014, 274: 46–52.
[10] AHMAD M, RAJAPAKSHA A U, LIM J E,Biochar as a sorbent for contaminant management in soil and water: a review.,2014, 99: 19–33.
[11] WANG X X, CHEN L, WANG L,Synthesis of novel nanomaterials and their application in efficient removal of radionuclides.,2019, 62(8): 933–967.
[12] YANG S, OKADA N, NAGATSU M. The highly effective removal of Cs(+) by low turbidity chitosan-grafted magnetic bentonite.,2016, 301: 8–16.
[13] ZHOU X L, LIU W Z, ZHANG J,Biogenic calcium carbonate with hierarchical organic inorganic composite structure enhancing the removal of Pb(II) from wastewater.,2017, 9(41): 35785–35793.
[14] DU Y, LIAN F, ZHU L. Biosorption of divalent Pb, Cd and Zn on aragonite and calcite mollusk shells.,2011, 159(7): 1763–1768.
[15] CHANDRASIRI C, YEHDEGO T, PEETHAMPARAN S. Synthesis and characterization of bio-cement from conch shell waste.,2019, 212: 775–786.
[16] CHEN X L, ZHANG X Y, WANG Y,Synergistic fire safety improvement between oyster shell powder and ammonium polyphosphate in TPU composites.,2019, 30(7): 1564–1575.
[17] CHEN X L, ZHANG X Y, WANG W D,Fire-safe agent integrated with oyster shell and melamine polyphosphate for thermoplastic polyurethane.,2019, 30(7): 1576–1588.
[18] DICKINSON G H, IVANINA A V, MATOO O B,Interactive effects of salinity and elevated CO2levels on juvenile eastern oysters, Crassostrea virginica.,2012, 215(1): 29–43.
[19] WU Q, CHEN J, CLARK M,Adsorption of copper to different biogenic oyster shell structures.,2014, 311: 264–272.
[20] YEN H Y, LI J Y. Process optimization for Ni(II) removal from wastewater by calcined oyster shell powders using Taguchi method.,2015, 161: 344–349.
[21] YANG S B, DU X D. Enhanced dispersion of carbon nanotubes in water by plasma induced graft poly(,-dimethylacrylamide) and its application in humic acid capture.,2019, 277: 380–387.
[22] NIU Z W, WEI X Y, QIANG S R,Spectroscopic studies on U(VI) incorporation into CaCO3: effects of aging time and U(VI) concentration.,2019, 220: 1100–1107.
[23] YANG S, ZHAO D, ZHANG H,Impact of environmental conditions on the sorption behavior of Pb(II) in Na-bentonite suspensions.,2010, 183(1/2/3): 632–640.
[24] WANG XIANG-XUE, YU SHU-JUN, XIANG-KE W. Removal of radionuclides by metal-organic framework-based materials.,2019, 34(1): 17–26.
[25] TRAVLOU N A, KYZAS G Z, LAZARIDIS N K,Functionalization of graphite oxide with magnetic chitosan for the preparation of a nanocomposite dye adsorbent.,2013, 29(5): 1657–1668.
[26] TAHIR S S, RAUF N. Thermodynamic studies of Ni(II) adsorption onto bentonite from aqueous solution.,2003, 35(12): 2003–2009.
[27] SHEN J, SCHAFER A. Removal of fluoride and uranium by nanofiltration and reverse osmosis: a review.,2014, 117: 679–691.
[28] LIU Z, SHEN Q, ZHANG Q,The removal of lead ions of the aqueous solution by calcite with cotton morphology.,2014, 49(15): 5334–5344.
[29] CHEN W, LU Z, XIAO B,Enhanced removal of lead ions from aqueous solution by iron oxide nanomaterials with cobalt and nickel doping.,2019, 211: 1250–1258.
[30] RAO M M, RAMANA D K, SESHAIAH K,Removal of some metal ions by activated carbon prepared from Phaseolus aureus hulls.,2009, 166(2): 1006–1013.
[31] XU D, TAN X L, CHEN C L,Adsorption of Pb(II) from aqueous solution to MX-80 bentonite: effect of pH, ionic strength, foreign ions and temperature.,2008, 41(1): 37–46.
[32] LI X, XING J L, ZHANG C L,Adsorption of lead on sulfur- doped graphitic carbon nitride nanosheets: experimental and theoretical calculation study.,2018, 6(8): 10606–10615.
[33] ZHANG J, XIE X, LIANG C,Characteristics and mechanism of Pb(II) adsorption/desorption on GO/r-GO under sulfide-reducing conditions.,2019, 73: 233–240.
High-efficiency Biogenic Calcium Carbonate for Adsorption of Pb(II) and Methyl Orange from Wastewater
DU Xudong1, TANG Chengyuan1, YANG Xiaoli2, CHENG Jianbo1, JIA Yuke1, YANG Shubin1
(1. School of Chemistry and Chemical Engineering, Yantai University, Yantai 264005, China; 2. School of Environmental and Municipal Engineering, North China University of Water Resources and Electric Power, Zhengzhou 450045, China)
A low-cost oyster shell was carried to prepare biogenic calcium carbonate (bio-CaCO3) to remediate Pb(II) and methyl orange (MO) from contaminated water. The morphology, composition and structure of the material were analyzed mainly by scanning electron microscope (SEM), thermogravimetric analysis (TGA), X-ray fluorescence (XRF). The adsorption of Pb(II) and MO by bio-CaCO3was studied by combining batch experiments and microstructure characterization. Batch sorption experiments showed that 45% MO was removed by bio-CaCO3(sorbent/solvent=0.2 g/L, [MO]initial=60 mg/L). An obviously morphology change took place after MO adsorbed onto bio-CaCO3. The maximum sorption capacity of bio-CaCO3for Pb(II) is 1775 mg/g (pH=5.0,=298 K), which is higher than that of the traditional nanomaterials such as bentonite and activated carbon. The Pb(II) removal mechanism is expected to be CaCO3+ Pb(II)→PbCO3, where the Δθ, Δθand Δθof Pb(II) sorption by bio-CaCO3(pH=5.0,=298K) are –7.64 kJ/mol, –17.92 J/(mol·K) and –2.30 kJ/mol, respectively. More regular products with quadrangular structure are formed after Pb(II) adsorption. The results highlight that the bio-CaCO3has a high Pb(II) and MO sorption efficiency, demonstrating that it is a promising adsorbent material in environmental pollution management.
biogenic calcium carbonate; Pb(II); methyl orange; sorption
TQ174
A
1000-324X(2020)03-0315-09
10.15541/jim20190349
2019-07-15;
2019-09-12
国家自然科学基金(51708215); 山东省自然科学基金–青年基金(ZR201807060384); 烟台大学博士启动基金(HY18B04)
National Natural Science Foundation of China (51708215); Shandong Provincial Natural Science Foundation (ZR201807060384); PhD Research Startup Foundation of Yantai University (HY18B04)
杜旭东(1995–), 男, 硕士研究生. E-mail: 2062296740@qq.com
DU Xudong (1995–), male, Master candidate. E-mail: 2062296740@qq.com
杨树斌(1987–), 副教授. E-mail: shubinyang@ytu.edu.cn
YANG Shubin, associate professor. E-mail: shubinyang@ytu.edu.cn

