大豆GmWRKY86基因的克隆及表达
王 静 付 晶 李晓伟
(1. 沧州职业技术学院,河北 沧州 061001;2. 河北大学,河北 保定 071002)
WRKY基因家族是高等植物最大的转录因子家族之一。1994年Ishiguro等[1]从甘薯中克隆了第一个WRKY蛋白,近年来随着越来越多植物基因组的公布,不同物种间大量的WRKY成员在相继得到克隆和鉴定[2]。WRKY基因编码的蛋白除了WRKYGQK核心序列外,还存在保守的锌指结构[2]。依据WRKY蛋白结构域及锌指基序数量和模式的不同,WRKY蛋白分为3个亚类,其中第Ⅰ类含有两个WRKY结构域,第Ⅱ类和第Ⅲ类虽只含有一个WRKY结构域,但第Ⅱ类的锌指结构模式为C2H2,而第Ⅱ类的锌指结构模式为C2HC[3]。
作为重要的转录因子成员,植物WRKY蛋白已被证明参与对生物和非生物胁迫的响应以及发育过程[3]。有研究表明,WRKY蛋白不仅在抵抗细菌、真菌和病毒病原体等生物胁迫过程中发挥重要作用[4-5],还广泛参与了胚发生[6]、衰老[7]、休眠[8]、毛状体发育[9]、种子发育[10]等过程,以及由植物激素如赤霉酸[11]、脱落酸(ABA)[12]或水杨酸[13]介导的一些信号转导过程。同时,有证据[14]表明WRKY蛋白参与了对各种非生物胁迫的响应。在拟南芥中过表达AtWRKY28蛋白可提高植物对多种非生物胁迫的抵抗力[15];在水稻中过表达来自玉米的ZmWRKY114蛋白可提高阳性植株对盐胁迫的耐受性;在水稻中过表达OsWRKY42蛋白虽然对生物胁迫无效果,但显著延缓胼胝质降解并增强对盐胁迫的耐受性[16-17]。
虽然植物WRKY蛋白的研究已取得了很大的进展,但对这个重要的转录调节家族的了解仍然有限。大豆是重要的农作物,是人类植物蛋白质、食用油和其他有益于健康的营养物质的主要来源[18]。目前有多个团队[19-20]鉴定了大豆的WRKY蛋白家族,但主要是根据保守结构域的电子鉴定。试验拟利用PCR技术克隆GmWRKY86,并利用qRT-PCR技术分析其在不同组织及非生物胁迫下的表达模式,为进一步分析该基因的生物学功能提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
乙醇:分析纯,国药集团化学试剂有限公司;
大豆(Glycinemax):富豆7号,黑龙江天昊种业有限公司;
总RNA快速提取试剂盒、cDNA第一链合成试剂盒:北京百泰克生物科技有限公司;
ZT4-Blunt快速克隆试剂盒、qRT-PCR Mix试剂盒:北京庄盟生物科技有限公司。
1.1.2 主要仪器
紫外分光光度计:UV-360型,北京金石生物技术有限公司;
梯度PCR仪:MP60201型,珠海莫纳生物科技有限公司;
荧光定量PCR仪:Lightlyder 2.0(RoChe)型,罗氏诊断产品(上海)有限公司;
微孔板离心机:GC60101型,普洛麦格(北京)生物技术有限公司。
1.2 样品采集
正常田间管理,植株生长30 d后,收集根、茎和叶组织,待植株开花后,收集花器官,用于RNA提取。幼苗生长30 d后,用50% PEG6000和200 mmol/L NaCl溶液进行干旱和盐胁迫处理,处理1,3,5,7 d后取上部叶片进行基因表达分析。每个样品取3个生物学重复。
1.3 大豆总RNA提取及cDNA第一链合成
1.3.1 大豆总RNA提取 采用总RNA快速提取试剂盒Ultrapure RNA提取。使用UV-360紫外分光光度计测定RNA浓度和纯度。
1.3.2 cDNA第一链合成 采用含DNase的Fast Super RT Kit cDNA第一链合成试剂盒对总RNA进行去除基因组DNA,再通过反转录合成cDNA第一链。
1.4 GmWRKY86基因的克隆
设计引物GmWRKY86-F:5′-ATGTCCACTCCCAACACCGATTC-3′和GmWRKY86-R:5′-TTATACTATG ATTTGCTCTT CTTTCA-3′扩增GmWRKY86的ORF序列,以大豆叶片的cDNA作为第一链为模板,进行PCR链式聚合反应,再使用零背景ZT4-Blunt快速克隆试剂盒对PCR产物进行连接,将获得的阳性克隆送往上海美吉生物技术有限公司进行测序。
1.5 生物信息学分析
利用DNAMAN7预测GmWRKY86蛋白的等电点和分子质量;使用SMART在线预测分析保守区,利用NCBI中的BlastP程序进行氨基酸一致性分析。进化树的构建采用iTOL在线软件操作。
1.6 荧光定量PCR分析
设计GmWRKY86基因荧光定量引物,GmWRKY86-qF:5′-TGGAAATGTAACTGTTCAGCC-3′和GmWRKY86-qR:5′-TCACTTGACCCAGGTAGTAGTTG-3′。大豆肌动蛋白基因作为内参基因,引物序列为5′-CTTCCCTCAGCACCTTCCAA-3′和5′-GGTCCAGCTTTCACACTCCAT-3′,荧光定量反应体系根据2×SYBR qPCR Mix说明书进行操作。试验过程中选用LightCycler 2.0 (RoChe)型PCR进行分析,需要重复3次试验操作。目的基因的mRNA水平采用2-ΔΔCT方法给予分析。
2 结果与分析
2.1 GmWRKY86克隆及分析
课题组前期从盐胁迫转录组数据中鉴定到多个差异表达的GmWRKY成员,其中GmWRKY86变化模式最为显著。利用大豆叶片的cDNA对GmWRKY86基因进行克隆。经测序分析发现GmWRKY86基因包含3个内含子和4个外显子,其开放阅读框长度为1 572 bp,编码523个氨基酸,所编码蛋白质的等电点为8.15,预测分子量为56.82 kDa。在Smart平台对其氨基酸序列分析,结果表明GmWRKY86蛋白含有2个典型的WRKY结构域,分别位于第228~286个氨基酸和第409~468个氨基酸(图1)。基因组定位分析表明GmWRKY86定位于大豆基因组Chr08:20546448~20551296 reverse位置,含有3个内含子组成和4个外显子(图2)。
为了进一步分析该基因功能,从NCBI获取陆地棉(Gossypiumhirsutum,AIE43850)、麻枫树(Jatrophacurcas,KT935498)、苦荞(Tartarybuckwheat,MK910374)、玉米(Zeamay,AIB05859)、野生棉(Gossypiumaridum,AIY62459)、水稻(OryzaSativa,AAT84154)、橡胶树(Heveabrasiliensis,AEE81757)、草莓(Fragariavesca,APP13924)、葡萄(Vitisvinifera,AY596466)、高粱(Solanumlycopersicum,ADZ15316.1)、拟南芥(Arabidopsisthaliana,NP_193551.1) 11个物种的经功能鉴定的WRKY成员,与大豆的GmWRKY86蛋白构建进化树。结果显示这些成员可分为3个亚类,GmWRKY86蛋白与来自草莓的FvWRKY42蛋白和葡萄的VvWRKY2蛋白聚为一支(图3)。

图1 GmWRKY蛋白在大豆中的WRKY保守结构域分析

图2 大豆GmWRKY86蛋白结构

图3 GmWRKY86蛋白进化树分析
2.2 GmWRKY86的组织特异性分析
为了进一步分析该基因功能,用荧光定量PCR方法分析了该基因的表达模式。结果显示:在所有检测的大豆组织中都存在GmWRKY86基因表达,其中在花中的表达量最高,种子中的表达量最低,其他组织中的表达量依次为叶>根>茎,提示GmWRKY86基因可能在大豆根茎叶感知逆境信号和激素信号中发挥重要作用,也说明GmWRKY86基因在大豆中广泛发挥功能(图4)。

图4 GmWRKY86基因在大豆不同器官中的表达
2.3 非生物胁迫对GmWRKY86表达的影响
为了进一步分析该基因的功能,利用荧光定量PCR技术分析了干旱和盐胁迫前后该基因的相对表达量。结果显示,GmWRKY86均能被干旱和盐胁迫诱导表达,其中在第7天时盐胁迫下的表达量为第0天的4倍左右,而同时期干旱胁迫下的表达量不到第0天的2倍(图5),表明该基因对盐胁迫更为敏感。Wei等[21]在拟南芥中过表达草莓的FvWRKY42基因,发现转基因植株中的SOD和CAT酶活显著上升,并提高了对盐胁迫和干旱胁迫的耐受力。Mzid等[22]发现在烟草中过表达草莓的VvWRKY2蛋白也可以提高转基因植株对盐胁迫和干旱胁迫的耐受力。试验结果表明GmWRKY86蛋白在抵抗盐胁迫和干旱胁迫方面可能具有类似的功能。
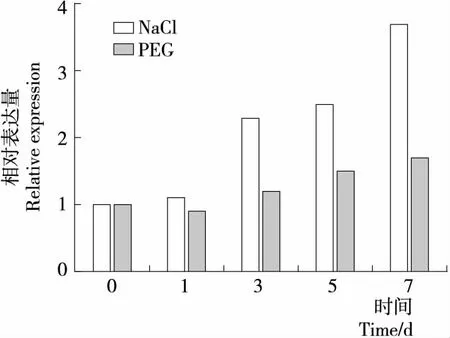
图5 干旱和盐胁迫下GmWRKY86基因的表达
3 结论
试验采用PCR和荧光定量方法,对大豆GmWRKY86基因进行了克隆和表达分析,发现GmWRKY86基因含有两个典型的WRKY保守结构域。结构保守性决定了功能的特异性,在GmWRKY蛋白进化树分析基础上,研究显示大豆GmWRKY86蛋白与来自草莓的FvWRKY42和葡萄的VvWRKY2聚为一支,进一步的组织特异性分析及干旱和盐胁迫前后该基因的相对表达量分析,明确了大豆GmWRKY86蛋白在抵抗盐胁迫和干旱胁迫方面发挥了重要作用。盐胁迫和干旱会严重影响作物生长、渗透调节和光合作用,降低作物产量。因此,了解干旱和盐胁迫的分子机制是生产此类作物的先决条件。但深刻阐述大豆GmWRKY86基因功能和分子机制,还需使用多种试验方法,包括转基因大豆过表达或CRISPR-Cas9缺失表达,以进一步揭示大豆WRKY基因家族和GmWRKY86生物学功能、分子机制和调控通路。

