植物诱导型启动子Prd29A的顺式元件分析及应用研究进展
田港 韦丁一 许本波
摘 要:植物在生长发育过程中会遭受各种生物和非生物胁迫,对植物生长发育造成巨大的影响。植物基因工程中组成型启动子应用存在种种弊端,因此对植物新型诱导型启动子的开发应用成为了植物基因工程的研究热点。该文从拟南芥中PAtrd29A启动子序列结构以及应用出发,概述了该启动子的胁迫诱导激活功能以及其给植物育种带来的影响,开发应用这类新型诱导型启动子是植物抵抗生长过程中非生物胁迫的有效措施。
关键词:诱导型启动子;顺式元件;非生物胁迫
中图分类号 Q943.2 文献标识码 A 文章编号 1007-7731(2020)24-0032-05
Advances in Cis-element Analysis and Application of Plant Inducible Promoter Prd29A
TIAN Gang et al.
(College of Life Science,Yangtze University, Jingzhou 434025, China)
Abstract:Plants suffer a variety of abiotic and biotic stresses in the process of growth and development,which causes great loss to plant growth. There are many disadvantages in the application of constitutive promoters in plant genetic engineering,so it is necessary to develop and apply new inducible promoters in plant genetic engineering. Based on the structure and application of the sequence of promoters PAtrd29A in Arabidopsis thaliana,the stress-induced and activated functions of the promoters and the significant impact of the promoters on plant breeding were reviewed in this paper. The development and application of the new type of promoters is an effective measure for plants to resist non-biological stress during growth.
Key word:Inducible promoter;Cis-elements;Abiotic stress
在植物生長过程中,非生物胁迫主要包括干旱、极端温度、重金属毒害、盐碱以及涝渍等,严重影响植物的生长发育,由环境胁迫引起的农业破坏已成为世界范围的问题[1,2]。在胁迫条件下,植物的形态、生理、生化及分子均会产生变化,植物细胞衰老死亡速度加快,为植物的生长和生产力带来了不利影响,对农业发展以及自然环境构成了严重威胁。
植物在受到外界环境胁迫的刺激时会做出一系列的胁迫应答反应,其中,由局部胁迫引起的系统响应广泛存在[3],植物通过对自身激素水平的调节来适应极端环境的过程被称为植物胁迫应答,而植物的激素水平通过其体内庞大的基因关系网络调控。一些与胁迫响应相关的表达基因以及转录因子在不同环境条件下表现出差异的转录水平,这个过程可分为信号感知、信号转导、基因激活及生化改变[4]。植物首先通过受体在细胞膜上感知到压力,然后产生次级信使,如钙和磷酸肌醇[5]。次级信使调节细胞内钙水平,这种钙水平变化由钙结合蛋白(Ca2+传感器)感测得到,随后该蛋白启动了磷酸化级联反应,最终导致基因表达改变[6,7],从而造成了激素以及一些蛋白激酶水平的差异。位于基因上游5′的启动子是这些基因转录激活的开关,启动子上面包含多种重要的顺势作用元件,它们能够通过活化RNA聚合酶,使之与模板DNA准确的结合从而激发或抑制基因的转录[8]。启动子有多种分类,其中诱导型启动子能够在特定的环境条件诱导下激活下游基因的转录,从而影响植株的一些生理功能,以应对恶劣环境带来的伤害。
1 诱导启动子Prd29A及调控基因进化分析
YAMAGUCHI- SHINOZAK[9]等首次从拟南芥中分离并且克隆出了胁迫诱导相关基因rd29A(也称为LTI78和COR78),它位于拟南芥5号染色体上,含711个氨基酸,预测分子量为7.8kd,由2个串联重复序列组成的112个氨基酸的多肽存在于rd29A的中间;在rd29A的C端区域中存在21个氨基酸的第2个串联重复序列,N端区域发现2个酸性区域和碱性区域[10]。经实验证明,在多种胁迫处理下,rd29A启动子均表现出强烈的诱导活性[11]。
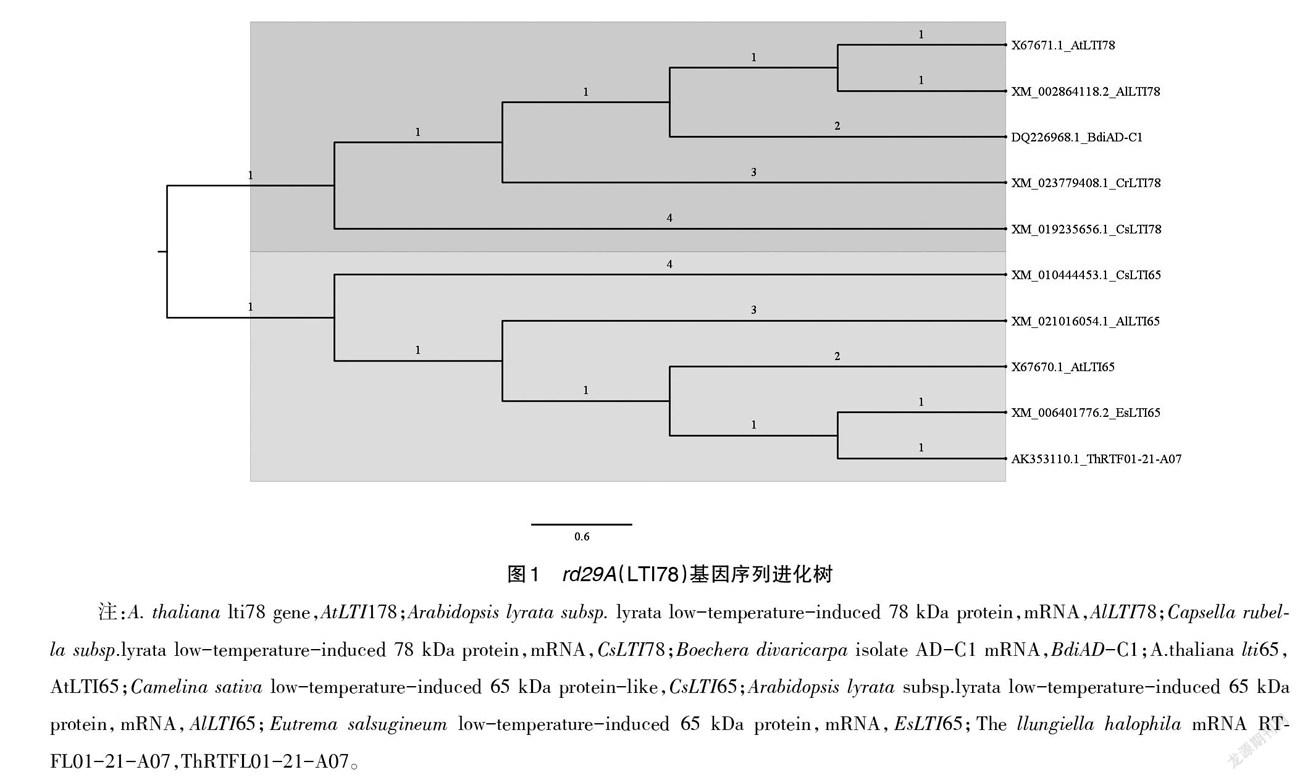
目前,仅从拟南芥(Arabidopsis thaliana)和结缕草粳稻(Zoysia japonica)中克隆得到rd29A启动子序列[12]。对rd29A基因序列进行进化分析(图1)发现,拟南芥(Arabidopsis thaliana)基因序列Atrd29A和琴叶鼠耳芥基因(Arabidopsis lyrata subsp.lyrata)AlLTI78亲缘关系最近,为91.68%,AlLTI78为低温诱导胁迫响应因子;与荠菜基因(Capsella rubella)CrLTI78同源性为83.45%;与亚麻荠基因(Camelina sativa)CsLTI78同源性为82.71%;与桦木基因(Boechera divaricarpa isolate)BdiAD-C1同源性为82.53%;拟南芥同家族基因Atrd29B也是一个RD29胁迫相关基因,它与Atrd29A串联在同一条有义链上,这2个基因在相同位置含有3个内含子[13],Atrd29A基因与Atrd29B同源性为82.66%,据报道,这些同源基因都是与各种胁迫调控相关的转录因子[12,14]。YAMAGUCHI-SHINOZAKI[13]等研究发现,拟南芥中的Atrd29A基因与多种胁迫应激相关,Atrd29A启动子对下游报告基因GUS表达活性的组织化学分析表明,rd29A启动子在缺水期间几乎在营养植物的所有器官和组织中起作用,其诱导活性甚至强于组成型启动子Camv35S。因此,对基因rd29A启动子的开发应用对培育抗逆植物新品种具有非常重要的生物学意义。
2 Prd29A启动子的顺式元件分析
順式作用元件是启动子序列上一段含有5~20个碱基对的短序列,是非常重要的分子开关,决定了启动子特异的转录激活功能的核心区域[15]。不同的顺式元件有着不同的激活功能,参与应激反应的顺式作用元件分别参与不同的胁迫相关基因调控通路,它们能与特定的转录信号因子结合,从而对下游基因在时间和空间上进行精细水平的调控,促进或抑制下游基因的转录。许多基因是由各种各样的胁迫环境诱导表达的,这表明在这些应激信号通路之间存在串联关系,诱导型启动子通过自身的顺式作用元件与其他的反式转录因子相互作用,并且在转录起始位点的上游的TATA盒(核心启动子)形成转录起始复合体,然后转录起始复合物激活RNA聚合酶对应激因子起始转录,从而驱动了外源基因在胁迫环境下的高水平表达[16]。
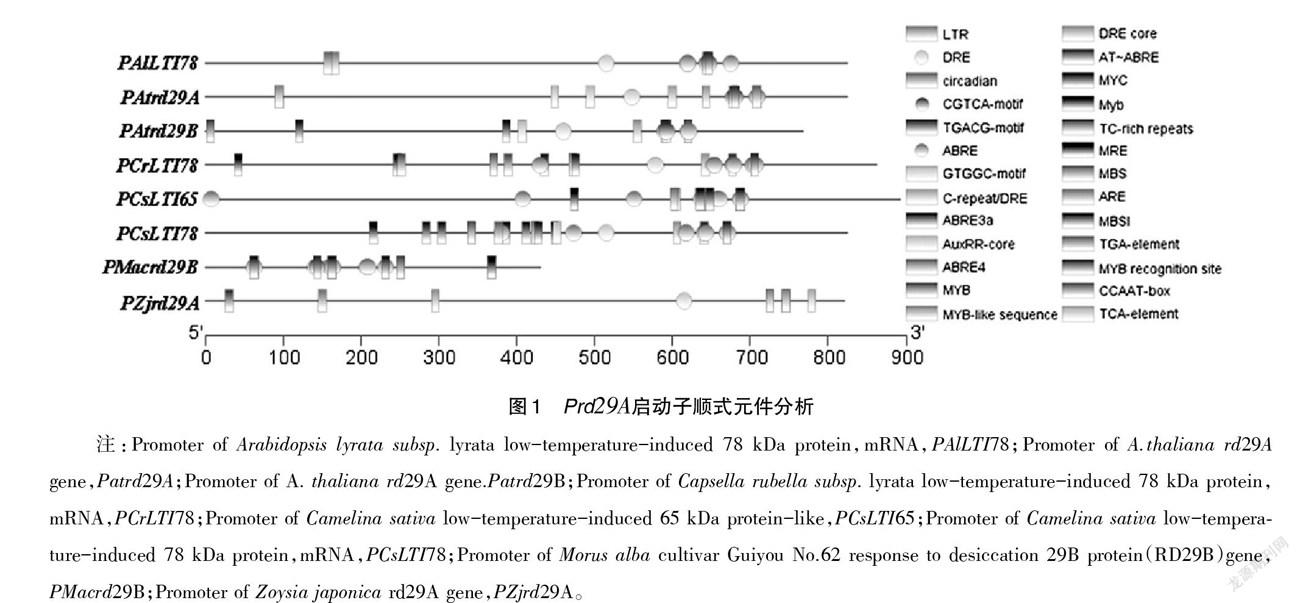
从NCBI上找到Atrd29A启动子序列以及其他各同源序列上游800bp左右启动子序列,利用PLANTCARE分析顺式元件,TBtools做可视化分析(图2),保守基序在图2中用圆圈标出。比较分析发现,在rd29A基因启动子的顺式元件中都存在保守的ABRE和ARE等脱落酸(ABA)响应元件。Marcotte[17]等利用缺失分析研究小麦Em基因启动子,鉴定得到ABRE,研究发现,保守序列ABREs(PyACGTGGC)在许多ABA响应基因表达中是主要的作用元件[18,19],许多干旱和寒冷诱导基因的启动子中都包含ABREs基序,ABRE序列经常和其他元件协同作用参与ABA响应基因的转录。ABA作为一种在植物组织适应干旱和高盐度等非生物胁迫以及种子的成熟和休眠都起着重要作用的植物激素,在ABA激素调控下,植株根系伸长、气孔关闭,缓解了因高盐分、干旱造成的脱水死亡,ABA还能诱导一些寒冷相关基因的表达,各种产物蛋白酶和激素水平的变化共同构成了植物的冷驯化过程[20]。除此之外,rd29A基因启动子上还存在保守的DRE(TACCGACAT)响应元件,这是一类与多种胁迫相关的启动子基序,参与干旱、低温或高盐胁迫诱导RD29A[21]。将整个DRE及其核心序列与不同植物中的其他胁迫诱导基因进行了比较,发现DRE顺式元件(或其核心序列)非常保守,并且在干旱响应的植物基因中广泛发现同时参与了盐和冷害胁迫[22,23]。
YAMAGUCHI-SHINOZAK[13]等分别对拟南芥植物进行干旱和外源ABA处理,发现Atrd29A基因分别存在一条ABA响应的胁迫应答途径和独立于ABA的应答响应途径,这与这2种顺式元件的调控有关,并且2种途径互相串扰,共同形成了启动子的诱导激活活性。在PAtrd29A启动子上存在2个DRE顺式元件,这可能是造成其转录激活活性强于其他转录激活启动子的原因。同时,CGTCA-motif也是Prd29A一个较为保守的顺式作用元件,参与茉莉酸调控途径;Patrd29A上还存在较为保守的AuxRR-motif,参与长素响应调控途径。Prd29A还含有一些MYB响应元件以及多个启动子核心元件TATA盒和CAAT盒,在这些顺式元件的共同作用下,Prd29A表现出仅在胁迫诱导条件的转录激活活性[24,25],被认为是一个胁迫诱导型启动子。
3 Prd29A启动子在植物基因工程的应用
3.1 Prd29A启动子在耐旱基因工程中的应用 干旱是导致作物减产最主要的环境因素,在干旱条件下,细胞脱水造成植物组织失去正常生理功能,植株难以生存。传统的育种方法可以得到抗旱植株,但是育种周期长、效率低,用分子生物学技术手段通过品种改良提高植株抗旱能力,有效地解决了传统育种周期长和效率低的问题,对于国家农业稳定发展的意义深远。柳娜[26]等通过转化PRD29:DREB1A到小麦中培育出了抗旱性强的融合基因小麦,结果表明,转基因小麦的过氧化物酶、氧化氢酶和超氧化物歧化酶在干旱胁迫下表现出了更强的活性,说明转基因小麦在干旱胁迫下具有更强的清除活性氧的能力,抵抗因干旱带来的加速衰老甚至死亡;2013年,Li F[27]等研究发现,构建组成型启动子表达载体35S:EXPB23转化烟草,得到的转基因植株出现严重的发育迟缓表型,PRD29A:EXPB23转化植株表型明显改善,并且抗旱能力增强;Amanda Alves de Paiva Rolla[28]等用Prd29A:AtDREB1A转化大豆培育对于温室和田间耐寒的新品种;Li Z N[29]等用30%的PEG分别处理35S-:AtCDPK1和Prd29A:AtCDPK1转基因马铃薯发现,由Prd29A启动子调控的转基因植株中,CDPK1基因在干旱压力胁迫下的表达量显著提高,然而35S在压力处理瞎与正常生长的植株并没有显著差异,形态学观察表明,Prd29A:AtCDPK1转基因植株在胁迫处理后仍可以正常生长,优于非转基因植株;吴琼[30]等通过遗传转化PRD29A:AVP1表达盒获得了抗旱性增强的匍匐翦股颖,表现出明显的发达根系表型,对土壤中水分和养分的吸收能力显著提高。
3.2 Prd29A启动子在耐寒基因工程中应用 植物在生长过程中由寒冷带来的损伤是重要的非生物胁迫之一,特别是对于油菜、小麦、韭菜等越冬作物而言,最适生长温度是0℃以上的低温不结冰。在我国北方冬季,冻害是造成植株死亡、农作物大量减产的主要原因,另外低温还限制了植物的时空分布[31],因此,培育耐寒的优良作物品种是解决低温影响的有效手段。王北艳[32]等构建了Prd29A启动子调控的ICE1基因的植物超表达载体,对粳稻品种空育131进行遗传转化发现,在寒冷胁迫处理下,大多野生型植株发生叶面卷曲、萎蔫、植株倒伏等致死表型,而转基因株系T1-16和T1-24的脯氨酸含量显著升高,基本都能恢复生长,表现出明显的抗寒表型,存活率显著高于对照;María Teresa Pino[33]等在对马铃薯低温胁迫研究中发现,由Camv35S启动子驱动AtCBF的转基因植株的抗冻性并没有明显增强,依旧表现出小叶、黄叶、延迟开花以及块茎减少或缺乏等表型,而Prd29A:AtCBF转基因植株在暴露于低温的几个小时就超过了35S:AtCBF的抗冻水平,并且降低了正常状态下的负面表型;贾海燕[34]等通过构建Prd29A:DREB1B表达载体分别转化了康乃馨、雏菊、三色堇、矮牵牛等多种花卉植物,培育出新型的抗逆花卉品种,扩大了花卉的种植范围和时间,延长了开花季节,在很大程度上提高了这些观赏植物的经济价值,为以后在寒冬中看到花朵绽放增加了更多的可能性。
3.3 Prd29A启动子在耐盐碱基因工程中应用 土壤盐碱化是全球性土地荒漠化的主要表现形式之一。在自然和人类活动的不断干扰下,受盐渍化影响的土地面积不断增加,严重制约了农业发展,对生态安全造成威胁[35]。盐胁迫可能会诱导植株发生一系列生理生化的改变,渗透压的改变直接影响了细胞膜的完整性和各种酶的活性。Qiu W[36]等研究发现,烟草中Prd29A:IPT基因的转化延迟了盐胁迫下叶片的衰老,提高了植株的抗氧化酶(POD、SOD等)活性和叶绿素、丙二醛(MDA)的含量,表现出更强的耐盐能力;JINGJIANG[37]等构建表达载体Prd29A:codA,转化烟草得到转基因植株,在NaCl胁迫诱导下,所有的转基因烟草植株均表现出比对照更高的盐度耐受能力,与野生型相比,转基因植株表现出明显的叶色差异、抗氧化酶活性增加,有效赋予了烟草植株的胁迫耐受性;Jin T[38]等通过遗传转化Prd29A:GmDREB1引入苜蓿植物中,转基因植株中与盐碱胁迫相关的代谢物D1-吡咯啉-5-羧酸合酶(P5CS)基因转录水平显著上调,这表明转基因植株的应激诱导表达赋予了苜蓿更强的耐盐能力,这些具有高耐盐性的转基因品系在饲草育种中具有重要的意义。
4 展望
逆境一直是全世界研究人员们致力解决的难题,为了提高植物的抗逆性,与传统的杂交育种策略相比,通过基因工程的手段直接导入外源基因是一种更简单快捷的解决方法。植物响应不同的环境胁迫条件时会表现出不同的基因转录水平,其在代谢和生理方面也会表现出特定的变化。通过开发利用新型启动子与抗逆相关基因的表达盒,能够很大程度提高植物的应激响应能力。但是我们对于诱导型启动子的研究相对于组成型启动子来说起步较晚[39],先前的植物转基因工程中用到最多的就是CaMV花椰菜花叶病毒的35S启动子[40],在各项研究中发现,这种组成型启动子在普通条件下也能驱动一些外源胁迫相关基因的表达,可能会造成大量的基因功能冗余,还会导致基因之间因为竞争关系带来的资源浪费,甚至可能直接影响了转化植株的正常生长,所以转化植株中经常会出现矮茎、叶片卷曲、发黄等负面表型[41],而诱导型启动子Prd29A正好弥补了这些不足,在未受到胁迫条件下它并不会表现出转录激活活性,只有在干旱、寒冷、盐碱等非生物逆境中才会驱动下游基因的转录,这在能够保证植物抗逆性提高的同时把副作用最小化。
目前,对于抗胁迫相关启动子的开发及应用已成为植物基因工程的研究热点,但是对于各类胁迫相关调控元件以及新的保守功能基序的发现还需要进一步探索[42]。由于植物应激响应调控网络相当复杂,还有很多胁迫诱导转录因子还并未被人们发现,植物在受到胁迫信号时是如何将这些信号在复杂的调控网络中传递的,如何引起植物通过各种代谢物水平的变化应答极端环境的,如何把这类诱导型启动子应用到非生物胁迫应答中,这些都需要更加深入的研究。利用这些生物技术手段培育优良的耐逆作物品种,对于加快我国农业经济的高速发展意义重大。
参考文献
[1]李书粉,孙富丛,肖理慧,等.植物对非生物胁迫应答的转录因子及调控机制[J].西北植物学报,2006,6:1295-1300.
[2]K P A, Arti G.Stress responsive gene regulation in relation to hydrogen sulfide in plants under abiotic stress[J]. Physiologia plantarum, 2020, 168(2):511-525.
[3]Arif M A, Alseekh S, Harb J, et al.Abscisic acid, cold and salt stimulate conserved metabolic regulation in the moss Physcomitrella patens[J].Plant Biology(Stuttg),2018,20(6):1014-1022.
[4]Shinozaki K, Yamaguchi-Shinozaki K, Seki M.Regulatory network of gene expression in the drought and cold stress responses[J].Current Opinion in Plant Biology,2003,6(5):410-417.
[5]代宇佳,羅晓峰,周文冠,等.生物和非生物逆境胁迫下的植物系统信号[J].植物学报,2019,54(02):255-264.
[6]Mahajan S,Tuteja N.Cold,salinity and drought stresses:an overview[J].Archives of Biochemistry and Biophysics,2005,444(2):139-158.
[7]Lee S C,Luan S.ABA signal transduction at the crossroad of biotic and abiotic stress responses[J]. Plant Cell and Environment,2011,35(1):53-60.
[8]张清秀,陈福禄,傅永福,等.逆境启动子的鉴定及在大豆中的应用[J].分子植物育种,2020,18(08):2556-2562.
[9]Yamaguchi-Shinozaki K, Shinozaki K.Arabidopsis DNA encoding two desiccation-responsive rd29 genes[J].Plant Physiol,1993,101(3):1119-1120.
[10]Behnam B, Kikuchi A, Celebi-Toprak F, et al. Arabidopsis rd29A:DREB1A enhances freezing tolerance in transgenic potato[J].Plant Cell Reports,2007,26(8):1275-1282.
[11]Jia H, Zhang S, Ruan M, et al.Analysis and application of RD29 genes in abiotic stress response[J].Acta Physiologize plantarum,2012,34(4):1239-1250.
[12]王莹,罗国坤,韩烈保.结缕草胁迫诱导型启动子Rd29A的克隆及功能鉴定[J].生物技术通报,2011(08):118-122.
[13]Yamaguchi-Shinozaki K.Characterization of the expression of a desiccation-responsive rd29 gene of arabidopsis thaliana and analysis of its promoter in transgenic plants[J].Mol. Gen. Genet.,1993,236(2-3):331-340.
[14]申丽婕,于月华,刘娜,等.拟南芥rd29A启动子的克隆及植物表达载体构建[J].湖北农业科学,2016,55(18):4824-4826.
[15]郭晋艳,郑晓瑜,邹翠霞,等.植物非生物胁迫诱导启动子顺式元件及转录因子研究进展[J].生物技术通报,2011(04):16-20.
[16]张春晓,王文棋,蒋湘宁,等.植物基因启动子研究进展[J].遗传学报,2004,031(012):1455-1464.
[17]Pla M, Vilardell J, Guiltinan M J, et al.The cis-regulatory element CCACGTGG is involved in ABA and water-stress responses of the maize gene rab28[J].Plant Molecular Biology,1993,21(2):259-266.
[18]Mundy S J.Gene expression in response to abscisic acid and osmotic stress[J].Plant Cell,1990,2(6):503-512.
[19]Pan W, Zheng P, Zhang C, et al.The effect of ABRE BINDING FACTOR 4-mediated FYVE1 on salt stress tolerance in Arabidopsis[J].Plant Science,2020,296:110489.
[20]Baumann K.Membrane-to-nucleus signals modulate plant cold tolerance[J].Nature Reviews Molecular Cell Biology,2017,18(5):276-277.
[21]Yamaguchi-Shinozaki K,Shinozaki K.Organization of cis-acting regulatory elements in osmotic-and cold-stress-responsive promoters[J].Tyends in Plant Science,2005,10(2):88-94.
[22]柳娜,楊文雄,王世红,等.拟南芥rd29A启动子在不同胁迫下GUS活性分析[J].甘肃农业科技,2019,521(05):44-50.
[23]Liu W S, Sikora E, Park S-W.Plant growth-promoting rhizobacterium, Panebacillus polymyxa CR1, upregulates dehydration-responsive genes, RD29A and RD29B, during priming drought tolerance in arabidopsis[J].Plant Physiology and Biochemistry,2020,156:146-154.
[24]王珍珍,夏阳,陈学森,等.转rd29A基因国槐试管苗对盐胁迫的生理响应[J].中国农学通报,2009,25(008):117-120.
[25]Jin Z P,Yu X,Pei Y X.Ectopic expression of AtSOC1 gene driven by the inducible promoter rd29A, causes early flowering in Chrysanthemum[J].Scientia Horticulturae,2020,261:109051.
[26]柳娜,杨文雄,王世红,等.转RD29A:DREB1A融合基因小麦的获得及其抗旱性研究[J].麦类作物学报,2020(08):1-9.
[27]Li F, Han Y, Feng Y, et al.Expression of wheat expansin driven by the RD29 promoter in tobacco confers water-stress tolerance without impacting growth and development[J].Journal of Biotechnology,2013,163(3):281-291.
[28]Rolla A A D P ,Josirley de Fátima Corrêa Carvalho.Phenotyping soybean plants transformed with rd29A:AtDREB1A for drought tolerance in the greenhouse and field[J].Transgenic Research,2014,23(1):75-87.
[29]聶利珍,于肖夏,李国婧,等.Rd29A启动子驱动AtCDPK1基因转化马铃薯的研究[J].中国生物工程杂,2015,11:19-28.
[30]吴琼.农杆菌介导rd29A启动子驱动AVP1基因转化匍匐翦股颖的研究[D].杭州:浙江大学,2007.
[31]谢鹏远,戚晓利.植物低温响应研究进展[J].佳木斯大学学报(自然科学版),2020,38(04):117-118,28.
[32]王北艳,殷奎德.转rd29A-ICE1冷诱导基因水稻提高抗寒性研究[J].核农学报,2013,27(06):731-735.
[33]María-Teresa Pino, Skinner J S, Zoran Jekni, et al.Ectopic AtCBF1 over-expression enhances freezing tolerance and induces cold acclimation-associated physiological modifications in potato[J].Plant Cell and Environment,2010,31(4):393-406.
[34]贾海燕.DREB1B和RD29A启动子的克隆、载体构建及康乃馨和雏菊遗传转化体系的建立[D].兰州:兰州大学,2010.
[35]洪林,杨蕾,杨海健,等.AP2/ERF转录因子调控植物非生物胁迫响应研究进展[J].植物学报,2020,55(04):481-496.
[36]Qiu W, Liu M, Qiao G, et al. An Isopentyl transferase gene driven by the stress-inducible rd29A promoter improves salinity stress tolerance in transgenic tobacco[J].Plant Molecular Biology Reporter,2012,30(3):1-10.
[37]Bot P J, Li H, Yin Y, et al.Over-expression of the codA gene by RD29a promoter improves salt tolerance in Nicotiana tabacum[J].Pakistan Journal of Botany,2013,45(3):821-827.
[38]Jin T, Chang Q, Li W, et al. Stress-inducible expression of GmDREB1 conferred salt tolerance in transgenic alfalfa[J].Plant Cell Tissue and Organ Culture,2010,100(2):219-227.
[39]文添龙,刘雪梅,冀亚萍,等.高等植物胁迫诱导型启动子的研究进展[J].西北植物学报,2014,034(001):206-214.
[40]朱丽萍,于壮,邹翠霞,等.植物逆境相关启动子及功能[J].遗传,2010,032(003):229-234.
[41]Jia N W, Zhao P S, Hong F J, et al. Characterization of wheat TaSnRK2.7 promoter in Arabidopsis[J].Planta,2018,248(6):1393-1401.
[42]杨瑞娟,白建荣,李锐,等.诱导型启动子在植物基因工程中的研究进展[J].山西农业科学,2018,046(002):292-298.
(责编:张宏民)

