胸腹主动脉瘤微创腔内治疗进展
艾克白尔江·艾尼瓦尔,冯 睿,冯家烜,鲍贤豪,吴明炜,赵玉玺,李 涛,曾照祥,陆 烨,徐子依,周 建,景在平
胸腹主动脉瘤(thoracoabdominal aortic aneurysm,TAAA)指胸腹主动脉扩张达正常直径1.5 倍以上累及胸主动脉、肋间动脉、腹主动脉及内脏诸分支动脉的动脉瘤,为主动脉常见疾病。随着近年人们寿命延长,TAAA 发病率逐渐升高。随着检出手段进步,其检出率约为10.4/10 万以上。研究提示高达80%TAAA 患者瘤体会破裂,未经治疗患者5 年生存率不足20%[1-2]。TAAA 病变范围因累及各内脏动脉,传统外科手术难度较大,高危患者不能耐受。随着血管腔内技术不断进步,全腔内治疗TAAA 逐步成为主流选择。本文就当前TAAA 腔内微创治疗进展综述如下。
1 TAAA 分型
1.1 Crawford 分型
目前国际上最多采用的是Safi 修订的Crawford分型[3],见图1。TAAA Ⅰ型:动脉瘤自左锁骨下动脉开口远端扩展至肾动脉以上;Ⅱ型:左锁骨下动脉远端扩展至肾动脉以下;Ⅲ型:第6 肋间隙至肾动脉平面以下;Ⅳ型:第12 肋以下至肾动脉以下;Ⅴ型:第6 肋间隙至肾动脉以上。TAAA 治疗策略选择很大程度上取决于病变位置、累及范围、分支动脉累及情况等。随着TAAA 腔内治疗深入发展,尤其是累及分支动脉TAAA 全腔内隔绝术进展,需要提出更为细化的分型,才能适应未来全腔内治疗和学术研究的需要。
1.2 3N3V 分型
3N3V 分型[4]将主动脉全程(包括主动脉根部主动脉瓣、主动脉窦及远端双侧髂动脉)分成6 个区,分界线依次为主动脉瓣环、冠状动脉开口远端1.5 cm、无名干开口近端1.5 cm、左锁骨下动脉开口远端1.5 cm、腹腔干开口近端1.5 cm、肾动脉开口远端1.5 cm 和腹股沟韧带;6 个区中有重要分支的3个区域定义为脏区(visceral part),依次记为V1、V2、V3 区,另外3 个区域定义为相对裸区(nude part),依次记为N1、N2、N3 区,见图2。
V1 区亚分型:将累及V1 区的主动脉病变进一步亚分为P 亚型(pericardium subtype, 心包亚型)、C 亚区(coronary subtype,冠状动脉亚型)和V 亚区(valve subtype,主动脉瓣亚型);V2 区亚分型:将累及V2 区的主动脉病变进一步亚分为I 亚型(innominate artery subtype,无名干亚型)、C 亚型(carotid artery subtype,左颈总动脉亚型)和S 亚型(subclavian artery subtype,左锁骨下动脉亚型);V3区亚分型:将累及V3 区的主动脉病变进一步亚分为C 亚型(celiac trunk subtype,腹腔干动脉亚型)、M亚型(superior mesenteric artery subtype,肠系膜上动脉亚型)和R 亚型(renal artery subtype,肾动脉亚型);N3 区亚分型:将累及N3 区的主动脉病变进一步亚分为A 亚型(abdominal aorta subtype,肾下腹主动脉亚型)、C 亚型(common iliac artery subtype,髂总动脉亚型)、I 亚型(internal iliac artery subtype,髂内动脉亚型),见图3。3N3V 分型对于TAAA 全腔内治疗手术方式选择、内脏动脉重建方法进步,将发挥越来越明显的指导作用。
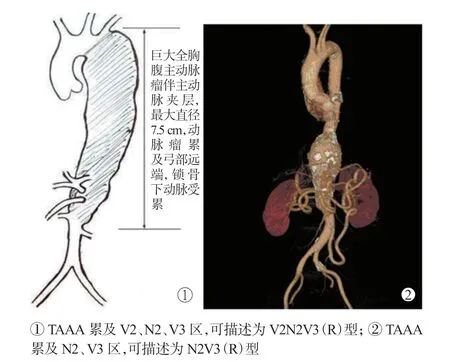
图3 主动脉3N3V 细化亚分型示例
2 腔内治疗适应证
Elefleriades 等提出的TAAA 腔内手术治疗适应证[5]:①瘤体破裂;②急性夹层形成;③临床症状持续不缓解;④瘤体直径迅速增大;⑤瘤体直径达到干预标准。
3 腔内治疗围手术期并发症
TAAA 腔内隔绝治疗围术期并发症主要包括术后内漏(9%~38%)、心血管并发症(6%~14%)、支架移位或闭塞(0.7%~3.9%)、脑卒中(3.1%~4.8%)、截瘫(2.3%~10%)、支架塌陷(罕见)、瘤体持续扩大(7.1%~14.5%)和肾功能损伤(8%~14.5%)等[6-11]。
3.1 内漏
内漏是TAAA 腔内治疗后最为常见的并发症之一。目前将内漏分为4 型[12]。Ⅰ型:覆膜支架两端与血管壁间帖服不紧密(近端为Ⅰa 型,远端为Ⅰb 型)。其预防需要基于术前测量分析选择适当的支架,有效处理方法是植入额外支架,延长锚定区或增大锚定力,以更好地贴附支架移植物,隔绝内漏。Ⅱ型:血液自肋间动脉、腰动脉和肠系膜下动脉反流入假腔。可定期随访,若内漏血流量较大,可经肠系膜下动脉、腰动脉和髂动脉等分支行栓塞治疗。Ⅲ型:血液自移植物破损处流入瘤腔,处理原则是选用合适口径的移植物将破损处隔绝。Ⅳ型:血液自覆膜支架自身途径流入瘤腔,反流血流量不大,往往可自闭。综上,术中准确评估、手术技术改进和器械改良是预防内漏发生的关键[13]。
3.2 支架塌陷或血栓闭塞
支架塌陷往往导致脊髓、内脏器官和肢体缺血损害。髂支闭塞发生率较高,文献报道为3%~5%。支架塌陷潜在危险因素,包括支架释放区域主动脉内径过小、髂支并行段两侧髂支口径相差悬殊、一侧髂支在开口处遮蔽另一侧髂支、一体化腹主动脉支架移植物在分叉部扭曲、内脏动脉平行支架塌陷或狭窄导致栓塞闭塞等[14]。通常需要紧急再次手术治疗,目前对大多支架塌陷或血栓闭塞均可予以腔内治疗二次处理,但也有严重患者需外科手术干预。
3.3 血管并发症
髂动脉明显狭窄或严重钙化易引起手术入路相关血管并发症,如血管破裂、血管撕裂、血栓形成、动静脉瘘形成和器械推送取出受阻等。因此,术前影像学检查确定手术路径非常重要,必要时可通过球囊预扩张或放置髂支移植物后扩张等方法处理高度狭窄、钙化、扭曲的入路。
3.4 神经系统并发症
神经系统并发症包括脑卒中和截瘫。脑卒中可能与升主动脉或主动脉弓血栓形成并脱落、覆膜支架导致颈动脉分支闭塞等相关。截瘫是腔内治疗最严重并发症[15]。近期研究表明,TAAA 腔内治疗脊髓缺血损伤或截瘫发生风险较传统开放手术下降2.3%~10%[12,16],通过术中降低颅内压、避免血压过低、围术期纳洛酮抑制神经过度兴奋性、预防性脑脊液引流等积极措施,可使围术期脊髓缺血发生风险控制在1%左右[17]。也有研究表明,分期手术可减少截瘫发生,该结果可能与脊髓前动脉侧支循环形成有关[9]。
3.5 肾功能不全和对比剂肾病
TAAA 患者腔内隔绝治疗后对比剂肾病(CIN)发生率与对比剂用量、术前存在肾功能不全病史密切相关[14],其它危险因素包括糖尿病、年龄超过75 岁、围术期体重下降、心功能不全、肝硬化、高血压病、蛋白尿、围术期应用非甾体类镇痛抗炎药(NSAID)。CIN 发病率高、治疗困难、后果严重, 除了予以及时透析治疗外,目前尚未发现特异性治疗,因此预防CIN 发生显得尤其重要。有研究证实术前术后水化、适当碱化尿液等是CIN 预防金标准[18]。
4 不同腔内技术治疗进展
近年来腔内技术在TAAA 治疗中取得了较为满意的临床结果,让越来越多患者受益[19]。目前TAAA 腔内治疗方法主要包括开窗动脉瘤腔内修复术(fenestrated endovascular aneurysm repair,FEVAR)、分支动脉瘤腔内修复术(branched endovascular aneurysm repair, BEVAR)和八爪鱼腔内技术(parallel endograft octopus technique)。
4.1 FEVAR 和BEVAR 技术
FEVAR 技术是在覆膜支架主体上存留与需要被覆盖区域分支动脉相对应的侧孔,术中通过该侧孔导入球扩式或自膨式覆膜支架至目标动脉,从而使分支动脉血运得以重建。Park 等[20]1996 年首次报道2 例FEVAR 术患者,分别为肠系膜下动脉开窗和肾动脉开窗。陈岩等[21]2018 年回顾性随访分析7 例台上FEVAR 治疗TAAA 患者,术后6 例主体开窗支架和内脏分支支架通畅,1 例术后2 d 死于心肌梗死,随访期间4 例出现Ⅱ型和Ⅲ型内漏。BEVAR 技术所采用的覆膜支架由主体及其相连接分支支架组成。Chuter 等[22]2001 年报道成功地应用分支型支架治疗Ⅲ型TAAA。随后,如何实现TAAA 全腔内治疗成为全球研究热点。
Verhoeven 等[23]报道应用Zenith 定制分支支架治疗30 例TAAA 患者(动脉瘤平均直径为70 mm,Ⅰ型8 例,Ⅱ型5 例,Ⅲ型12 例,Ⅳ型5 例),结果显示手术技术成功率为93%(28/30),2 例(6.7%)出现靶动脉闭塞,30 d 死亡率为6.7%(2/30),6 个月、1 年生存率分别为89.3%、76.0%。Sweet 等[24]报道尝试采用标准化分支支架技术,旨在节省既往定制需花费大量工艺制作时间,增加TAAA 腔内治疗范围,并认为标准化分支支架适用范围包括:①须重建的内脏动脉不超过4 支;②腹腔干和肠系膜上动脉直径为6~10 mm;③肾动脉直径4~8 mm;④所有目标动脉重建入路需经肱动脉;⑤每枚延长型支架(cuff)和对应动脉开口距离≤50 mm;⑥沿主动脉长轴,延长型支架与内脏动脉开口偏差≤45°。
Schneider 等[25]报 道 对50 例TAAA 患 者(194支内脏动脉)行FEVAR/BEVAR 治疗前瞻性、非随机化、单因素研究,结果显示技术成功率为99.5%(193/194 支),30 d 主要不良事件(MAE)发生情况为死亡3 例(6%),新发病透析1 例(2%),遗尿症/截瘫3 例(6%),脑卒中2 例(4%)。FEVAR/BEVAR围术期动脉瘤相关死亡率和发病率较低,但开窗技术存在操作复杂、费时、内漏发生率高等不足。标准化分支支架技术仍处于探索阶段,台上自制分支型支架重建TAAA 技术对术者经验要求较高,仅有部分临床中心可开展,且远期分支通畅率、内漏率、支架移植物完整性等均需进一步评估。
4.2 八爪鱼支架技术
八爪鱼支架技术可采用目前上市的主动脉和外周动脉覆膜支架重新组合,应用于动脉瘤腔内隔绝和内脏动脉血供重建,是一新颖的TAAA 腔内治疗手段(图4)。八爪鱼技术由美国医师Kasirajan[26]于2011年首次应用于TAAA治疗。国内谷涌泉等[27]最早应用八爪鱼技术治疗1 例TAAA 患者,术中未出现并发症及不良事件,随访期间内脏区分支动脉通畅,未发现内漏、支架闭塞及脊髓缺血等并发症。该技术所采用的支架由2 枚或多枚主体覆膜支架加上多枚外周覆膜支架组合而成,因最终组合完成后伸入至内脏动脉内的覆膜支架外型酷似章鱼触角而得名。该术式基本操作步骤:①选择合适的主体支架植入TAAA 上方健康的主动脉部位,向后延伸的腹主动脉主体覆膜支架短腿支作为腹腔分支血管支架的共同开口(支架入路经由肱动脉、腋动脉、锁骨下动脉及颈动脉);②选择适合长度、内径的覆膜支架植入对应内脏动脉内;③连接第2 枚腹主动脉主体覆膜支架,如同常规腹主动脉瘤支架植入术。

图4 八爪鱼技术示意图
5 结语
目前鲜见关于TAAA 不同治疗方式的对比研究报道。FEVAR、BEVAR 和八爪鱼腔内治疗技术不断探索给TAAA 患者带来了多元治疗选择空间,为建立个体化治疗方案,找到适用于个体的优化治疗方案提供了基础。需建立更大样本量随机对照研究,以评估这些腔内技术的安全性和有效性。