HRP酶促丝胶自交联及其膜材料的制备
胡浩然 何敏 王平 余圆圆 袁久刚 王强
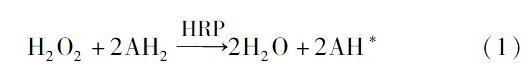
摘要: 丝胶(SS)具有良好的生物相容性,但水溶性较高,材料成型性差,限制了其在生物材料领域的应用。文章通过辣根过氧化物酶(HRP)和过氧化氢(H2O2)协同催化丝胶蛋白分子间交联,并在此基础上制备丝胶蛋白膜材料。测定反应前后丝胶蛋白相对分子质量与二级结构变化,考察丝胶蛋白膜的水溶性、热性能及机械性能。结果表明:丝胶中酪氨酸残基能被HRPH2O2体系催化氧化,引发丝胶蛋白分子间交联和相对分子质量增加,丝胶蛋白的二级结构由无定形结构向β构象转变。与未处理的丝胶膜相比,经酶促交联改性的丝胶膜水溶性下降,热性能和机械性能有所改善。
关键词: 丝胶;辣根过氧化物酶(HRP);酶促交联改性;膜材料;成型性
中图分类号: TS102.54;TQ340.64文献标志码: A文章编号: 10017003(2020)02000105
引用页码: 021101DOI: 10.3969/j.issn.10017003.2020.02.001
HRPcatalyzed crosslinking of silk sericin and preparation of its membrane material
HU Haoran, HE Min, WANG Ping, YU Yuanyuan, YUAN Jiugang, WANG Qiang
(Key Laboratory of EcoTextiles, Ministry of Education, Jiangnan University, Wuxi 214122, China)
Abstract: Silk sericin(SS) has the excellent biocompatibility. However, its high water solubility and poor formability limit its applications in the biomaterial field. In the present work, horse radish peroxidase(HRP) was used to catalyze the crosslinking of sericin in the presence of hydrogen peroxide(H2O2), and the membranes of crosslinked sericin were prepared on this basis. Changes in the relative molecular weight and secondary structure of silk sericin before and after the enzymatic reaction were determined, respectively. The properties of silk sericin membranes, including water solubility, thermal behavior and mechanical property were also examined. The results indicate that the HRPH2O2 system could oxidize the tyrosine residues in sericins, thus initiating intermolecular crosslinking of sericin and increase in the relative molecular mass. The secondary structure of sericin is transformed to β conformation from amorphous structure. Compared with untreated sericin, water solubility of sericin modified by enzymatic crosslinking declined, and the thermal property and mechanical property improved.
Key words: silk sericin; horse radish peroxidase(HRP); enzymatic crosslinking modification; membrane material; formability
丝胶(SS)约占蚕丝总量的20%~30%,相对分子质量分布范围较宽[1]。丝胶含有18種氨基酸,其中丝氨酸、天冬氨酸、酪氨酸等极性氨基酸含量较高[2],赋予了其极好的亲水性。由于丝胶溶解性高、成型性差,因此传统蚕丝脱胶过程中,丝胶蛋白作为副产品被排入废水中。有研究发现,丝胶蛋白具有许多重要的生物活性如抗氧化、抗紫外、低免疫原性等[34],使其在生物医药、化妆品和食品工业等领域有着很大的应用潜力。采用化学法进行丝胶蛋白交联或分子改造,能提升丝胶蛋白的应用性能[57],拓展丝胶基材料的应用性能。与化学法丝胶改性方法相比,生物酶法反应条件温和,具有生态友好的加工特点。辣根过氧化物酶(HRP)在过氧化氢(H2O2)的存在下,可催化氧化含酚羟基的底物产生酚氧自由基[8],继而引发酚类单体之间发生自由基聚合,该过程反应机理如下式所示。
H2O2+2AH2HRP2H2O+2AH*(1)
式中:AH2与AH*分别代表酚类底物及其自由基产物。
丝胶蛋白中含有一定量的酪氨酸残基,因此可借助于HRP—H2O2体系催化丝胶蛋白中酪氨酸残基,实现酶促丝胶蛋白分子自交联(图1),为丝胶蛋白酶法改性和丝胶基蛋白材料制备提供了一种新方法。
本文首先研究不同碱量脱胶对丝胶相对分子质量的影响,确定后续实验所采用的脱胶方法;在此基础上,借助HRPH2O2体系催化丝胶蛋白自交联,比较反应前后丝胶蛋白相对分子质量及其构象变化,并制备丝胶蛋白膜材料,进一步探究膜材料的水溶性、热性能和机械性能。
1实验
1.1材料与仪器
1.1.1材料
5A级桑蚕生丝(鑫缘茧丝绸集团股份有限公司),辣根过氧化物酶HRP(>300U/mg,阿拉丁试剂有限公司),无水碳酸钠、二水合磷酸氢二钠、十二水合磷酸二氢钠、氯化钠、乙酰丙酮、30%过氧化氢、丙三醇均为分析纯(国药集团化学试剂有限公司)。
1.1.2仪器
AL204电子天平、EL20pH计(瑞士METTLER TOLEDO公司),SHJA水浴恒温磁力搅拌器(江苏省金坛市金南仪器制造有限公司),DHG9070A电热鼓风干燥箱(上海一恒科学仪器有限公司),FD1A50真空冷冻干燥机(北京博医康实验仪器有限公司),E2695高效液相色谱仪(美国Waters公司),MiniPROTEAN蛋白质凝胶电泳系统(美国BIORAD公司),MOS450圆二色谱仪(美国Biologic公司),DSC Q200差示扫描量热仪(美国TA Instruments公司),3385H电子万能材料试验机(美国Inston公司)。
1.2方法
1.2.1丝胶溶液制备
生丝以去离子水洗涤后,以碳酸钠(0、0.1、1.0、5.0g/L)进行碱法脱胶,温度98℃,时间4h,浴比1︰50。脱胶后获得的丝胶蛋白溶液转移至透析袋(Mw 8000~14000 Da)中透析48h,以去除盐和小分子杂质,并以称重法精确测定丝胶溶液的质量浓度,在4℃下保存备用。
1.2.2HRPH2O2二元体系催化丝胶自交联
在氮气保护下,置三口烧瓶内进行HRP催化丝胶蛋白交联,丝胶质量浓度为1g/L;当瓶内空气被完全排空后,加入12U/mL HRP酶溶液(体系pH=7,温度37℃),在1h内逐滴加入0.4% H2O2(30%),继续反应1~8h,所得产物标记为SSSS。
1.2.3丝胶蛋白膜制备
冻干膜制备:分别将反应前后的丝胶蛋白溶液在-20℃下储存4h,然后在-50℃下冷冻干燥24h。将冻干膜浸入75%乙醇中30min,用去离子水洗涤几次去除残留的乙醇溶液,再次放入冰箱储存并冷冻干燥24h。
风干膜制备:将反应前后的丝胶蛋白溶液以30%的聚乙二醇溶液浓缩至40g/L,加入6‰甘油后以流延法在聚四氟乙烯模具中成膜,室温条件下风干,在20℃和65%相对湿度条件下平衡24h。
上述反應前后的丝胶蛋白膜分别记为SS和SSSS。
1.3分析测试
1.3.1SDSPAGE
分别将15μL反应前后的丝胶溶液与5μL蛋白质上样缓冲液混合,并沸煮10min。采用丙烯酰胺质量分数为8%的分离胶,16%的浓缩胶,上样10μL,在MiniPROTEAN电泳系统中以150V电泳约1h;将凝胶浸入G250考马斯亮蓝溶液中进行染色;最后将凝胶浸入去离子水中脱色。
1.3.2体积排阻色谱(SEC)
丝胶溶液经0.22μm滤膜过滤后,用Ultradrogel柱在E2695高效液相色谱仪中分析丝胶蛋白相对分子质量变化。以含0.3M氯化钠、摩尔浓度为50mM、pH值7磷酸盐缓冲液为洗脱液,洗脱速度0.5mL/min,柱温为25℃,使用2998 PDA Detector紫外检测器在214nm处测定不同样品SEC曲线。
1.3.3圆二色谱(CD)
在1mm比色皿中加入质量浓度为0.1mg/L的丝胶蛋白溶液样品,在JASCO715分光偏振计上进行检测。检测波长为190~250nm,扫描速度为100nm/min,扫描值为3次数据的平均值。
1.3.4冻干膜材料溶胀形态及溶失率(DR)测定
将一定质量m1的丝胶冻干膜于105℃烘干至恒重(质量记为m0),通过公式计算膜材料在空气中的含水率。然后,将反应前后的丝胶蛋白溶液所制备的冻干膜称重(质量记为m3)分别置于装有去离子水培养皿中,浴比为1︰100,在37℃下放置不同时间,观察其形态并拍照记录,同时取出膜材料并在105℃下干燥至恒重,称其质量记为m4,通过公式计算膜材料的溶失率,结果取3个平行样的均值。
w/%=m1-m0m1×100(2)
DR/%=m3×(1-w)-m4m3×(1-w)×100(3)
1.3.5差示扫描量热(DSC)测试
称取2~3mg的丝胶蛋白冻干膜样品,采用TAQ200差示扫描量热仪进行分析。其中,升温速率10℃/min,升温范围30~300℃,氮气流速50.0mL/min。
1.3.6机械性能测试
将风干丝胶膜切成5mm宽的条带,分别测量膜厚度;以3385H系列电子通用材料测试仪评估不同处理的丝胶风干膜的机械性能;夹持距离和拉伸速度分别设定为30mm,10mm/min。计算断裂强度和断裂伸长率,每个样品重复10次,并以算术平均值表示。
2结果与分析
2.1脱胶中碳酸钠质量浓度对丝胶相对分子质量的影响为探究脱胶中不同碳酸钠质量浓度对丝胶相对分子质量的影响,分别选取0~5g/L的碳酸钠进行对比实验,采用SEC测试不同脱胶条件下丝胶蛋白样品的SEC曲线,结果如图2所示。热水脱胶获得的丝胶蛋白溶液的曲线出峰时间较早,表明此方法获取的丝胶相对分子质量最大,但实际该条件下生丝脱胶率较低(低于15%);采用碳酸钠脱胶的样品脱胶率均大于20%,其中0.1g/L碳酸钠脱胶的丝胶样品出峰时间更早一点,这表明该条件下获取的丝胶蛋白中较高相对分子质量丝胶的比例相对更多;经5g/L碳酸钠脱胶的丝胶出现峰值时间最晚,所以其相对分子质量最小。由此可见,碳酸钠溶液质量浓度为0.1g/L时,不仅脱胶率较高,且丝胶蛋白的相对分子质量较高,故后续实验中选择0.1g/L质量浓度进行脱胶。
2.2HRPH2O2二元体系对丝胶蛋白相对分子质量的影响HRP
H2O2二元体系可催化丝胶中酪氨酸残基氧化,测定不同酶促反应时间下丝胶蛋白溶液的SEC图谱,结果如图3所示。其中,酶促反应15min后,其SEC曲线的最大峰值时间相对于未处理丝胶蛋白提前了約0.8min,表明HRPH2O2体系能催化丝胶大分子发生交联。不同时间条件下,酶促反应8h后的丝胶样品出峰时间与反应4h的试样相似最早,两者均在约15.9min出现最大峰值,表明酶促反应中丝胶蛋白相对分子质量较未处理空白样有相似程度的增加。
图4为未反应空白样和反应4h后的丝胶溶液的SDSPAGE结果。从图4中第1条谱带可以看出,丝胶蛋白的相对分子质量分布在10~170kD,而第2条谱带顶部的颜色更深,说明相对分子质量大的蛋白所占比例更高,即表明经过HRPH2O2二元体系酶促交联后,丝胶蛋白的相对分子质量增大,这一结果与图3中SEC曲线的变化规律具有很好的一致性。
2.3HRPH2O2二元体系对丝胶蛋白二级结构的影响
酶促交联前后,反应体系中丝胶蛋白的二级结构变化如图5所示。两条曲线在218nm处有弱的负吸收峰,这是由β构象引起的;曲线在198nm附近出现的强的负吸收峰为无规则卷曲的吸收峰[9];验证了丝胶蛋白构象以无规则卷曲为主。丝胶自交联样品的曲线在此处峰面积相较于未处理的丝胶稍小,且稍向后偏移,表明HRPH2O2二元体系处理以后,丝胶蛋白的二级结构可能发生了变化。表1为反应前后丝胶蛋白的二级结构的计算结果,其中未处理丝胶以无规则卷曲构象为主,占总比例的98%,几乎不含有α螺旋、β折叠和β转角。酶促交联后丝胶样品的无规则卷曲的比例下降,转变为α螺旋、β折叠和β转角,所占比例分别为20.6%、24.2%和191%,表明经过HRPH2O2二元体系催化以后,酶促交联中不仅有利于分子交联,且使蛋白分子结构从无序状态向有序状态转化。
2.4丝胶冻干膜溶胀形态
图6为不同处理的丝胶冻干膜随着时间推移在去离子水中的形态变化。从图6可以看出,未经处理的丝胶蛋白冻干膜(图6(a))在0.5h时就已发生吸水溶胀,1h时其溶失率为50.3%,3h时膜材料已经解体,几乎完全溶解在去离子水中。与之相比,丝胶自交联样品SSSS(图6(b)),在0.5h时只有边缘部分开始吸水溶胀,1h的溶失率为42.07%,3h时在水中还保留接近一半的形态(溶失率为48.13%),其水溶性有所改善,表明丝胶在经过自交联反应以后,使其水溶性降低。
2. 5 丝胶冻干膜热性能
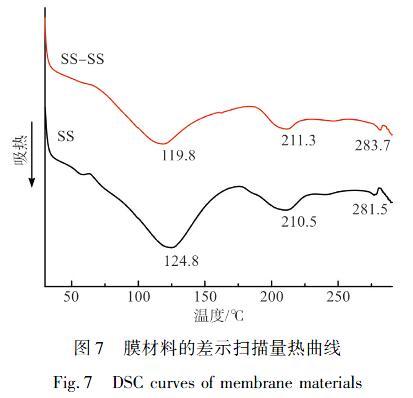
图7显示了不同处理的丝胶蛋白膜材料的热学性能。两者DSC曲线比较类似,均表现出两个吸收峰和一个放热峰。其中,在120℃左右吸热峰主要是源于样品中游离水和结合水的损失造成的[10];在210℃附近的吸收峰则是由于丝胶蛋白中无规卷曲结构的分子链热运动和部分氨基酸的热分解[11],而在约281℃处检测到的微弱放热峰则可能是晶体结构导致的。两者比较而言,HRPH2O2二元体系处理的丝胶膜材料在211℃吸热峰和284℃的放热峰均略高于未处理的丝胶膜样品,是由于丝胶自交联增加了β折叠构象,提高了其结晶度,从而使膜材料的热稳定性得到了略微的提高。
2. 6 丝胶风干膜机械性能
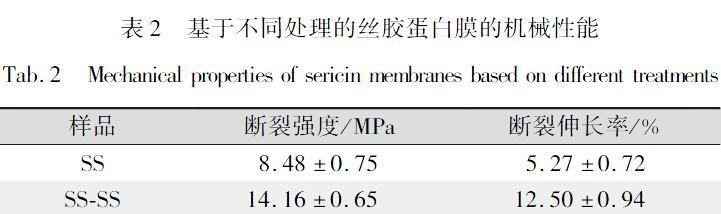
测定酶促反应前后丝胶蛋白风干膜的断裂强度和断裂伸长率,结果如表2所示。未处理的丝胶蛋白膜表现出相对较差的机械性能,断裂强度和断裂伸长率分别为8.48MPa和527%。当使用HRPH2O2反应体系催化丝胶时,丝胶大分子之间发生交联作用,使分子排列变得规整,结晶区的比例增加。因此,自交联样品SSSS的断裂强度和断裂伸长率都得到了提高,分别达到了14.16MPa和12.5%。
样品断裂强度/MPa断裂伸长率/%SS8.48±0.755.27±0.72SSSS14.16±0.6512.50±0.94
3结论
1)HRPH2O2二元体系能催化氧化丝胶中酪氨酸残基,酶促处理后丝胶蛋白的相对分子质量显著增加,二级结构由无规则卷曲逐渐向α螺旋、β折叠和β转角转变,验证了该二元催化体系能促进丝胶蛋白分子间发生自交联。
2)以12U/mL HRP酶和0.4%H2O2(30%)催化丝胶蛋白交联,在37℃、pH7条件下处理4h,制得的冻干膜水溶性降低,膜材料热性能得到提升;风干膜的机械性能也得到显著改善,断裂强度和断裂伸长率分别达14.16MPa和12.5%。该酶促交联方法为丝胶基再生蛋白材料的制备提供了新方法,有利于实现丝胶蛋白的资源化再利用。
参考文献:
[1]ZHANG Y Q. Applications of natural silk protein sericin in biomaterials [J]. Biotechnology Advances, 2003, 20(2): 91100.
[2]CAO T T, ZHANG Y Q. Processing and characterization of silk sericin from Bombyx mori and its application in biomaterials and biomedicines [J]. Materials Science & Engineering C Materials for Biological Applications, 2016, 61: 940952.
[3]JO Y N, UM I C. Effects of solvent on the solution properties, structural characteristics and properties of silk sericin [J]. International Journal of Biological Macromolecules, 2015, 78: 287295.
[4]CHEN L, HU J, RAN J, et al. A novel nanocomposite for bone tissue engineering based on chitosansilk sericin/hydroxyapatite: biomimetic synthesis and its cytocompatibility [J]. RSC Advances, 2015, 5(69): 5641056422.
[5]张业顺. 丝胶蛋白水凝胶的制备及应用研究[D]. 武汉: 华中科技大学, 2015.
ZHANG Yeshun. Preparation and Applications of Sericin ProteinBased Hydrogels [D]. Wuhan: Huazhong University of Science and Technology, 2015.
[6]ZHANG Q, DONG P, CHEN L, et al. Genipincrosslinked thermosensitive silk sericin/poly(Nisopropylacrylamide) hydrogels for cell proliferation and rapid detachment [J]. Journal of Biomedical Materials Research Part A, 2014, 102(1): 7683.
[7]JADI P K, BHARDWAJ N, MANDAL B B. CrossLinked Silk SericinGelatin 2D and 3D Matrices for Prospective Tissue Engineering Applications [J]. RSC Advances, 2016,6(107): 105125105136.
[8]CARLSSON G H, NICHOLLS P, SVISTUNENKO D, et al. Complexes of horseradish peroxidase with formate, Acetate, and Carbon Monoxide [J]. Biochemistry, 2005, 44(2): 635642.
[9]TSUKADA M, KOMOTO T, KAWAI T. Conformation of Liquid Silk Sericin [J]. Polymer Journal, 1979, 11(6): 503505.
[10]ZHOU Q, ZHANG Q, WANG P, et al. Enhancement biocompatibility of bacterial cellulose membrane via laccase/TEMPO mediated grafting of silk fibroins [J]. Fibers and Polymers, 2017, 18(8):14781485.
[11]劉义绘. 蚕丝的高温高压脱胶及纯棉织物的丝胶整理[D]. 苏州: 苏州大学, 2007.
LIU Yihui. Silk Degumming with High Temperature and Pressure and Finish of Cotton Fabrics with Sericin [D]. Suzhou: Soochow University, 2007.
收稿日期: 20190430; 修回日期: 20191212
基金项目: 国家自然科学基金项目(31771039,51373071);江苏省青蓝工程资助项目(苏教师〔2016〕15号);中央高校基本科研业务费专项资金项目(JUSRP51717A)
作者简介: 胡浩然(1994),男,硕士研究生,研究方向为纺织品生态加工技术。通信作者:王平,教授,wxwping@163.com。

