益生菌联合早期肠内营养在重症急性胰腺炎中的应用
张晶晶 曹景菊 崔静
重症急性胰腺炎(SAP),即坏死性胰腺炎,是临床常见急腹症,约占急性胰腺炎的15%,往往合并有休克、脑中毒、肝肾功能衰竭等并发症,感染性坏死率高达39%[1-2]。SAP致死率高的原因为肠内菌群失衡及易位导致肠黏膜功能损伤,长期存在的负氮平衡和营养不良也属于高危因素[3]。益生菌辅助早期肠内营养治疗,可调节肠道菌群紊乱,确保霉素释放,维持微生态平衡[4]。因此,本研究将其应用于SAP中,临床效果满意。现报道如下。
1 资料与方法
1.1 临床资料 选取我院2017年1月至2019年1月76例SAP患者为研究对象,纳入标准[5]:根据中华医学会胰腺外科学组编制的《重症急性胰腺炎诊治方案》,经B超、CT检查确诊为SAP;年龄≥18岁;患者及家属自愿参与本研究并签署知情同意书。排除标准[6]:严重精神障碍或认知性疾病;心、肝、肾脏等组织器官严重病变或合并肿瘤;资料不全。按照简单随机对照原则将其均分为对照组和观察组,对照组中男21例,女17例;年龄21~77岁,平均(50.92 ±8.54)岁;病程1~9年,平均(4.73±1.65)年。观察组中男19例,女19例;年龄22~76岁,平均(49.72 ±7.91)岁;病程2~9年,平均(4.55±1.40)年。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 均实施心电监护、禁食、胃肠减压、抑制胰酶活性、抗感染、补充血容量;给予生长抑素、改善微循环药物治疗;维持水电解质平衡等常规治疗。
1.2.1 对照组 实施全胃肠外营养,提供每日所需的糖类约占50%,蛋白质约占20%,脂肪约占30%的能量支持,糖脂比约为3/2;提供每日氮量0.25~0.39 g/kg,热氮比约为410~625 KJ/g;充分补充维生素和微量元素[7]。
1.2.2 观察组 观察组实施早期肠内营养联合益生菌治疗。(1)肠内营养治疗。肠功能正常、肛门排气后,放置复尔凯鼻肠管于空肠上端韧带20~30 cm左右;把营养管尾端固定面颊处;选取肠内营养乳剂:8%的复方氨基酸注射液+20%的长链脂肪乳注射液,行肠内营养(EN)支持。首先,滴注37 ℃温生理盐水450~550 ml,刺激肠蠕动,然后,过渡至百普力营养制剂滴注,滴速由第1天和第2天的低速(20~30 ml/h)逐渐增至第3天的100~140 ml/h,用量从50 g/d左右增至200~250 g/d。依据能量需求,调整剂量和滴速,待腹痛消失,CT血尿淀粉酶、胰腺周围炎症基本正常后,停用肠内营养,适量开放饮食,如牛奶、蔬菜、米粥等。(2)联合益生菌治疗。入院48~72 h行早期肠内营养的同时,加用双歧杆菌三联活菌胶囊,含肠球菌+双歧杆菌+嗜酸乳杆菌,采用口服或经胃管注射方式给药,每天3次,2粒/次,直至临床症状、各项生化指标基本恢复后,停止用药[8]。
1.3 观察指标 (1)营养指标。选取血清白蛋白(ALB)、转铁蛋白(TRF)、血淀粉酶(AMY)以及前白蛋白(PA)4项指标对营养状况进行评估。(2)肠黏膜屏障功能。选择血清二胺氧化酶(DAO)、D-乳酸以及肿瘤坏死因子-α(TNF-α)3项指标作为肠黏膜功能评估指标[9-10]。抽取空腹静脉血3~5 ml,在抗凝试管内以2500r/min转速低温离心10min,将分离出血清置于-70℃冰箱内待检。测定DAO、D-乳酸和TNF-α使用酶联免疫吸附实验法(ELASA)进行、手术率。(4)比较两组禁食天数、感染消退时间。
1.4 统计学处理 采用SPASS 19.00统计学软件,计量资料比较采用t检验或秩和检验,计数资料采用两独立样本的χ2检验。检验水准α=0.05。
2 结 果
2.1 两组患者营养状况比较 治疗后2周,观察组各项指标显著优于对照组(P<0.05),差异有统计学意义。见表1。

表1 治疗后2周两组患者营养状况比较
2.2 治疗后两组患者肠黏膜屏障功能指标比较 治疗后2周,观察组血清中DAO、TNF-α和D-乳酸指标,显著优于对照组(P<0.05),差异有统计学意义。见表1。

表2 治疗后两组患者肠黏膜屏障功能指标比较
2.3 治疗后两组患者临床效果比较 观察组禁食天数、感染消退时间、手术率均明显低于对照组(P<0.05)。见表3。
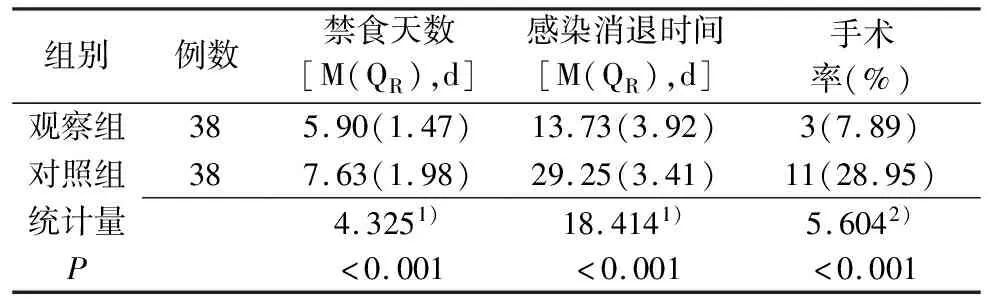
表3 两组患者临床效果比较
注:1)为u值,2)为χ2值。
3 讨 论
SAP诱因是机体胰酶异常激活,胃酸和胰腺液分泌过多,导致蛋白质、脂肪等分解过快,出现负氮平衡、代谢紊乱、黏膜屏障功能减弱以及免疫功能损伤,进而引发肠道感染、全身性炎症、多器官功能障碍等症状[11]。早期营养支持可有效刺激SPA胰腺、肠黏膜分泌,维持肠内细胞功能完整性,调节炎症介质和因子波动,促进机体吸收及代谢,提高肠黏膜屏障功能,延缓病情发展,降低并发症发生[12-13]。单纯依靠早期肠内营养支持,长期无法达到理想疗效,而益生菌补充可直接增加SPA肠道有益菌数量,抑制病菌入侵和滋生,形成“膜菌群”屏障;可发酵糖类,产生乳酸、醋酸等,促进肠道蠕动,抑制炎症发生的物质;激活体内吞噬细胞活性,增强肠道功能,减少肠源性感染,提高机体免疫力[14]。杨芬等[15]研究强调,益生菌辅助治疗,可保护肠黏膜结构,减少毒素、败血症等发生率。
观察组血清中ALB,PA,TRF和AMY指标显著优于对照组(P<0.05)。原因是益生菌联合早期肠内营养明显促进营养物质消化吸收,避免高代谢、负氮平衡、高分解等情况,提高机体免疫力,改善营养状况。观察组血清中DAO,TNF-α和D-乳酸指标明显优于对照组(P<0.05)。与王凯等[16]研究结果大致相同,由于益生菌平衡肠道内菌群,保持胃肠道内环境稳定,形成天然生物屏障,使肠道黏膜通透性、内毒素分泌减少,加快组织器官恢复,达到恢复肠黏膜功能的预期,有效避免营养不良、肌无力、伤口不愈合或感染等不良反应。结果显示,观察组禁食天数、感染消退时间、手术率均低于对照组(P<0.05)。
综上所述,益生菌联合早期肠内营养在SAP应用,不仅有效改善营养状况,提高肠黏膜屏障免疫功能,而且降低了手术概率,值得推广应用。

