优选非酿酒酵母胞外酶增香酿造干白葡萄酒效果
尹 荐,陶永胜,2,孙玮璇,陈思雨
优选非酿酒酵母胞外酶增香酿造干白葡萄酒效果
尹 荐1,陶永胜1,2※,孙玮璇1,陈思雨1
(1. 西北农林科技大学葡萄酒学院,杨凌 712100;2. 陕西省葡萄与葡萄酒工程技术研究中心,杨凌 712100)
为了研究非酿酒酵母胞外酶促进葡萄酒发酵产香的效果,该文在爱格丽葡萄汁酒精发酵12 h后,分别添加优选胶红酵母(,RM)胞外酶液,优选发酵毕赤酵母(,PF)胞外酶液和商业糖苷酶制剂(almond-glucosidase,AG)(10 mU/mL),以不添加酶制剂的酿酒酵母纯发酵为对照,发酵过程中每24 h取样,采用HS-SPME-GC/MS(headspace solid-phase microextraction-gas chromatography/mass spectrometry)监测挥发性成分的生成变化。葡萄酒含糖量低于2 g/L时终止发酵,低温满罐密封储存,次年4月,进行葡萄酒香气仪器和感官量化分析。胞外酶液共测得6种风味酶活性,其中RM酶液中的-D-葡萄糖苷酶、-L-鼠李糖苷酶、-D-木糖苷酶活性均显著(<0.05)高于PF中的,而-L-阿拉伯糖苷酶和酯酶在PF酶液中活性更高(<0.05)。发酵过程中,胞外酶处理显著促进了(<0.05)品种香气和发酵香气物质的生成,其中RM酶液显著提高了萜烯类物质和苯乙基类化合物含量,其作用效果分别比商业酶处理高41.7%和31.8%,PF酶液显著促进了发酵香气化合物的生成,尤其是脂肪酸乙酯含量约为对照的2倍。酒样感官分析结果显示,两株酵母的胞外酶处理表现出各自增香酿造的优势,其中RM酶液促进温带酸果类香气的效果突出,PF酶液显著提升了柑橘类香气。研究结果为酵母风味酶应用于葡萄酒的增香酿造提供了理论和实践指导。
酶;发酵;葡萄酒;非酿酒酵母;胞外酶;增香;香气成分
0 引 言
香气是葡萄酒主要的风味特征,也是影响葡萄酒感官质量的重要因素[1]。葡萄果实自身前体物质水解形成的品种香气物质,使葡萄酒具有独特的风味典型性。另一方面,酵母在酿酒过程中的代谢活动产生发酵香气成分对葡萄酒香气质量也有重要影响。因此,研究优选菌种发酵或者酶处理技术调控主要香气物质的生成,对于葡萄酒产业酿造技术革新具有重要意义。近年来,有研究采用不同的方法来提高葡萄酒的香气质量,如冷浸渍[2-4],酶制剂处理[5],非酿酒酵母与酿酒酵母混合发酵[6-7]等。其中混菌发酵改善葡萄酒香气质量的研究成为本领域最近的热点。研究表明,不同非酿酒酵母菌株[8]、接种比例[9]和发酵策略[10]均能够对葡萄酒香气化合物生成造成不同的影响,但是较高的非酿酒酵母接种量常常产生一些不良的次级代谢产物,破坏葡萄酒的风味质量[8]。研究发现,优选非酿酒酵母菌株的增香作用主要体现在它们分泌的风味酶上,如-D-葡萄糖苷酶(-D-glucosidase)、-L-阿拉伯糖苷酶(-L-arabinosidase)、-D-半乳糖糖苷酶(-D-galactosidase)等[11-12]。很多研究报道,非酿酒酵母胞外酶可水解葡萄果实中的风味前体物质并显著改善葡萄酒风味特性和香气典型性[12-15]。但目前国内外相关领域对于发酵过程中酵母胞外酶处理引起的香气物质生成规律的研究较少,优选非酿酒酵母胞外酶促进葡萄酒典型香气生成的化学机制尚不清楚。本试验以弱香型酿酒葡萄品种爱格丽为试材,在发酵过程中添加两株优选非酿酒酵母胞外酶液,并以商业杏仁-D-葡萄糖苷酶制剂为对照,研究发酵过程中重要香气物质的生成变化规律,以期进一步探究优选非酿酒酵母胞外酶处理促进干白葡萄酒典型香气生成的化学机制。研究结果以期为应用风味酶增香酿造葡萄酒的工艺革新提供理论和实践指导。
1 材料与方法
1.1 葡萄原料
爱格丽(Ecolly):白色欧亚种酿酒葡萄,由西北农林科技大学葡萄酒学院选育[16]。酿酒原料于2018年8月采自陕西杨凌官村葡萄基地,约260 kg,含糖量177 g/L,酸度4.2 g/L(以酒石酸计)。
1.2 酵母菌株
酿酒酵母():Actiflore F33活性干酵母,购于法国Laffort公司。
发酵毕赤酵母(,PF,Z9Y-3)与胶红酵母(,RM,BEI29):本实验室优选,根据该菌株在WL鉴别培养基上的菌落形态和显微细胞形态以及经26S rRNA D1/D2区域序列鉴定,确认其分别为发酵毕赤酵母和胶红酵母(序列相似度99%)。
1.3 化学试剂
分析纯化学试剂:酵母浸粉、蛋白胨、吐温80、琼脂、无水乙醇等主要购于四川西陇化工有限公司和天津市科密欧化学试剂有限公司。对硝基苯基--D-葡萄糖苷(NPG)、对硝基苯基--L-阿拉伯糖苷(NPA)、对硝基苯基--L-鼠李糖苷(NPR)、对硝基苯基--D-木糖苷(NPX)、对硝基苯基-D-半乳糖糖苷(NPG)购于Sigma-Aldrich公司。PEG20000透析袋(截流分子量:8000~14000 Da)购于北京Biotopped公司。0.45m水系微孔滤膜购于天津市津腾实验设备有限公司。
GC色谱纯化学试剂(纯度≥97%):二氯甲烷、戊烷、甲醇、乙酸乙酯、丁酸乙酯、异戊酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯、月桂酸乙酯、乙酸苯乙酯、水杨酸甲酯、异丁醇、1-己醇、异戊醇、异戊酸、辛酸、癸酸、苯甲醇、苯乙醇、苯甲醛、大马酮、香茅醇等香气物质标品购于Sigma-Aldrich公司。
酒样的糖苷提取分离使用固相萃取小柱Sep-pek C18购于美国Waters公司。
杏仁-葡萄糖苷酶制剂(20~40 U/mg),购于上海源叶生物科技有限公司。
1.4 试验方法
1.4.1 优选菌株胞外酶液的制备
酵母胞外酶液的制备方法参考Hu等[14]。将优选菌株接入发酵培养基中(20 g/L蛋白胨,20 g/L葡萄糖,3 g/L NH4NO3,4 g/L KH2PO4,0.5 g/L MgSO4·7H2O,10 mL/L吐温80和10 mg/L酵母浸粉),于28℃恒温培养箱中活化培养72 h。然后以10%接种量接入发酵培养基,于28 ℃、150 r/min条件下扩增培养72 h。随后,将发酵液低温离心(4 ℃,8 000 r/min,15 min)取上清液,经0.45m膜过滤后用PEG20000透析袋浓缩备用。
1.4.2 优选菌株胞外酶活力测定
采用pNPG法,参照Fia等[17]方法适当修改。取750L 0.1 mol/L柠檬酸-磷酸氢二钠缓冲液(pH值5.0)、200L酶液和250L浓度为1 mmol/L的对应糖苷(对硝基苯基--D-葡萄糖苷、对硝基苯基--L-阿拉伯糖苷、对硝基苯基--L-鼠李糖苷、对硝基苯基--D-半乳糖苷、对硝基苯基--D-木糖苷)于小试管中混匀,在40℃恒温水浴中反应30 min,加入1 mL浓度为1 mol/L碳酸钠溶液终止反应。酯酶活性的测定参考Pérez-Martín等[18]方法。将200L酶液、80L 25 mmol/L的对硝基苯基丁酸盐与1.72 mL 0.1 mol/L柠檬酸/磷酸盐缓冲液混匀,37℃反应60 min,加入0.2 mL 0.5 mol/L NaOH终止反应。于400 nm波长下测定吸光度,每样重复3次。最终酶活力值根据标准曲线(=17.696+0.0057,2=0.9997)计算得出。酶活单位(U)定义为:40℃条件下每分钟内催化生成1mol对硝基苯酚所需要的酶量。
1.4.3 香气糖苷提取
香气糖苷浸提制备方法参考文献Rodríguez等[19],略有改动。取100 mL酒样,40℃真空旋转蒸发去除乙醇及易挥发性物质,纯水定容至100 mL,添加10 g/L聚乙烯基吡咯烷酮(polyvinylpyrrolidone, PVPP)震荡摇匀20 min,除去色素等酚类物质,再于4℃,10 000 r/min条件下离心20 min。所得上清液用0.45m水系微孔滤膜过滤。糖苷纯化及水解方法参照Yang等[20],依次用二氯甲烷、甲醇、超纯水进行C18固相萃取小柱活化,取定量糖苷提取液,自然重力上样。糖苷洗脱:首先用超纯水过柱,去除糖、色素、高极性杂质物质;再用二氯甲烷/戊烷(1∶2)过柱,洗脱游离态香气成分;最后用甲醇/乙酸乙酯(1∶9)过柱,洗脱糖苷物质。糖苷洗脱后液氮吹干,获得糖苷样品。糖苷水解:将所得糖苷样品溶于10 mL pH值5.0的柠檬酸-磷酸缓冲溶液,加入5 U/mL杏仁-葡萄糖苷酶,于40℃恒温水浴中酶解16 h后进行顶空固相微萃取吸附。
1.4.4 葡萄酒酿造试验
爱格丽葡萄除梗、破碎后装入20 L玻璃罐中,4 ℃下低温浸渍24 h后压榨取汁,添加50 mg/L的SO2,而后添加1 g/L的膨润土下胶澄清,24 h后澄清汁接种4×106cells/mL酿酒酵母启动发酵,12 h后分别添加10 mU/mL(以-D-葡萄糖苷酶为标准)酵母胞外酶液和商业酶制剂[13],混合均匀。实时监测密度和温度,控制发酵温度16~20 ℃,每隔24 h采样进行香气成分分析,在发酵旺盛期添加蔗糖使最终酒精度达到11%±0.5%,添加酒石酸调整酸度到6.0 g/L,当还原糖含量低于2 g/L时,终止发酵,并将葡萄酒转入干净卫生的玻璃罐中4℃满罐密封贮藏。贮藏期间对葡萄酒进行3次转罐澄清并调整游离SO2浓度防止酒样氧化。次年4月对葡萄酒样品的香气成分进行气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)分析,并进行香气特征的感官评价。试验以不添加酶制剂的酿酒酵母纯发酵为空白对照(CK),以添加胶红酵母(RM)胞外酶、发酵毕赤酵母(PF)胞外酶和杏仁-D-葡萄糖苷酶制剂(AG)为处理组,每个处理重复2次。
1.4.5 GC-MS分析
葡萄酒香气物质采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)吸附,使用DVB/CAR/PDMS萃取纤维(50/30m涂层厚度,2 cm可伸缩长度)及SPME 57330-U联用手柄(美国Supelco公司)。15 mL顶空瓶中加入8 mL酒样或香气糖苷水解溶液,2.0 g NaCl,2-辛醇(内标,400g/L)和搅拌子,在40℃水浴中平衡15 min后,萃取纤维在40℃下搅拌吸附30 min,而后取出插入GC进样口,230℃解析5 min取出。每个酒样重复2次。
GC-MS分析条件:岛津GC/MS-QP2020,柱型号为DB-WAXETR(60 m×0.25 mm i.d.,涂层厚度0.25m,美国Agilent公司)。不分流进样,载气为高纯氦气(99.999%),流速1.5 mL/min。柱升温程序:40℃保持5 min,然后以2 ℃/min上升到130℃,再以5 ℃/min上升到220℃,保持10 min。进样口温度230℃,连接杆温度220℃,离子源温度200℃,电子源电压70 eV,质谱为电离轰击(EI)模式,全扫描质谱范围35~350 amu,扫描频率0.2 s/次。
定性定量方法:采用标准品保留时间对比、Wiley 275.L谱库查询和文献保留指数比对法进行化合物定性。采用内标-标准曲线法定量,2-辛醇为内标,具体定量方法参考Tao等[21]的方法。
1.4.6 感官分析
参照Tao等[22]的方法进行,品尝小组由20名葡萄酒专业的学生(10男,10女)组成,感官分析前对品尝小组进行为期一个月的葡萄酒标准香气物质闻香培训,直至小组成员对每个香气特征正确辨别的误差小于整体误差的5%。感官分析试验采用随机区组设计,要求品评员用标准香气特征中的3~4个特征词汇来描述葡萄酒的香气特征,并用“五点标度法”量化(1为弱;2为较弱;3为中等;4为较强;5为强)。香气特征的量化强度值(MF,%)为该特征词汇的使用频率(,%)和强度平均值(,%)的几何平均数,用如下公式计算:

1.4.7 统计分析
试验数据处理主要应用单因素方差分析(one-way analysis of variance,One-way ANOVA)、多重比较分析(multiple comparison analysis,MCA)和主成分分析(principal component analysis,PCA)的方法,使用SPSS 20.0(美国SPSS公司)进行分析,分别用于评价试验的重复性,不同处理间的差异性以及供试酒样中香气成分变化规律,常规图表的绘制采用Office 2013、Origin 9.5(美国OriginLab公司)进行,数据的基本统计分析采用Microsoft Excel 2013进行。
2 结果与分析
2.1 非酿酒酵母胞外酶活性分析
RM和PF胞外酶液中测得风味酶活性如表1所示,共测出6种酶活,同一风味酶活性在不同菌株之间存在差异。RM胞外酶的-D-葡萄糖苷酶活性(41.81 mU/mL)、-L-鼠李糖苷酶活性(18.79 mU/mL)、-D-木糖苷酶活性(15.19 mU/mL)均显著高于PF的(<0.05),而PF胞外酶的-L-阿拉伯糖苷酶活性(15.98 mU/mL)和酯酶活性(61.17 mU/mL)显著高于RM的(<0.05)。
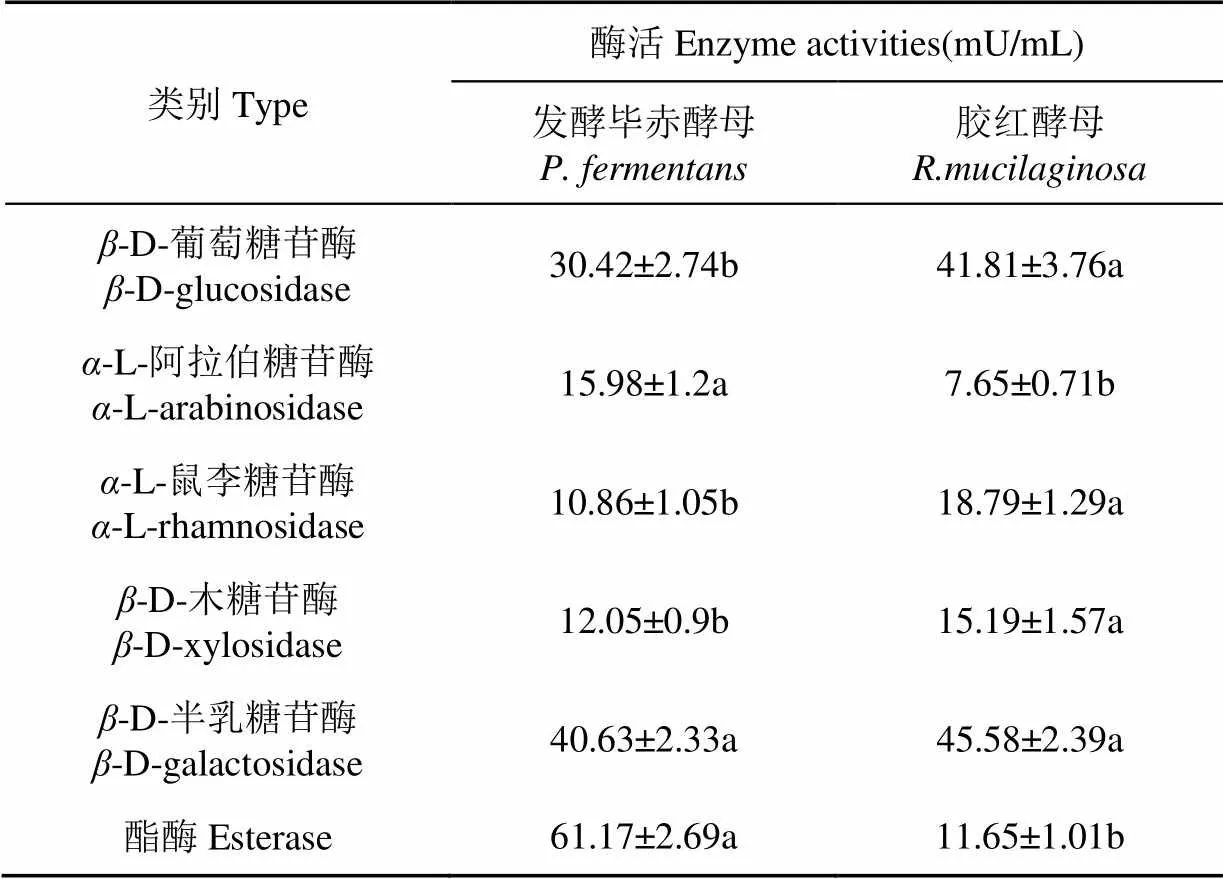
表1 胶红酵母和发酵毕赤酵母胞外酶液中的糖苷酶和酯酶活性
注:表中同一行数据后的不同字母表示处理间差异性显著(检验,< 0.05)
Note: Data followed by different letters in a row are significantly different (< 0.05) bytest
2.2 香气成分分析
2.2.1 发酵过程中关键香气成分的生成规律分析
图1所示为重要的葡萄酒品种香气物质(C6化合物和萜烯类物质)的发酵生成规律。由图可知,风味酶处理促进了品种香气物质的发酵生成,对应的结合态化合物含量随着其游离态的增加而减少,这表明了结合态香气物质在发酵过程中的水解与游离态香气化合物的生成有直接关联。值得注意的是,RM酶处理促进游离态萜烯类物质的生成效果显著优于其他处理(<0.05)。由于萜烯类物质是葡萄酒花香和甜果香的重要贡献者,所以非酿酒酵母胞外酶处理具有明确的增香功能。
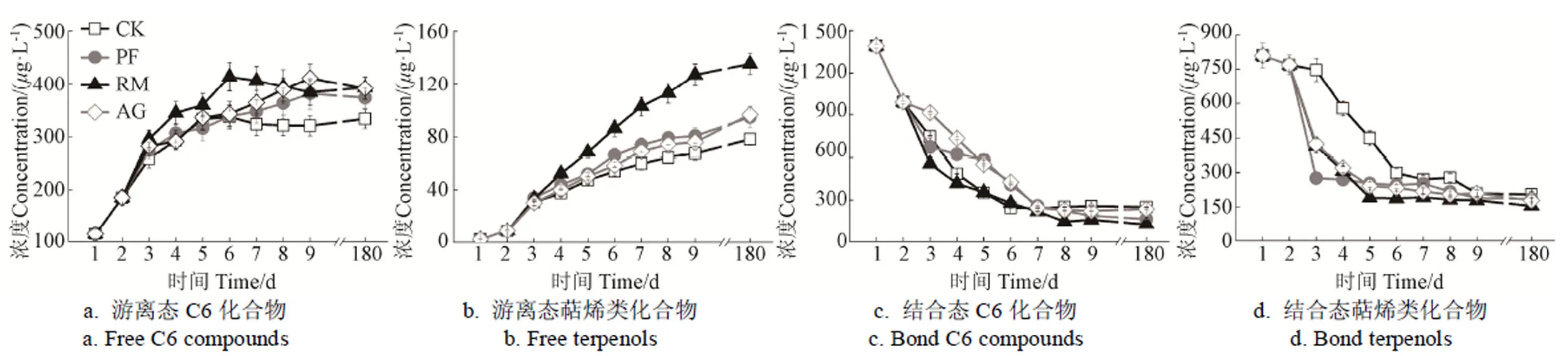
图1 主要品种香气化合物的生成规律
发酵香气成分的变化规律如图2所示。酿造过程中,高级醇含量整体上呈持续上升趋势,即随着发酵的进行,高级醇含量逐渐升高,发酵末期和储藏期含量趋于稳定。但不同于其他3组,PF酶液处理的酒样在贮藏阶段高级醇含量有所降低,这可能是由于高级醇参与酯类物质生成导致的。苯乙基类化合物含量在发酵过程中持续升高,且第1~4天为该化合物的高速增长期,不同处理酒样间苯乙基类化合物变化趋势相近。此外,脂肪酸含量变化趋势为发酵中期浓度达到最大值,随后持续降低直至次年4月。值得注意的是,相对于其他酒样而言,添加PF胞外酶的酒样中脂肪酸含量在发酵过程中变化更加激烈。对酯类物质的变化规律分析表明,乙酸酯含量最高,约为脂肪酸乙酯和其他酯类总量的3~4倍。在RM、AG和CK酒样中,乙酸酯变化趋势是先逐渐增加达到峰值基本保持稳定,而在PF酒样中则呈现出持续增长的趋势,即便在贮藏阶段,仍有小幅度乙酸酯类的累积。脂肪酸乙酯在发酵启动后的6~7 d达到峰值,随后其含量具有小幅度下降。另外,供试酒样中,其他酯类化合物呈现持续增长的趋势,这主要是由于乳酸乙酯和丁二酸二乙酯的生成在陈酿时期仍然较活跃。
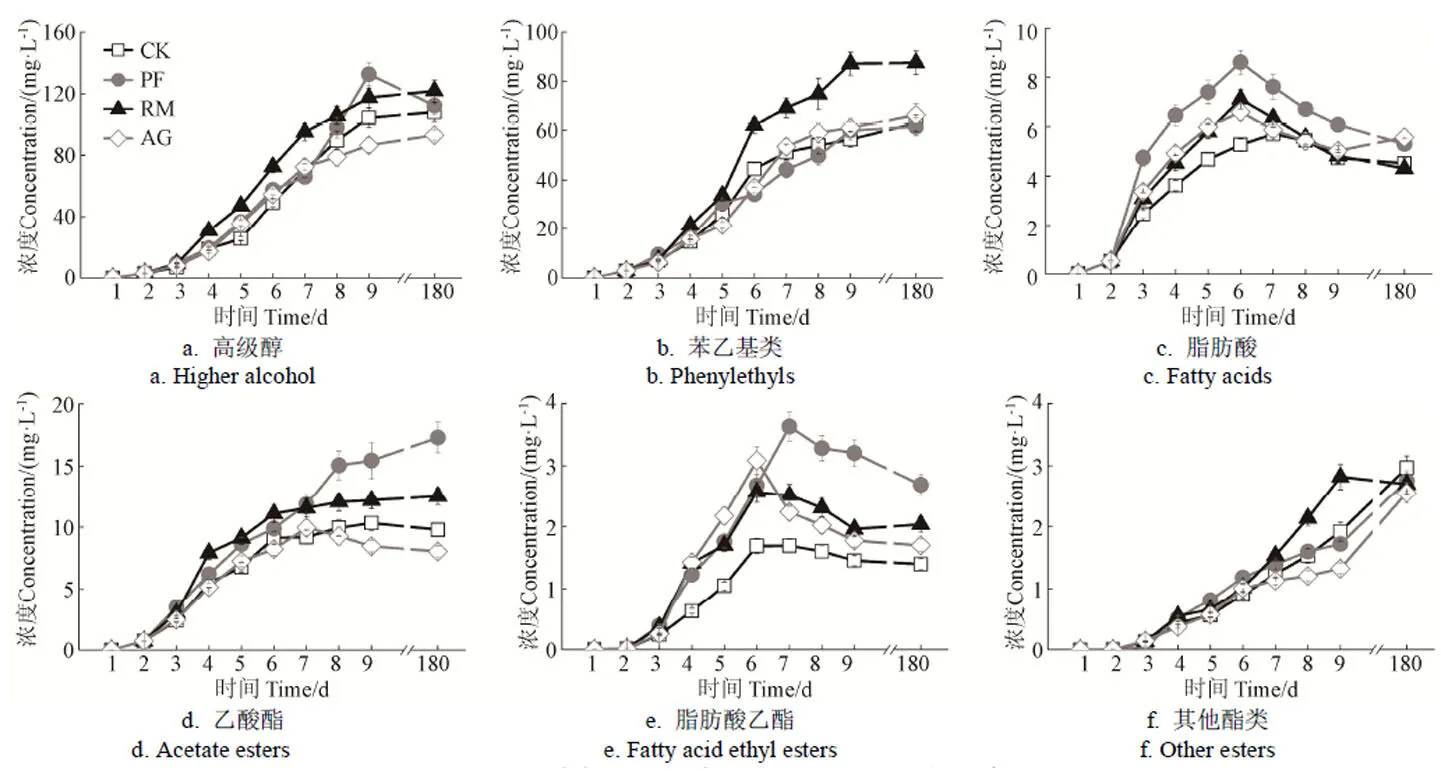
图2 酒样中主要发酵香气化合物的生成规律
2.2.2 不同处理酒样中的香气成分分析
供试酒样贮藏180 d后对香气成分进行定性定量分析,共检测出54种香气成分。其中,品种香气成分11种,包括C6化合物2种,萜烯类化合物5种,C13去甲类异戊二烯3种和酚酸酯1种;发酵香气成分43种,包括高级醇8种,乙酸酯5种,脂肪酸乙酯10种,其他酯类8种,脂肪酸7种和苯乙基类化合物5种。共有16种挥发性成分的含量超过其嗅觉阈值,即气味活性值(OAV, odor activity value)大于1,13种OAV在0.1~1之间。OAV大于0.1的潜在气味活性成分及其含量如表2所示。
分析可见,与对照组相比RM胞外酶液处理有促进爱格丽葡萄酒品种香气成分释放的作用。从品种香气化合物总含量变化上来看,RM酶处理对品种香气物质总量的提升效果显著。具体而言,RM酶液对C13去甲类异戊二烯含量有显著提升作用。此外,尽管非酿酒酵母胞外酶和商业杏仁-D-葡萄糖苷酶处理均能促进萜烯类物质的释放,但RM酶处理的酒样中萜烯类化合物含量显著高于其他3组,其作用效果比商业酶处理组高41.7%,这一增量主要归功于RM酒样中具有含量较高的橙花醇氧化物(40g/L)。另一方面,非酿酒酵母胞外酶对发酵香气成分的生成也有显著影响。由表2可知,非酿酒酵母胞外酶处理均可提升酒中高级醇含量,这一作用是商业杏仁-D-葡萄糖苷酶不能替代的,其中RM胞外酶对高级醇含量的提升作用显著(<0.05)。本试验共检测出游离态苯乙基类化合物5种,含量约占发酵香气总量的1/3,是发酵产物中含量仅次于高级醇的一类香气物质。其中,RM胞外酶处理酒样中的苯乙基类化合物含量显著(<0.05)高于其他3组,与商业酶处理组相比,其作用效果高31.8%。此外,在贮藏180 d后,PF胞外酶液处理的酒样中脂肪酸含量高于对照组,但低于AG处理。值得注意的是,不同于RM胞外酶促进品种香气及其他发酵香气产生方面表现出的优势,PF胞外酶在促进乙酸酯类和脂肪酸乙酯类生成方面有突出贡献,尤其是对于乙酸异丁酯、乙酸异戊酯、丁酸乙酯等的含量有显著(<0.05)的提升作用。
2.3 葡萄酒香气特征与气味成分的关联分析
图3所示是感官分析得出的供试酒样中5种典型的香气特征。与对照相比,非酿酒酵母胞外酶处理显著(<0.05)提升了爱格丽干白葡萄酒中的柑橘、温带酸果和花香特征。其中,PF酶处理酒样中柑橘类香气(MF=68.98%)强于RM酶处理,而RM酒样中温带酸果类香气(59.74%)显著高于PF酒样的。此外,尽管酶处理也提升了热带水果的香气强度,但处理间差异不显著;酶处理具有降低供试酒样生青类香气的作用。

表2 酒样中的潜在气味活性物质
注:CK:对照;PF:发酵毕赤酵母胞外酶处理;RM:胶红酵母胞外酶处理;AG:商业杏仁-D-葡萄糖苷酶制剂处理;表中同一行数据后的不同字母表示处理间差异性显著(Duncan检验,< 0.05);OAV(气味活性值)=香气化合物浓度/该香气化合物气味阈值;ND:没有检测到;香气阈值参考文献:A(Peng等)[4];B(Guth等)[23];C(Simpson等)[24];D(Maavse等)[25];E(Tao等)[22];F(Crandles等)[26];G(Wang等)[12]
Note: CK: control group; PF: treated with extracellular enzyme from; RM: treated with extracellular enzyme from; AG: treated with commercial glycosidase; Data followed by different letters in a row are significantly different (< 0.05) by Duncan test; OAV (odor activity value) equals the ratio of the aroma compound concentration to its odor threshold; ND: Not detected; Odor threshold reference:A (Peng et al.)[4]; B (Guth et al.)[23]; C (Simpson et al.)[24]; D (Maavse et al.)[25]; E (Tao et al.)[22]; F (Crandles et al.)[26]; G (Wang et al.)[12]

注:*表示处理间差异性显著(Duncan检验,P < 0.05)。
通过主成分分析揭示供试酒样香气特征与香气成分之间的关联,分析结果见图4。由图可见,前两个主成分分别占数据总体方差的47.74%和30.50%,萜烯类、C13去甲类异戊二烯、苯乙基类化合物、高级醇、乙酸酯、脂肪酸乙酯、柑橘类、温带酸果和RM酶处理酒样主要分布于第一象限,而C6化合物、脂肪酸、花香、热带水果特征分布在第四象限,PF与AG酶处理酒样分别处于第二主成分的正、负两端,而CK酒样在第一主成分的负向端。分析可得,PF酶处理有利于高级醇、乙酸酯、脂肪酸乙酯,柑橘类香气特征增加,而RM酶处理对酚酸酯、C13去甲类异戊二烯、苯乙基类、萜烯类化合物的生成促进作用最大,酒样的温带酸果、热带水果、花香特征最好。
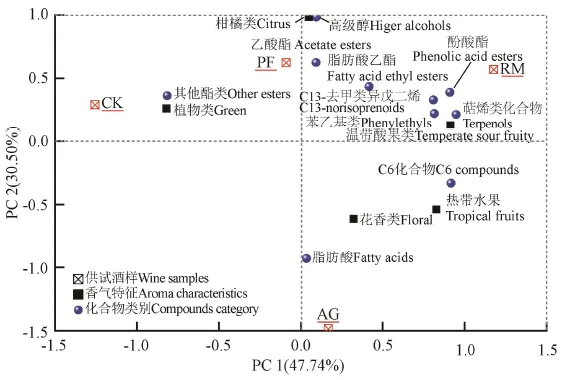
图4 前两个主成分上葡萄酒香气指标的载荷及酒样的分布
3 讨 论
来源于葡萄中的品种香气成分对葡萄酒典型香气特征的表现具有重要的影响,它们常常以结合态前体物质的形式存在。发酵过程中,酵母菌生长代谢活动产生的糖苷酶是水解释放游离态香气苷元反应的主要催化剂[27]。Lopez等[28]研究表明,毕赤酵母属具有较高的D-葡萄糖苷酶和D-木糖苷酶活性,并能在酿造过程中有效增加萜烯类香气的含量。本研究供试非酿酒酵母菌株是根据产D-葡萄糖苷酶的活性筛选的发酵毕赤酵母和胶红酵母,其胞外酶中共测有5种风味糖苷酶活性,其中D-葡萄糖苷酶和D-半乳糖苷酶活性较高。研究发现,糖苷酶的活性受到还原糖含量的影响,较高的糖含量对糖苷酶活力具有抑制作用[29]。在本研究中,品种香气的含量变化差异主要表现在启动发酵后的第2天,这可能是由于非酿酒酵母胞外酶也受到还原糖含量的影响,其水解作用在还原糖含量降低时得以发挥。在非酿酒酵母胞外酶的作用下,葡萄果实中的结合态品种香气前体物质转化为C6化合物、萜烯类、C13-去甲类异戊二烯类、酚酸酯类等多种游离态品种香气成分。其中,C6化合物与葡萄酒生青类香气有关,主要来源于长链不饱和脂肪酸和香气糖苷前体物质的降解[30]。Wang等[12]在胶红酵母和酿酒酵母混菌发酵的爱格丽葡萄酒中检出的C6化合物含量占品种香气物质总量的一半以上,并发现适当比例的胶红酵母在混合发酵中能提升葡萄酒中C6化合物的含量,这与本研究采用其胞外酶处理的结果一致。萜烯类化合物,如里那醇(linalool)、-萜品醇(-terpineol)等对呈现葡萄酒花香、甜果香有积极作用[30]。Cabaroglu等[5]发现添加外源糖苷酶能够促进萜烯类香气糖苷的水解并释放更多香气活性成分,与先前研究结果相同,本研究中非酿酒酵母胞外酶液显著促进了游离态萜烯类香气成分的生成,尤其是RM酶处理。
除此之外,发酵过程中产生的挥发性成分也对葡萄酒的香气表现具有重要的调整作用。有研究表明,高级醇含量受发酵条件、成分和葡萄品种等因素的影响[30],过高含量的高级醇会降低酒中的新鲜水果香气,使未陈酿的红葡萄酒中表现出蔬菜和青椒味[31-32],从而导致酒的香气质量下降。本研究中,高级醇是所有发酵香气物质中含量最多的香气物质,约占发酵香气总含量的55%,酶处理酒样中高级醇虽有升高,但总体含量未对香气质量产生负面影响,葡萄酒具有优雅的醇香和花香。酵母细胞通过Ehrlich代谢途径分解氨基酸,产生高级醇[33]。本试验中PF和RM酶液分别对异丁醇和异戊醇的含量提升最多,可能与供试非酿酒酵母菌株的胞外酶促进了酵母对缬氨酸和亮氨酸的分解代谢能力有关。脂肪酸参与酯类物质生成的动态平衡反应,它是合成酯类风味化合物不可或缺的前体物质[34],其含量对于新鲜水果香气特征的感知至关重要[31]。本研究中,脂肪酸在酒精发酵过程中整体变化趋势是先增高后减少,其变化幅度在RM酶和PF酶处理的酒样更加剧烈,推测这可能是胞外酶处理促进了酵母脂肪酸的代谢生成,过多的脂肪酸进一步转化生成脂肪酸乙酯造成的。前人研究报道了辛酸通过促进EHT1和EEB1基因表达进而提高酯酶活性[35],但酯酶活性对脂肪酸含量的影响尚待进一步研究。Renault等[36]报道了葡萄酒中的果香复杂性与非酿酒酵母在发酵过程中产生的酯类物质密切相关。非酿酒酵母在参与葡萄酒酿造过程中也产生酯酶[37],其中酯酶活性与维持酯类合成和水解平衡的酯类化合物含量密切相关[38]。Ma等[39]分析比较了发酵毕赤酵母与酿酒酵母的酯酶活力,结果表明发酵毕赤酵母比酿酒酵母具有更强的酯酶活性。本研究酵母胞外酶的酶活分析结果印证了先前的研究结果,PF酶处理对于提高乙酸酯和脂肪酸乙酯含量具有明显的优势,这可能与发酵毕赤酵母胞外酶中酯酶活性显著高于胶红酵母胞外酶中的酯酶活性有关。随着酿酒工艺技术的发展和市场对果香型葡萄酒产品的需求增加,优选非酿酒酵母越来越受到研究人员和酿酒师的关注。研究发现,优选非酿酒酵母与酿酒酵母的混合发酵可以有效增加葡萄酒中的酯类物质含量,从而增加葡萄酒的果香特征。但非酿酒酵母参与的混菌发酵增香的同时,也具有产生杂味的风险[8,40]。本研究应用非酿酒酵母胞外酶液进行葡萄酒的增香酿造,有效避免了非酿酒酵母过多的生物代谢产生的负面风味,探索了其促进葡萄酒香气生成的化学机制。
4 结 论
本试验在非酿酒酵母参与的葡萄酒混菌发酵具有明显的增香酿造效果的基础上,进一步探究了非酿酒酵母胞外酶处理对干白葡萄酒中香气成分生成的调控机制。胶红酵母和发酵毕赤酵母的胞外酶液中均可检测到-D-葡萄糖苷酶、-L-阿拉伯糖苷酶、-L-鼠李糖苷酶、-D-半乳糖苷酶、-D-木糖苷酶和酯酶,酶活在不同菌株之间存在差异。胞外酶处理显著提升了葡萄酒的香气质量,尤其是花香特征和温带酸果类香气。其中发酵毕赤酵母胞外酶对大多数发酵香气化合物的生成有积极影响,而胶红酵母胞外酶能显著(<0.05)促进高级醇、苯乙基类化合物、乙酸酯、脂肪酸乙酯生成,两株非酿酒酵母胞外酶均能提升品种香气成分(游离态C6化合物、萜烯类物质)的含量。总的来看,酿造过程中添加非酿酒酵母胞外酶能够改善干白葡萄酒香气,所酿酒具有较好的果香和花香。本研究结果可以为优选非酿酒酵母胞外酶应用于葡萄酒增香酿造提供理论和实践指导。
[1]Sánche E, Alonso R, González M A, et al. Characterisation of free and glycosidically bound aroma compounds of La Mancha Verdejo white wines[J]. Food Chemistry, 2015, 173: 1195-1202.
[2]Palomo E S, Gonzalez-Vinas M A, Perezcoello M S, et al. Aroma potential of Albillo wines and effect of skin-contact treatment[J]. Food Chemistry, 2007, 103(2): 631-640.
[3]Parenti A, Spugnoli P, Gori C, et al. Effects of cold maceration on red wine quality from Tuscan Sangiovese grape[J]. European Food Research and Technology, 2004, 218(4); 360-366.
[4]Peng C T, Wen Y, Tao Y S, et al. Modulating the formation ofwine aroma by prefermentative freezing process[J]. Journal of Agricultural and Food Chemistry, 2013, 61(7): 1542-1553.
[5]Cabaroglu T, Selli S, Canbas A. Wine flavor enhancement through the use of exogenous fungal glycosidases[J]. Enzyme and Microbial Technology, 2003, 33: 581-587.
[6]王倩倩,覃杰,马得草,等. 优选发酵毕赤酵母与酿酒酵母混合发酵增香酿造爱格丽干白葡萄酒[J]. 中国农业科学,2018,51(11):2178-2192. Wang Qianqian, Qin Jie, Ma Decao, et al. Aroma enhancement of Ecolly dry white wine by co-inoculation of selectedand[J]. Scientia Agricultura Sinica, 2018, 51(11): 2178-2192. (in Chinese with English abstract)
[7]Loira I, Morata A, Suarezlepe J A, et al. Use ofandstrains in mixed and sequential fermentations to improve red wine sensory quality[J]. Food Research International, 2015, 76: 325-333.
[8]Comitini F, Gobbi M, Ciani M, et al. Selected non-wine yeasts in controlled multistarter fermentations with[J]. Food Microbiology, 2011, 28(5): 873-882.
[9]Medina K, Boido E, Carrau F, et al. Increased flavour diversity of Chardonnay wines by spontaneous fermentation and co-fermentation with[J]. Food Chemistry, 2013, 141(3): 2513-2521.
[10]Hu K, Jin G J, Tao Y S, et al. Wine aroma response to different participation of selectedin mixed fermentation with[J]. Food Research International, 2018, 108: 119-127.
[11]Jolly N P, Varela C, Pretorius I S. Not your ordinary yeast: Non-yeasts in wine production uncovered[J]. Fems Yeast Research, 2014, 14(2): 215-237.
[12]Wang X C, Li A H, Tao Y S, et al. Evaluation of aroma enhancement for “Ecolly” dry white wines by mixed inoculation of selectedand[J]. Food Chemistry, 2017, 228: 550-559.
[13]Hu K, Qin Y, Tao Y S, et al. Potential of glycosidase from non-isolates for enhancement of wine aroma[J]. Journal of Food Science, 2016, 814: 935-943.
[14]Hu K, Zhu X L, Tao Y S, et al. A novel extracellular glycosidase activity from: Its application potential in wine aroma enhancement[J]. Letters in Applied Microbiology, 2016. 62(2): 169-176.
[15]朱晓琳. 糖苷酶处理葡萄酒酿造过程中香气物质的动态变化研究[D]. 杨凌:西北农林科技大学,2017. Zhu Xiaolin. Evolution of Aroma Compounds During Winemaking Process Through the Treatment With Glycosidases[D]. Yangling:Northwest A&F University, 2017. (in Chinese with English abstract)
[16]李华,张振文,王华,等. 葡萄新品种:爱格丽[J]. 园艺学报,2000(1):75. Li Hua, Zhang Zhenwen, Wang Hua, et al. A new grape variety-Ecolly[J]. Acta Horticulturae Sinica, 2000(1): 75. (in Chinese with English abstract)
[17]Fia G, Canuti V, Rosi I. Evaluation of potential side activities of commercial enzyme preparations used in winemaking[J]. International Journal of Food Science and Technology, 2014, 49(8): 1902-1911.
[18]Pérez-Martín F, Seseña S, Izquierdo P M, et al. Esterase activity of lactic acid bacteria isolated from malolactic fermentation of red wines[J]. International Journal of Food Microbiology, 2013, 163(2), 153–158
[19]Rodríguez J J, Cabrera H M, Pérez J P, et al. Bound aroma compounds of gual and listán blanco grape varieties and their influence in the elaborated wines[J]. Food Chemistry, 2011, 127(3): 1153-62.
[20]Yang Y, Jin G J, Tao Y S, et al. Chemical profiles and aroma contribution of terpene compounds in Meili (L.) grape and wine[J]. Food Chemistry, 2019, 284: 155-161.
[21]Tao Y S, Li H, Wang H. Volatile compounds of young Cabernet Sauvignon red wine from Changli County (China) [J]. Journal of Food Composition and Analysis, 2008, 21(8): 689-694.
[22]Tao Y S, Liu Y Q, Li H. Sensory characters of Cabernet Sauvignon dry red wine from Changli County (China)[J]. Food Chemistry, 2009, 114(2): 565-569.
[23]Guth H. Quantitation and sensory studies of character impact odorants of different white wine varieties[J]. Journal of Agricultural and Food Chemistry, 1997, 45(8): 3027-3032.
[24]Simpson R, Mille G. Aroma composition of aged Riesling wine[J]. Vitis, 1983, 22(1): 51-63.
[25]Maarse H. Volatile compounds in foods and beverages[M].Oxfordshire: Taylor and Francis, 2017.
[26]Crandles M, Reynolds A G, Khairallah R, et al. The effect of yeast strain on odor active compounds in Riesling and Vidal blanc icewines[J]. LWT - Food Science and Technology, 2015, 64(1): 243-258.
[27]Hernández L F, Espinosa J C, Fernández-González M, et al. Betaglucosidase activity in awine strain[J]. International Journal of Food Microbiology, 2003, 80(2): 171-176.
[28]Lopez M C, Mateo J J, Maicas S. Screening of-glucosidase and-xylosidase activities in four non-yeast isolates[J]. Journal of Food Science, 2015, 80(8): 1696-1704.
[29]Madrigal T, Maicas S, Tolosa J J M. Glucose and ethanol tolerant enzymes produced byisolates from enological ecosystems[J]. American Journal of Enology and Viticulture, 2013, 64: 126-133.
[30]Moreno-Arribas M V,Polo M C. Wine Chemistry and Biochemistry[M]New York: Springer Science Business Media, 2009.
[31]San-Juan F, Ferreira V, Cacho J, et al. Quality and aromatic sensory descriptors (mainly fresh and dry fruit character) of Spanish red wines can be predicted from their aroma-active chemical composition[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 7916-7924.
[32]Cameleyre M, Lytra G, Tempere S, et al. Olfactory impact of higher alcohols on red wine fruity ester aroma expression in model solution[J]. Journal of Agricultural and Food Chemistry, 2015, 63(44): 9777-9788.
[33]Anthony L R, Paul K B, Peter S S, et al. Origins of grape and wine aroma. part 1. chemical components and viticultural impacts[J]. American Journal of Enology and Viticulture, 2014, 65: 1-24.
[34]Perestrelo R, Fernandes A, Albuquerque F F, et al. Analytical characterization of the aroma ofred wine: Identification of the main odorants compounds[J]. Analytical Chimistry Acta, 2006, 563(2): 154-164.
[35]Saerens S M G, Delvaux F, Verstrepen K J, et al. Parameters affecting ethyl ester production byduring fermentation[J]. Applied and Environmental Microbiology, 2008, 74: 454-461.
[36]Renault P, Coulon J, De R G, et al. Increase of fruity aroma during mixedwine fermentation is linked to specific esters enhancement[J]. International Journal of Food Microbiology, 2015, 207: 40-48.
[37]Bağder S, Özçelik F. Effects of non-yeasts on wine aroma[J]. GIDA - Journal of Food, 2009, 34(4): 239-244.
[38]Sumby K M, Grbin P, Jiranek V. Microbial modulation of aromatic esters in wine: Current knowledge and future prospects[J]. Food Chemistry, 2010, 121(1): 1-16.
[39]Ma D C, Yan X, Wang Q Q, et al. Performance of selectedand its excellular enzyme in co-inoculation withfor wine aroma enhancement[J]. LWT-Food Science and Technology, 2017, 86: 361-370.
[40]Mateo J, Maicas S. Application of non-saccharomyces yeasts to wine-making process[J]. Fermentation, 2016, 2(3): 14-26.
Effect of aroma enhancement for dry white wine by selected non-extracellular enzymes
Yin Jian1, Tao Yongsheng1,2※, Sun Weixuan1, Chen Siyu1
(1.,,712100,; 2.,712100,)
Aroma compounds are mainly produced during brewing, which is involved various yeast flavor enzymes. The potential application of yeast flavoring enzyme in brewing was evaluated through the study on the aroma enhancement of dry white wine treated by extracellular enzymes from two non-strains. Ecolly grape is a kind of white variety with weak flavor. It was used as wine making material in experiment, and the grape juice was fermented by commercialstrain. After 12 hours, the extracellular enzymes from selected(PF) and(RM) strains were added (10 mU/mL), as well as the commercial almond-glucosidase (AG). The pure fermentation ofwithout enzyme treatment was used as the control. During the fermentation, the juice was sampled every 24 h to detect sugar content and aroma compounds. Volatile compounds were extracted by headspace solid-phase microextraction (HS-SPME), and then were desorbed and detected by gas chromatography coupled with mass spectrometry (GC-MS). Grape juice alcohol fermentation was completed when the residue sugar was less than 2 g/L, and the clear wine was racked to a clean bottle and stored at low temperature. In April of the next year, wine aroma compounds of wine were identified and quantified by HS-SPME-GC-MS, and aroma characteristics were analyzed and quantified by well-trained panelists. Results showed that six flavor enzyme activities were detected in both PF and RM extracellular enzymes. The activities of-D-glucosidase,-L-rhamosidase, and-D-xylosidase in RM enzymes were significantly higher than those in PF enzymes (< 0.05), while the activities of-L-arabinosidase and esterases in PF enzymes were significantly higher than those in RM enzymes (< 0.05). In general, both the treatments of PF and RM extracellular enzymes improved the contents of varietal and fermentative volatiles during fermentation significantly (< 0.05). Compared with AG treatment, the concentration of terpenes and phenylethyls increased by 41.7% and 31.8%, respectively. Furthermore, the production of most fermentative volatiles was promoted by PF enzymes, particularly fatty acid ethyl esters. The content of fatty acids ethyl esters in PF treatment was almost twice as much as that in the control. It is worth to be noted that the effect of aroma enhancement for dry white wine was different between PF and RM enzymes treatments according to sensory analysis results. Two kinds of extracellular enzymes of non-showed their respective advantages in aroma improvement. RM enzymes enhanced temperate sour fruits aroma type, while citrus attribute was strengthened by PF enzymes. In summary, the treatment of two sample non-extracellular enzymes had the clear aroma enhancement effect for dry white wine. The selected PF and RM extracellular enzymes had different flavor enzymes profiles, then their enzymes treatments during wine alcohol fermentation would bring out different improvements of varietal and fermentative aroma compounds. This results led to the different effects of aroma enhancement for dry white wine. This work would give the theoretical and practical guidance to the wine making for aroma enhancement by yeast flavor enzymes.
enzymes; fermentation; wine; non-; extracellular enzyme; aroma enhancement; aroma compound
尹 荐,陶永胜,孙玮璇,陈思雨. 优选非酿酒酵母胞外酶增香酿造干白葡萄酒效果[J]. 农业工程学报,2020,36(4):278-286. doi:10.11975/j.issn.1002-6819.2020.04.033 http://www.tcsae.org
Yin Jian, Tao Yongsheng, Sun Weixuan, Chen Siyu. Effect of aroma enhancement for dry white wine by selected non-extracellular enzymes[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(4): 278-286. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.04.033 http://www.tcsae.org
2019-10-28
2019-12-13
国家自然科学基金面上项目(31771966);科技部发展改革专项(106001000000150012);新疆建设兵团重点科技攻关计划(2019AB025)
尹 荐,主要进行葡萄酒、果酒酿造学研究。Email:yinj983001@163.com
陶永胜,博士,教授,主要进行葡萄酒酿造与风味化学研究。Email:taoyongsheng@nwafu.edu.cn
10.11975/j.issn.1002-6819.2020.04.033
TS262.6
A
1002-6819(2020)-04-0278-09

