基于血流动力学的大脑中动脉分叉处与侧壁动脉瘤破裂风险研究
施昭 胡斌 徐文达 王若冰 张晓倩 张敏 张龙江
近年来,未破裂颅内动脉瘤的检出率逐年提高,我国35~75 岁普通人群未破裂颅内动脉瘤的发生率为7%[1]。颅内动脉瘤破裂风险低,自发性蛛网膜下腔出血(subarachnoid hemorrhage, SAH)是颅内动脉瘤最常见的严重后果, 其致残率和致死率可达25%~50%[2-3]。 关于未破裂颅内动脉瘤的临床决策一直存在争议[4]。 鉴于此,识别颅内动脉瘤破裂相关特征以辅助临床管理具有重要意义。
大脑中动脉瘤(middle cerebral artery aneurysm,MCAA)是一种常见的颅内动脉瘤[5],多生长于动脉血管的分叉和侧壁处, 分叉处是其最常见的破裂部位[6]。 已有研究[7]表明颅内动脉分叉处是预测动脉瘤破裂状态的独立危险因素, 然而不同部位动脉瘤的破裂风险不同[8-9],目前尚缺乏针对大脑中动脉分叉处和侧壁动脉瘤不同破裂风险的研究。 计算流体力学(computational fluid dynamics,CFD)研究综合了形态学和血流动力学参数,揭示了血流、炎症、内皮细胞损伤与动脉瘤形成、破裂之间的关系[10],在理解及预测颅内动脉瘤破裂风险中起着重要作用,因此结合血流动力学,探索大脑中动脉分叉/侧壁部位的不同血流动力学作用从而预测MCAA 破裂风险具有重要意义。 以往的纵向研究中, 一旦识别到动脉瘤的形态或者大小发生变化,则该动脉瘤即被处理,从而导致了此类随访研究的极大偏倚[11]。目前,越来越多的研究在尝试应用识别破裂/未破裂颅内动脉瘤相关特征的横断面研究来评估未破裂颅内动脉瘤破裂风险[12-13]。 本研究旨在通过病例特异性的CFD模拟的方法,探索与MCAA 破裂相关的临床、形态学(如分叉/侧壁)和血流动力学参数,并分别分析大脑中动脉分叉/侧壁动脉瘤破裂相关的血流动力学特征。
1 资料与方法
1.1 一般资料 回顾性纳入2010 年1 月—2016 年12 月期间于南京大学医学院附属金陵医院因可疑颅内动脉瘤或其他脑血管疾病行头颅CT 血管成像(CTA)检查且经颅内血管造影(DSA)或手术确诊的MCAA 病人。 排除标准:①梭形、夹层和血栓性颅内动脉瘤;②临床或影像信息不全;③CTA 影像质量差或CFD 模拟失败;④多发动脉瘤。 最终纳入MCAA 病人193 例,其中动脉瘤未破裂组24 例,年龄46~78 岁,平均(58.5±8.5)岁,男9 例(9/24,37.5%),动脉瘤平均直径(6.4±3.2) mm,侧壁动脉瘤8 例(8/24,33.3%);动脉瘤破裂组169 例,年龄18~82 岁,平均(54.9±10.3)岁,男89 例(89/169,52.7%),动脉瘤中位直径5.2(4.1,6.7) mm,侧壁动脉瘤23 例(23/169,13.6%)。
1.2 设备与方法 采用西门子Somatom Definition或Definition Flash 双源CT 进行头颅CTA 检查。 平扫CT 后行增强CTA 检查,扫描参数:管电压120 kV,参考管电流140~180 mA,准直器宽度64×0.6 mm 或64×2×0.6 mm,旋转时间0.5 s/r,螺距1.2。 采用非离子型对比剂碘普罗胺 (优维显, 拜耳先灵医药公司;含碘300 mg/mL),经静脉注射60 mL,注射流率为4.0 mL/s。 采用团注示踪技术触发CT 扫描,将兴趣区(ROI)放置在颈内动脉(internal carotid artery,ICA)中,当颈内动脉近段CT 值达到100 HU 阈值3 s 后开始图像采集,采集时间3~4 s。
1.3 数据分析
1.3.1 临床信息与动脉瘤特征 记录2 组病人临床资料,包括年龄、性别、SAH 家族史、高血压、糖尿病、缺血性卒中、冠心病、饮酒史和吸烟史。 动脉瘤形态学特征包括最大直径(mm)、形状(规则/不规则)、子囊(动脉瘤壁不规则突起)、位置(分叉/侧壁)及动脉瘤破裂状态(根据CT 平扫上的颅内出血模式或者DSA 术中,或颅脑外科手术时观测的出血状况确定)。
1.3.2 CFD 分析 根据既往研究[14]设计CFD 分析过程, 包括: ①2D 横断面DICOM 图像导入软件ANSYS(版本15.0,ANSYS Inc.)中进行动脉瘤瘤体和载瘤动脉的分割和重建;②使用软件Fluent(版本15.0,ANSYS Inc.)进行非稳态CFD 模拟,该软件使用有限元体积法来计算Navier-Stokes 方程。
1.3.3 血流动力学参数 纳入11 个定量血流动力学参数和4 个定性因素。 定量参数包括压力(pressure,P)、壁剪切应力(wall shear stress, WSS)、平均WSS 绝对值(averaged WSS-absolute,AWSS-ABS)、平均WSS 均值(averaged WSS-mean,AWSS-MEAN)、壁切应力梯度(WSS gradient, WSSG)、平均WSS 梯度(averaged WSS gradient, AWSSG)、振荡剪切指数(oscillatory shear index,OSI)、相对停留时间(relative residence time,RRT)、动脉瘤形成指数(apeurysm formation index,AFI)、梯 度 振 荡 数(gradient oscillatory number,GON)和参数G,所有参数值均来自心脏收缩末期。 将变异系数(coefficient of variation,CV)作为描述颅内动脉瘤的血流动力学参数,即PCV、AWSSMEANCV、WSSCV、AWSS-ABSCV、OSICV、RRTCV、WSSGCV、AWSSGCV、AFICV、GONCV及GCV。 定性因素指血流模式,包括血流复杂程度、血流稳定程度、入射血流集中程度和血流冲击区域大小。图1 展示了典型的分叉处和侧壁MCAA 血流的不同模式。
1.4 统计学分析 采用SPSS 23.0 统计软件进行数据分析。 采用Kolmogorov-Smirnov 检验评估计量资料的正态性。 正态分布的数据以均数±标准差(x±s)表示,非正态分布的数据则以M(P25,P75)表示。 2 组间正态分布的数据采用独立样本t 检验进行比较;非正态分布数据则采用Mann-Whitney U 检验。 计数资料如性别、SAH 家族史、位置(分叉/侧壁)、定性血流动力学参数等以例(%)表示,2 组间比较采用χ2检验或Fisher 精确检验。单变量分析中P<0.05 的参数进行Logistic 回归分析。 采用方差膨胀因子(variance inflation factor,VIF) 判断两个变量之间是否线性相关。 P<0.05 表示差异有统计学意义。
2 结果
2.1 2 组MCAA 病人的临床资料、动脉瘤形态及血流动力学参数比较 2 组MCAA 病人的临床资料差异无统计学意义(见表1,均P>0.05)。动脉瘤形态学特征的比较显示, 破裂组动脉瘤与未破裂组相比较少分布于侧壁(见表2,P<0.05),多位于大脑中动脉分叉处。 破裂组血流模式复杂、集中,血流冲击区域小且不稳定(见表3,均P<0.05);破裂组动脉瘤OSICV也更低(见表4,P<0.05)。 2 组间的其余血流动力学参数差异无统计学意义(见表4,P>0.05)。

图1 分叉/侧壁处MCAA 不同的血流模式。 A 图为侧壁未破裂MCAA,从左向右依次显示动脉瘤内简单、分散血流模式,冲击区域大且稳定。B 图为分叉处破裂MCAA,从左向右依次显示动脉瘤内复杂、集中血流模式,冲击区域小且不稳定。
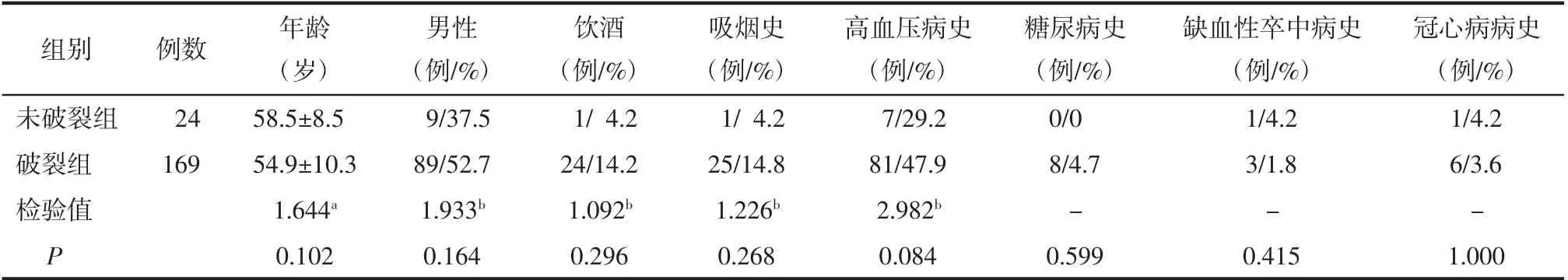
表1 2 组MCAA 病人临床资料比较

表2 2 组MCAA 肿瘤形态特征比较

表3 2 组MCAA 血流模式比较
2.2 MCAA 破裂状态的Logistic 回归分析 单因素Logistic 回归分析结果表明动脉瘤部位(分叉/侧壁)、血流复杂程度、血流集中程度、血流冲击区域大小、血流稳定性及OSICV具有统计学意义(均P<0.05)。进一步将以上参数纳入到多因素Logistic 回归分析中,结果显示复杂的血流模式、血流冲击面积小及小的OSICV是MCAA 破裂状态预测的独立风险因素(均P<0.05),均与MCAA 的破裂有关(见表5)。 对部位(分叉和侧壁)与血流动力学因素进行多重共线性分析结果显示,MCAA 部位与血流复杂、 血流集中、血流冲击小、血流不稳定之间存在明显共线性,VIF 分别为11.8、23.3、23.0 和11.5(均VIF>10);而与OSICV无明显共线性(VIF=8.4)。
2.3 分叉/侧壁处MCAA 的破裂相关的血流动力学特征分析 比较分叉/侧壁处动脉瘤破裂相关定性因素, 结果显示破裂组中侧壁动脉瘤的血流冲击更小,而分叉处动脉瘤的血流更复杂、更集中、冲击区域更小、更不稳定(见表6,均P<0.05)。 2 组的定量血流动力学参数差异无统计学意义(见表7、8,均P>0.05)。
3 讨论
本研究结合MCAA 病人的临床资料、动脉瘤形态学和血流动力学信息分析发现, 破裂和未破裂动脉瘤的部位(分叉/侧壁)及各种血流动力学参数,如血流复杂程度、集中程度、冲击面积大小、稳定性和OSICV间存在明显差异, 且构成了MCAA 破裂状态的独立风险因素。 分别对分叉和侧壁处MCAA 的破裂相关血流动力学参数深入分析发现, 侧壁动脉瘤破裂组较未破裂组血流冲击区域小, 而分叉处破裂动脉瘤血流复杂、集中、不稳定,且冲击区域小。
既往研究[15]分析颅内动脉瘤破裂的风险因素主要集中于病人的一般临床特征(如高血压、年龄)和动脉瘤的形态(动脉瘤大小、形态、位置)等因素,如大家熟知的动脉瘤破裂风险评分研究(PHASES)和未破裂颅内动脉瘤研究(UIAS),其中动脉瘤的大小通常被认为是预测动脉瘤破裂的最重要因素。 与之前结果不同的是, 本研究结果显示临床相关因素和动脉瘤大小在MCAA 破裂组和未破裂组之间差异并不存在统计学意义。 因此, 这些结果提示颅内动脉瘤的破裂状态预测需要根据部位做更加深入和精准的分析。
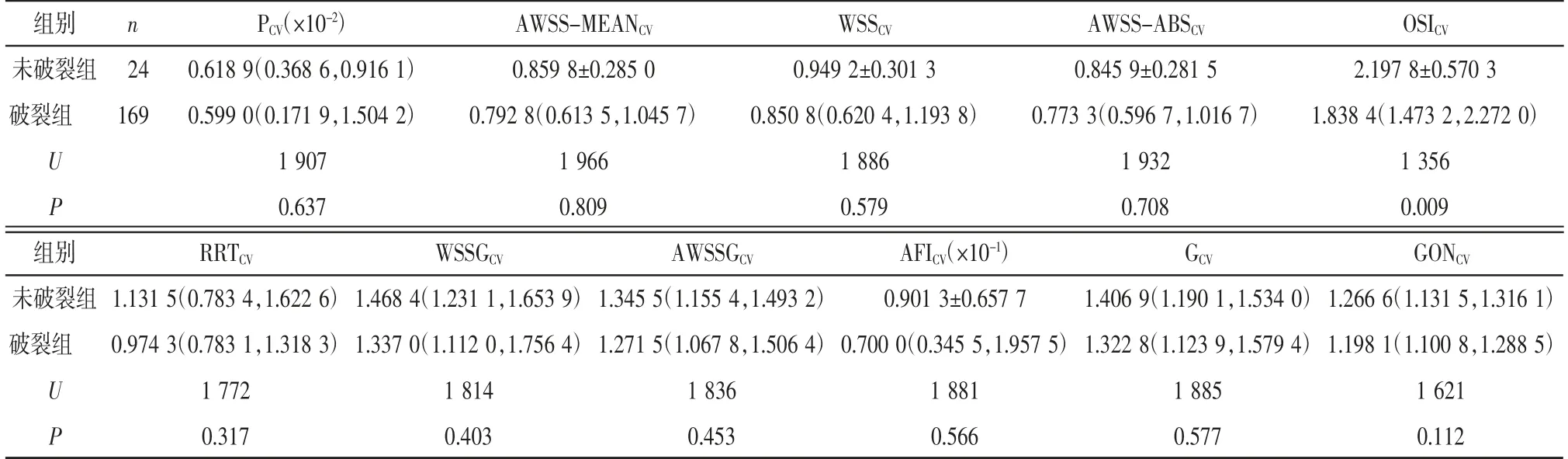
表4 2 组MCAA 病人的定量血流动力学参数比较

表5 预测MCAA 破裂状态的Logistic 回归分析结果
本研究围绕分叉和侧壁MCAA 对破裂预测的影响进行分析, 发现破裂组和未破裂组的侧壁动脉瘤的比例不同(13.6% 和33.3%,P=0.030)。 之前有研究[7]结果表明分叉处与动脉瘤形成和破裂相关,但是该研究没有限制动脉瘤部位, 结果可能存在一定的偏倚。 大脑中动脉具有典型的分叉/侧壁结构,动脉瘤发生率较高[5],是探索分叉和侧壁对动脉瘤破裂影响较合适的部位。 本研究仅针对MCAA 进行分析, 结果并未显示分叉和侧壁部位是动脉瘤破裂状态预测的独立危险因素,这与之前研究结果相悖,提示动脉瘤的不同部位可能影响着分叉/侧壁的作用,如后交通动脉瘤部位。

表6 2 组MCAA 中侧壁和分叉处肿瘤的血流参数比较
我们进一步分析MCAA 分叉和侧壁处血流动力学参数的影响,发现破裂/未破裂动脉瘤的血流动力学参数特征还会受到分叉/侧壁部位的影响,分叉处破裂的MCAA 的血流更加复杂,而侧壁处的破裂MCAA 则仅体现在血流冲击区域大小的不同。分叉/侧壁部位在本研究中并非独立风险因素的原因可能在于这些因素与血流动力学存在的多重共线性。
已有研究[16-17]证明异常的血流动力学可诱导血管内皮功能紊乱、动脉管壁炎症和重塑,破坏血管内皮细胞通透性, 促进血管粥样硬化和炎症细胞的浸润[17],从而导致动脉瘤的形成和破裂。我们根据以往的研究[18-19]分别纳入了研究较多的11 个定量血流动力学参数和4 个定性血流参数。 在本研究中,血流复杂程度、 冲击区域大小和OSICV构成了MCAA破裂状态预测的独立风险因素。 值得注意的是,本研究所用的4 个定性血流参数在MCAA 破裂状态中具有预测作用。 也有文献[19]报道,复杂、集中且不稳定的血流以及小的冲击区域与动脉瘤破裂显著相关。 由此可见, 集中而快速的血流冲击会促进动脉瘤的破裂。 而对于分叉和侧壁MCAA 的破裂血流动力学因素的分析则表明这些参数的作用受制于载瘤血管的形态特征, 其中的机制有待进一步研究。 本研究分析了193 例MCAA 病人, 通过对其临床信息、 形态学信息和血流动力学信息的分析, 明确了MCAA 破裂状态的独立风险因素, 发现在对MCAA破裂状态的预测中,分叉/侧壁部位会影响血流动力学参数, 对于进一步认识MCAA 血流动力学作用、分叉/侧壁部位和破裂之间的关系具有一定的意义。但本研究也存在一定的局限性: ①本研究为回顾性横断面研究,仅对MCAA 破裂状态的不同特征进行分析,缺少前瞻性设计对本研究的结果验证;②未破裂组人数较少(仅24 例),其中侧壁动脉瘤仅有8例,数据分布较不平衡,可能会影响研究结果;③纳入的动脉瘤形态学参数过少,如瘤颈长度、瘤体高度等未能纳入,这些形态学参数可能与分叉/侧壁部位相关;④未考虑动脉瘤破裂前后的形态学变化;⑤未涉及动脉管壁及瘤壁的信息, 而关于此内容的研究受到越来越多的关注[20]。

表7 2 组MCAA 中侧壁处肿瘤的血流动力学参数比较

表8 2 组MCAA 中分叉处肿瘤的血流动力学参数比较
综上所述,本研究发现瘤内血流的复杂程度、冲击面积大小和OSICV是MCAA 破裂的独立风险因素,血流动力学对MCAA 的影响受到其分叉/侧壁部位的影响; 同时未发现目前临床上常用的最大径指标对于预测MCAA 破裂/未破裂的意义。 本研究结果对于认识分叉/侧壁处MCAA 破裂相关的不同血流动力学特征, 优化临床检查中偶然发现的大脑中动脉的管理,具有为临床决策提供参考的潜在价值。

