蒽对脊尾白虾存活、免疫和能量分配的影响
邹易恒 李威 吴越 孟祥实 王兴强 曹梅 孙美超


摘 要:以脊尾白虾(Exopalaemon carinicauda)为试验对象,探讨了蒽对脊尾白虾存活、免疫和能量分配的影响。将同一批亲虾繁殖的幼虾放在试验室暂养7 d,挑选健康活泼和规格相似的幼虾作为试验对象,推算蒽对脊尾白虾的半致死浓度和安全浓度。试验设置8个浓度梯度,每个处理设3个重复。在试验过程中,每个水族箱加入5只白虾,经试验计算蒽对脊尾白虾24、48、72和96 h半致死浓度分别为21.53、16.31、11.76和9.06 mg/L,安全浓度为2.81 mg/L。在安全浓度下胁迫192 h,测定血清酚氧化酶和超氧化物歧化酶的活性,发现蒽对脊尾白虾免疫有着一定程度的抑制作用。随后在安全浓度下试验21 d,设两个处理,每个处理设3个重复,每个重复投放10只白虾,待试验结束后,选取白虾的肌肉部分进行能量分配测定,计算出蛋白含量、脂肪含量、糖元含量和肌肉的总能量储备以及对应能量分配的变化,结果发现对照组与处理组总能量储备相差240.67 mJ·mg-1(湿重),能量消耗相差252 mJ·mg-1(湿重),细胞能量分配相差11.33 mJ·mg-1·h-1(湿重)。以上结果表明,蒽明显影响脊尾白虾的存活、免疫和代谢。
关键词:蒽;脊尾白虾(Exopalaemon carinicauda);半致死浓度;安全浓度;免疫;能量分配
中图分类号:S949
蒽又称绿油脑,分子式C14H10或C6H4(CH)2C6H4,分子量178.22。蒽是无色片状或白色片状结晶,具有半导体的性质,有蓝色荧光,熔点216 ℃,沸点340 ℃,相对密度1.25(27/4 ℃),1.252(25/4 ℃),闪点(闭口)121.11 ℃,自燃点472 ℃,粘度(222.3 ℃)50.1 mPa·s,折射率1.594 8,不溶于水,难溶于乙醇和乙醚,而能溶于苯、氯仿和二硫化碳等有机溶剂。蒽的化学性质比较活泼,暴露在空气中,在阳光的照射下容易发生氧化反应,略微加热就会发生升华。蒽的粉尘与空气混合可以引起爆炸,爆炸极限为5.04 g/m3。蒽纯品基本上无毒,但工业品因含有杂质,故加大了其毒性。由于蒽的蒸气压很低,所以一般吸入蒽中毒的可能非常小。蒽对皮肤和黏膜具有一定刺激性,容易引起皮肤炎症。蒽由于对环境有危害,属于有机污染物,已被各国列为水质检测的必测指标之一[1-5]。
脊尾白虾(Exopalaemon carinicauda)是一种中型的虾类,体长5~10 cm,体色透明,有蓝色或红色小斑点,死后呈白色,所以被称作白虾。脊尾白虾额角的侧边扁且细长,隆起、鸡冠状。脊尾白虾腹部不大,它的第一节侧甲在里,而第二节侧甲在外。脊尾白虾普遍分布在岸边或者河口,一般都在浅海或者淡水河附近。脊尾白虾对环境的适应能力很强,在水温2~35 ℃内均可成活,即便水温到了零下3 ℃也能存活。在冬天低温时,有钻洞冬眠的习性,喜好群居。脊尾白虾对盐度的适应范围较大,咸淡水最为适宜生长,它能适应的盐度范围在3.87‰~30.00‰。在低氧上,脊尾白虾的耐受能力很差,它在溶氧1 mg/L的水环境中会因缺氧窒息死亡。脊尾白虾属于杂食性虾类,它的食性非常杂,范围广。在其幼仔虾阶段,吃食浮游植物和有机碎屑,待其到了成虾,开始吃食浮游动物。投喂动物性饲料或者人工配合饲料较投喂植物性饲料而言,可以大大提高脊尾白虾的生长速度[6-11]。
随着我国工业的快速发展,海洋环境问题也日益严峻,环境污染带来的问题直接降低了水产养殖业的产量,对我国养殖业带来巨大打击。另外,全球范围内都越来越严峻的环境污染问题,也因为其威胁着人类的健康而受到社会各界的广泛关注。在环境中蒽总体的量虽然相对其他污染物较少,但是由于它在环境中的分布极广,并且致癌性极强,所以仍然可通过多种途径对人体造成危害。关于蒽对脊尾白虾毒性的研究,目前还没有报道。鉴于此,本文探讨了蒽对脊尾白虾存活和能量分配的影响,以期为脊尾白虾的生态养殖提供技术支持。
1 材料与方法
1.1 试验设计
试验用脊尾白虾是大板桥育苗基地培育的亲虾所繁殖幼虾,放在试验室暂养7 d,每24 h换1次水,每次换1/3~1/2,并喂2次食。挑选出健康活泼、规格相似的白虾作为试验对象,放入事先准备好的规格50 cm×30 cm×30 cm的水族箱中,一共设置8个浓度,每个处理设3个重复,每组水族箱内蒽的浓度分别为0、6、9、12、15、18、21、24 mg/L。在每个水族箱中放入5只健康的脊尾白虾,并对其进行96 h的观察并记录。在安全浓度下胁迫192 h,一共设置2个处理,每个处理设3个重复,每个重复放养60尾白虾,分别在0、3、6、12、24、48、96和192 h按照血淋巴与抗凝剂1:2的比例抽取2~3尾白虾血液测定酶活。在安全浓度下试验21 d,两个处理,每个处理设3个重复,每个重复投放10尾白虾,试验结束后选取白虾的肌肉部分,测定和计算能量代谢数据。
表2表明,在进行实验观察后0~3 h之间,由于触发了免疫反应,所以血清酚氧化酶的活性增強;但是随着时间的推移酶的活性越来越低,在96 h后达到最低,最后趋于稳定。超氧化物歧化酶的活性在0~6 h内是呈增加的,直到12 h时才出现明显下降达到最低,为187.76 U/mg,随后在24 h时再次有小幅度上升后,达到初始SOD的活性。在48 h时SOD活性再次下降,并稳定在212 U/mg左右,最终趋于稳定水平。
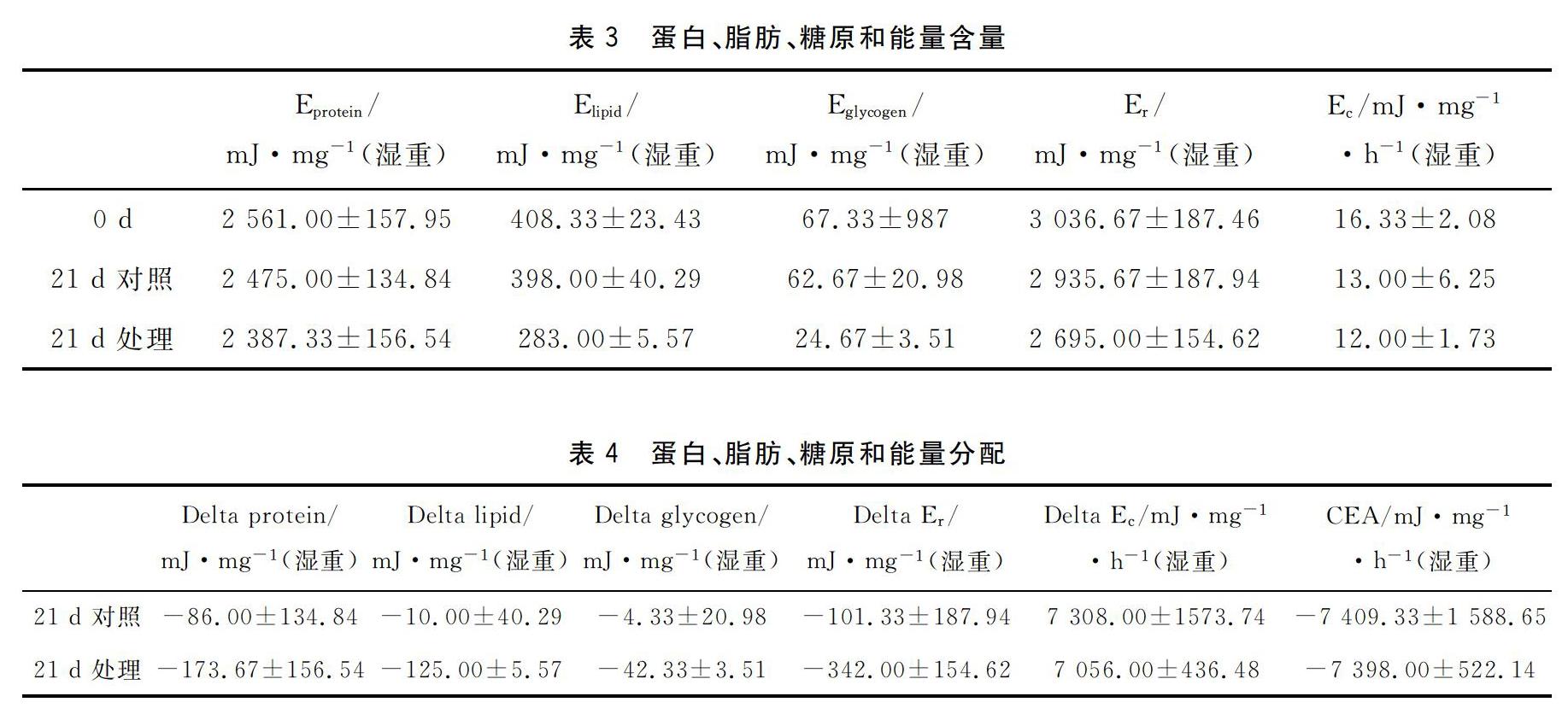
21 d安全浓度的胁迫试验发现,白虾的存活率呈现下降的趋势(图1),且试验结束时对照组白虾体重最大。经过21 d的试验处理,对照组与处理组Delta Er(总能量储备)相差240.67 mJ·mg-1(湿重),Delta Ec(能量消耗)相差252 mJ·mg-1·h-1(湿重),CEA(细胞能量分配)相差11.33 mJ·mg-1·h-1(湿重),见表3和表4。
3 讨论
脊尾白虾目前在我国的养殖面积非常大,同时也是我国特有的3种经济虾类之一。近年来,随着我国工业的快速发展,海洋环境问题也日益严峻,环境污染带来的问题也对人类构成了巨大的威胁,同时给我国养殖业带来较大影响。蒽属于多环芳烃,它是全球有机污染物,存在于空气、水和土壤等各个介质中。如今多环芳烃已经成为要优先处理的有机污染物,所以对多环芳烃的研究刻不容缓。近些年,我国的一些研究人员对此类有机污染物对水生生物的毒性做了一些研究,虽然我们起步较晚,但也同样有了很深刻的认识[3-5]。蒽在生活中应用非常广泛,它是染料的原材料,同时也能合成除草剂。它活泼的化学性质使其成为其它一些复杂多环芳烃的母体。蒽普遍存在于自然界的水体中,因为它的毒性会对水生生物的生长发育造成影响,已被列为环境监测的必须监测项目之一。蒽的毒性作用主要表现在能在光促的情况下,产生具有强氧化性的自由基,会破坏细胞膜。它还可以降解产生中间产物,再通过共价键和细胞中的大分子结合。在这次的试验过程中,我们不断深入探寻蒽这类有机污染物对脊尾白虾能量代谢所造成的影响,发现蒽明显影响脊尾白虾的存活和代谢(表1-表3,图1-图2)。
细胞能量分配可以把生物体的能量消耗(电子传递活性)和能量储备(蛋白质、脂肪和糖原储备)整合成一个总的胁迫指标,可以用来测定海洋生物在胁迫过程中能量收支的变化。甲壳动物的体成分主要是蛋白质、脂肪和糖原,通过蛋白质、脂肪和糖原等的能量换算可以计算出甲壳动物的蛋白、脂肪、糖原及其总的能量储备,其数值的变化可以反应出体内蛋白质、脂肪和糖原的供能情况。甲壳动物主要营有氧呼吸,其电子呼吸链(ETS)活性可以间接反映其能量消耗情况。通过计算能量储备和能量消耗的差值或比值,可以将甲壳动物的能量储备和能量消耗整合成一个数值,从而能更灵敏地反映出甲壳动物在胁迫条件下能量收支的变化[13-14]。本研究中,细胞能量分配有一定的变化,但幅度较小,可能与在安全浓度下胁迫有关(表4)。蒽在环境中的量不多,但是它分布极广,且不容易降解,因此仍然可以对生物体造成多种危害。尽管目前已经找到了清除蒽的最有效的手段-微生物修复,但是这一技术想要应用于实际,还需要克服多种因素的限制。研究蒽对脊尾白虾的毒性影响,科学准确评估蒽污染,对保护脊尾白虾的生存以及养殖环境的管理有着重要的意义,还可以为环境的污染提供早期的预警。
4 结论
本文以脊尾白虾为试验对象,探讨了蒽对脊尾白虾存活和能量分配的影响,发现蒽对脊尾白虾的24、48、72和96 h半致死浓度分别为21.53、16.31、11.76和9.06 mg/L,安全浓度为2.81 mg/L。在进行酶活性测定的实验中,血清酚氧化酶的活性增强,在3 h时达到最高,为0.023 U/min,但是随着时间的推移酶的活性越来越低,在96 h后达到最低,并趋于稳定。超氧化物歧化酶的活性在0~6 h内是呈增加的,直到12 h时才出现明显下降,为187.76 U/mg,随后在24 h时再次有小幅度上升后。在48 h时SOD活性再次下降,并稳定在212 U/mg左右,最终趋于稳定水平。在安全浓度下试验21 d,发现对照组与处理组总能量储备相差240.67 mJ·mg-1(湿重),能量消耗相差252 mJ·mg-1·h-1(湿重),细胞能量分配相差11.33 mJ·mg-1·h-1(湿重),表明蒽明显影响脊尾白虾的存活和代谢。
参考文献:
[1] 周瑶,鲍翠玉,李晶.蒽环类药物相关心脏毒性的发病机制及治疗研究进展[J].湖北科技学院学报(医学版),2019,33(06):547-549.
[2] 刘楠,王傲,白彦萍.高剂量7,12-二甲基苯并[a]蒽诱发的小鼠皮肤鳞状细胞癌模型建立及评价[J].海南医学院学报,2020,26(02):92-96.
[3] 吴春雷,丰诚杰,庄大卫,等.Cu(OTf)2催化螺环吲哚氧杂蒽三酮类衍生物的合成[J].绍兴文理学院学报(自然科学),2019,39(3):73-79.
[4] 乔雪,李士猛,杨红梅.紫杉醇或吉西他滨联合顺铂治疗蒽环类耐药晚期乳腺癌患者临床疗效及安全性观察[J].中国肿瘤临床与康复,2019,26(12):1478-1481.
[5] 林滔.不同剂量蒽环类药物对乳腺癌术前化疗临床疗效分析体会[J].中国医药科学,2019,9(23):48-50.
[6] 李志辉,王玉,李光光,等.温度和盐度对脊尾白虾生长和非特异性免疫的影响[J].海洋湖沼通报,2019(06):78-82.
[7] 解延年,李法君.地下卤水养殖脊尾白虾技术探索[J].黑龙江畜牧兽医,2019(20):144-145.
[8] 马杭柯,李志辉,赖晓芳,等.不同生物絮团对脊尾白虾高密度养殖水体氨氮的影响[J].水生态学杂志,2019,40(05):68-72.
[9] 仲崇虎,王梦杰,魏星,等.磺胺二甲嘧啶对脊尾白虾抗氧化酶活性的影响[J].江苏农业科学,2019,47(15):205-207.
[10] 陈实,吴旭干,杨丰,等.配合饲料和传统饵料养殖脊尾白虾气味品质的比较[J].食品工业科技,2020,41(01):189-194+200.
[11] 马鸿梅,王兴强,曹梅,等.脊尾白蝦养殖研究进展[J].现代农业科技,2019(16):171-172+175.
[12] 叶建生,阎斌伦,王兴强.中草药制剂对凡纳滨对虾非特异性免疫的影响[J].扬州大学学报(农业与生命科学版),2018,39(1):25-30.
[13] Wang Xingqiang, Wang Lingling, Yao Chen,et al. Alternation of immune parameters and cellular energy allocation of Chlamys farreri under ammonia-N exposure and Vibrio anguillarum challenge[J]. Fish & Shellfish Immunology,2012,32:741-749.
[14] Wang Xingqiang, Wang Lingling, Zhang Huan,et al. Immune response and energy metabolism of Chlamys farreri under Vibrio anguillarum challenge and high temperature exposure[J]. Fish & Shellfish Immunology,2012,33:1016-1026.
Abstract:The effect of anthracene on the survival, immunity and energy allocation of the shrimp Exopalaemon carincauda were studied using anthracene as experimental reagents. E. carincauda were obtained from the same shrimp breeding individuals. The shrimp were cultured in the laboratory for 7 d. The healthy and lively similar shrimps were choosed as the experimental object, determining anthracene lethal and safe concentration. In the experiment, 8 concentration gradients were set up. Each experiment group was set up with three replicates, each aquarium with 5 shrimps. The survival were recorded at 24, 48, 72 and 96 h, calculating the half lethal concentration and safe concentration. The results showed that the anthracene 24 h half lethal concentration was 21.53 mg/L, 48 h half lethal concentration was 16.31 mg/L, 72 h half lethal concentration was 11.76 mg/L, 96 h half lethal concentration was 9.06 mg/L, the safe concentration was 2.81 mg/L. The activity of serum phenol oxidase and superoxide dismutase was determined under the safe concentrations and it was found that the immunity of E. carinicauda was inhibited. Then, the experiments were conducted at a safe concentration for 21 d, three replicates per treatment, and 10 prawns at each replicate. At the end of the experiment, the muscle sections of the white shrimp were selected for energy allocation determination, calculating the total reserves of protein content, fat content, glycogen content and the corresponding changes of energy allocation. Between the control group and the treatment group, total energy reserve difference was 240.67 mJ·mgww-1, energy consumption difference 252 mJ·mgww-1·h-1, cell energy allocation difference 11.33 mJ·mgww-1·h-1, indicating that anthracene obviously affected the survival, immunity and metabolism of E. carincauda.
Key words:anthracene; Exopalaemon carincauda; half lethal concentration; safe concentration; immunity; energy allocation
(收稿日期:2020-02-29)

