CYP2C19基因多态性在急性冠状动脉综合征合并2型糖尿病患者中的分布特点及相关分析
高璐,李潞,赵红丽
(1.沈阳医学院内科学专业2016级硕士研究生,辽宁沈阳110034;2.沈阳医学院附属第二医院心血管内科)
目前,临床上急性冠状动脉综合征 (acute coronary syndrome,ACS)患者中确诊合并糖尿病的人群高达38.5%[1],如何安全对ACS合并糖尿病这一高危人群进行防治一直是人们关注的热点。氯吡格雷是一种抗血小板药物,广泛应用于ACS合并2型糖尿病的预后治疗中,其抗血小板聚集的效果受CYP2C19酶的影响。CYP2C19具有基因多态性,其野生基因型为CYP2C19*1/*1型,携带CYP2C19*2和CYP2C19*3基因可导致酶功能丧失,影响其抗血小板作用,而携带CYP2C19*17基因,其抗血小板作用增强,出血风险增加[2]。目前针对CYP2C19基因多态性在ACS合并糖尿病人群中研究较少,本文基于此进行研究,以期更好地优化治疗方案,给予安全有效的治疗。
1 资料与方法
1.1 研究对象 随机选取2016年9月至2018年6月沈阳医学院附属第二医院收治的确诊为ACS患者280例为研究对象,其中合并2型糖尿病患者200例,未合并2型糖尿病的患者80例。诊断标准依据 《中国 2型糖尿病防治指南 (2013年版)》[3], 《2016非ST段抬高型急性冠状动脉综合征指南》[4], 《2015年中国急性ST段抬高型心肌梗死诊断及治疗指南》[5]。所有入选患者均签署知情同意书,本研究经沈阳医学院附属第二医院伦理委员会批准。
1.2 方法 采集入选患者空腹静脉血2 ml置于EDTA抗凝管内,根据血液基因组DNA提取试剂盒 (产品型号:DP348,天根生化科技 (北京)有限公司)以及人类CYP2C19基因检测试剂盒(武汉友芝友医疗科技股份有限公司)的产品说明书进行血液DNA提取,基因扩增。
1.3 分组 根据基因检测结果进行分组,分为慢代谢型 (*2/*2、*2/*3、*3/*3)、 中等代谢性型(*1/*2、*1/*3、*2/*17、*3/*17)、 快代谢型(*1/*1)以及超快代谢型 (*1/*17、*17/*17)[6]。比较ACS患者中合并糖尿病和未合并糖尿病患者间基因代谢型分布特点。
1.4 统计学方法 采用SPSS 23.0软件进行统计学分析,计数资料用百分率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 ACS患者CYP2C19基因多态性分布情况 本研究纳入ACS患者280例,共表达了7种基因型,见表1。本研究符合Hardy-Weinberg定律 (P>0.05),所研究人群的基因型分布具有一定的群体代表性。
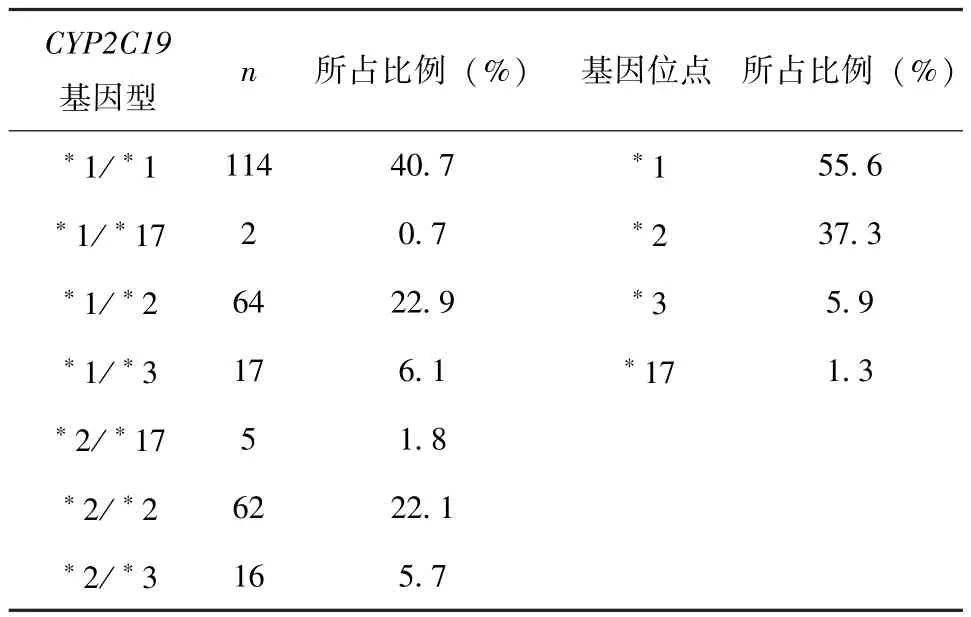
表1 280例ACS患者CYP2C19基因多态性分布情况
2.2 ACS合并糖尿病患者与未合并糖尿病患者基因代谢型分布比较 本研究280例患者共表达了4种代谢型,包括超快代谢型 (*1/*17)2例,占0.7%;快代谢型 (*1/*1)114例,占 40.7%;中等代谢性型 (*1/*2、*1/*3、*2/*17) 86 例,占 30.7%; 以及慢代谢型 (*2/*2、*2/*3) 78例,占27.9%。合并糖尿病患者与不合并糖尿病患者基因代谢型比较,差异有统计学意义 (χ2=14.8,P<0.05), 见表 2。
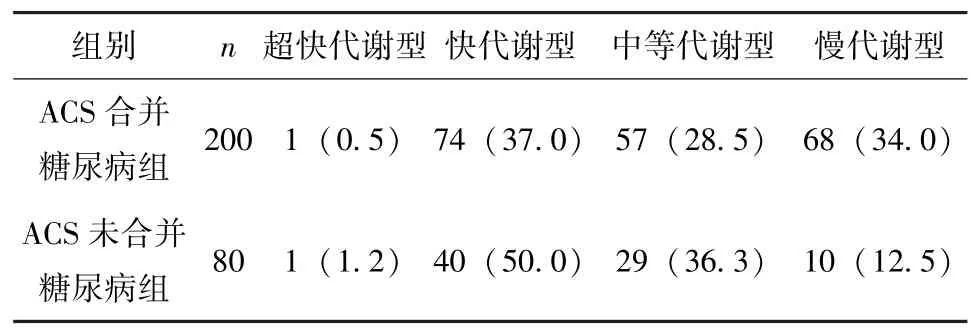
表2 ACS合并糖尿病患者与未合并糖尿病基因代谢型分布比较 [n(%)]
3 讨论
血管内皮在炎症反应刺激下发生损伤,血脂在冠状动脉内膜沉积形成粥样斑块,粥样斑块不稳定导致斑块破裂,血小板黏附聚集导致血栓形成,故针对ACS患者其有效的抗血小板治疗尤为关键。氯吡格雷作为抗血小板治疗的基石类药物为临床治疗带来巨大获益,但在实际工作中仍会发现,诸多患者即使规律口服阿司匹林联合氯吡格雷双重抗血小板药物仍有心血管事件的发生,其可能与氯吡格雷的药物代谢有关。
氯吡格雷为前体药物,需要经肠吸收,在肝脏CYP450酶的代谢下成为活性代谢产物,CYP2C19酶在其中发挥重要作用。既往研究表明:CYP2C19基因多态性能显著影响ACS患者服用氯吡格雷的疗效,慢代谢型及中间代谢型患者出现氯吡格雷抵抗率明显高于快代谢型[7]。相关文献指出:CYP2C19慢代谢基因型在我国部分地区冠心病患者中发生率为4.29%~24.66%[8],不同民族、不同地区的CYP2C19基因型分布具有差异。在本研究中发现ACS患者共表达了7种基因型,CYP2C19*1/*1型 (40.7%),CYP2C19*1/*17型(0.7%),CYP2C19*1/*2 型 (22.9%),CYP2C19*1/*3型 (6.1%),CYP2C19*2/*17型 (1.8%),CYP2C19*2/*2型 (22.1%),CYP2C19*2/*3型(5.7%),未检测到CYP2C19*3/*17 型,CYP2C19*17/*17型以及CYP2C19*3/*3型。 4种基因代谢型,超快代谢型 (0.7%)、快代谢型(40.7%)、中等代谢性型 (30.7%)及慢代谢型(27.9%)。
ACS合并糖尿病患者相比于未合并糖尿病的患者,其炎症反应进一步加重,血小板活性、黏附性、聚集性增高,更易损伤血管内皮,常常伴有血脂异常,且冠状动脉病变更为严重,更易发生心血管不良事件[6]。相关文献指出:针对ACS患者无论是否行血运重建治疗,都推荐进行双联抗血小板治疗12个月[9]。然而有资料显示:即使服用双联抗血小板药物,冠心病合并2型糖尿病患者的氯吡格雷抵抗率仍高达36.7%[10]。携带CYP2C19*2基因以及患有糖尿病是氯吡格雷抵抗的主要原因[11]。本研究通过对ACS合并糖尿病患者与ACS未合并糖尿病患者基因代谢型对比发现:合并糖尿病的ACS患者其为慢代谢型的可能性更大,进一步印证了这一观点。既往文献指出:表达中等及慢代谢型的冠心病合并2型糖尿病患者治疗6个月后主要不良心血管事件发生率明显高于快代谢型患者[12]。且表达中等代谢型及慢代谢型的ACS合并糖尿病患者血糖不易控制,相比于表达快代谢型及超快代谢型患者更倾向于应用胰岛素治疗[13]。 Carreras 等[11]指出, 患有糖尿病和携带CYP2C19*2的患者需要增加4倍的氯吡格雷维持剂量,才能达到类似的抗血小板反应。
ACS合并糖尿病患者在使用药物前对其进行CYP2C19基因型检测,指导其进行个体化的治疗,对患者的预后治疗起到极大帮助。董丽梅等[14]研究显示,表达CYP2C19*1/*2患者经皮冠状动脉介入治疗 (PCI)术后4 d发生亚急性支架内血栓形成,在应用阿司匹林联合氯吡格雷双联抗血小板治疗的基础上,加用另一种抗血小板聚集药物(西洛他唑50 mg,日2次),患者病情稳定好转。李朝晖等[15]研究发现,通过血小板功能测定及CYP2C19基因检测指导PCI术后抗血小板的治疗,其术后1个月肌钙蛋白、肌酸激酶同工酶、超敏C反应蛋白水平及术后1、6个月主要不良心血管事件的发生,都明显小于常规治疗组,且未增加出血风险。黄娇等[16]研究发现,快代谢组应用双联抗血小板常规治疗,中等代谢组应用双倍剂量氯吡格雷双联抗血小板治疗,慢代谢组应用替格瑞洛替代氯吡格雷治疗,用药3个月后,中等代谢组及慢代谢组血小板抑制率高于快代谢组,且慢代谢组血小板抑制率高于中等代谢组。
本研究发现ACS合并糖尿病患者相比于未合并糖尿病的患者其CYP2C19基因代谢型为慢代谢型的可能性更大,故其应用氯吡格雷,抗血小板作用更易受影响。因此,针对ACS合并糖尿病这类高危人群,行CYP2C19基因检测指导患者个体化的治疗,在积极控制心血管疾病危险因素,平衡出血风险的同时,加大抗血小板的力度,换用新型抗血小板药物,更能有效改善患者预后。

