不同配准方式下鼻咽癌千伏级CBCT图像引导放疗的摆位误差
张国前,张书旭,曾庆星,罗松桂,李萍,阳露,王琳婧,周露,王锐濠,廖煜良
广州医科大学附属肿瘤医院放疗科,广东广州510095
前言
图像引导是保证精确放疗的重要方法之一[1-2]。在鼻咽癌的图像引导放疗(Ⅰmage-Guided Radiation Therapy, ⅠGRT)中,锥形束CT(Cone-Beam Computed Tomography,CBCT)已成为最重要的一种三维图像引导方式[3],该技术应用X 射线容积成像(X-ray VolumetricⅠmaging,XVⅠ)原理,分次放疗开始前从不同机架角度获取一系列连续的图像,重建成三维容积图像,再生成断面图像即CBCT,将其与模拟定位CT图像进行配准,确定此时肿瘤位置的摆位误差[4-5]。临床实践证实鼻咽癌调强放射治疗过程中应用CBCT图像配准可以有效监控患者的摆位信息,实时纠正患者摆位误差[6]。在鼻咽癌ⅠGRT的图像配准过程中,自动配准相比手动配准更为方便、快捷,在临床工作中得到较普遍的应用。自动配准是计算机提取配准区域内相似的特征信息进行叠加匹配,然后综合计算两者间的位置差异,这就导致图像配准得到的摆位误差可能与配准时选取的配准区域有关,配准范围越大则包含特征信息越多。在图像引导实际临床操作中,出于兼顾图像配准精度和配准效率考虑,需要确定一个合适的图像配准范围,即确定配准框(Clipbox)大小和位置。本研究选取了两种不同的配准区域即靶区区域和全扫描范围进行探讨。此外由于不同配准算法采用特征空间和搜索策略不同,配准框选择对不同算法配准结果影响也不相同[7]。医科达XVⅠ图像引导系统提供了骨性、灰度和手动配准方式供临床工作选择,因系统自动配准能保证头颈部ⅠGRT需要的精度,因此,并未将手动配准纳入本研究。为了明确两种不同配准区域和不同配准算法对广州医科大学附属肿瘤医院鼻咽癌ⅠGRT配准结果的影响,本研究对此进行了比较,旨在为临床摆位提供参考。
1 病例资料与方法
1.1 一般临床资料
回顾性选取2016年6月~2018年5月在广州医科大学附属肿瘤医院进行调强放疗的鼻咽癌患者100例。其中,男76例,女24例;年龄30~68岁(中位年龄59 岁);临床TNM 分期:Ⅰ期14 例,Ⅱ期38 例,Ⅲ期33例,Ⅳ期15例。
1.2 CT模拟定位及放疗计划设计
患者均取仰卧位,通过U型热塑性面罩和全碳素纤维底板行头枕固定。按体位固定要求,采用飞利浦大孔径模拟定位CT(Brilliance Big Bore)进行扫描,扫描范围:上界至颅顶,下界至锁骨头下2 cm,扫描层厚3 mm,512×512 矩阵。将CT 图像通过网络传输至Pinnacle(V9.10)放疗计划系统,由主治医生遵循ⅠURU 第50、62 号报告原则进行靶区勾画,物理师按照处方剂量要求进行调强放疗计划设计。计划由医生和物理师共同确认后连同模拟定位CT 图像、靶区及计划系统重建的数字影像正侧位图像经网络传至MOSAⅠQ和CBCT计算机内存储。
1.3 图像引导设备
患者放疗开始前先行常规模拟机位置复核,即放疗计划射野中心的确认。由医科达公司的Simulix-Evoluation模拟定位机完成。复核图像和TPS导出的重建数字图像正侧位图像的配准由Mosaiq网络系统中的自动配准软件结合人工手动完成。千伏级CBCT扫描由医科达Synergy加速器的XVⅠ系统于患者首次治疗时完成。扫描条件为100 kV,36.1 mAs,FOV为27.6 cm的S20准直器,F0滤线器,机架旋转角度为100°~260°,中等分辨率重建模式。
1.4 图像配准方式
参考图像为模拟定位CT 图像,浮动图像为XVⅠ系统扫描后重建的CBCT 图像。实验中通过更改Clipbox的大小分别选择两种不同配准区域。小区域(即配准靶区,用S 代表)范围只包括所有计划靶区,具体来说分别在横断位、冠状位和矢状位将配准框的左右、上下及前后界调至覆盖全部靶区范围即可;大区域(即配准全部扫描范围,用L 代表),在三维方向上将配准框调至包含CBCT扫描的整体图像范围。实验中采用的配准算法分别是XVⅠ系统自带的骨性(用B代表)和灰度(用G代表)配准算法。最终,每位患者分别采用不同配准区域和配准算法结合的方式,即大区域骨性(LB)、大区域灰度(LG)、小区域骨性(SB)、小区域灰度(SG)这4 种方式进行配准。全部配准工作由具有丰富ⅠGRT 经验的一名物理师和一名技师离线状态下共同完成并确认。记录不同配准方式在左右、头脚及前后方向射野中心点的平移误差和旋转误差。
1.5 统计学方法
应用SPSS 20.0软件进行统计学分析。对不同配准方式的配准结果进行配对t检验并采用Pearson 相关性分析方法。P<0.05 为差异有统计学意义。配准结果的一致性采用Bland-Altman绘图法检验。
2 结果
对每例患者CBCT 扫描的图像,分别采用4 种不同配准方式进行匹配,得到XVⅠ系统自动计算出的X、Y、Z 即左右、头脚、前后方向的平移误差和3 个轴向的旋转误差(表1)。其中,在X、Y、Z 方向,4 种配准方式等中心点平移误差均值范围为-0.29~1.07 mm,旋转误差均值范围为-0.1°~0.61°。对于三维方向上误差绝对值≤3 mm 或3°的概率分布中,4 种配准方式中X 方向为91%~100%,Y 方向为84%~91%,Z 方向为89%~97%;对于三维方向上误差绝对值≤2 mm或2°的概率分布中,4 种配准方式中X 方向为70%~98%,Y方向为64%~81%,Z方向为75%~87%。
摆位误差的比较方面,LG与LB相比除Y方向的平移和旋转误差无显著性差异(P=0.67, 0.57)外,其余所有误差均有显著性差异(P=0.00~0.02)。SB 与SG相比除X方向平移误差和Y方向旋转误差无显著性差异(P=0.36, 0.72)外,其余所有误差均有显著性差异(P=0.00~0.02)。除LB 与SB 在Y 方向的平移误差存在显著性差异(P=0.00)之外,其余平移和旋转误差均无显著性差异(P=0.05~0.82)。LG 与SG 的所有平移和旋转误差均无显著性差异(P=0.14~0.64)。各配准方式两两组合的相关性经Pearson 相关性分析,三维方向上所有平移和旋转摆位误差结果均呈正相关(R=0.48~0.98,P<0.01)。详见表2。
4 种配准方式两两组合,三维方向上的平移和旋转摆位误差的一致性经Bland-Altman法检验,95%一致性限度均<3 mm 或3°。其中,采用LG 和SG 进行配准得出的摆位误差在X、Y、Z平移和旋转方向上的95%一致性限度分别为[1.19, -1.25]、[0.95, -1.01]、[1.13,-1.31]和[0.80,-0.85]、[0.69,-0.60]、[1.02,-1.13](表3)。按照2 mm 和2°界值标准二者摆位误差具有足够一致性。LG 与SG 平移和旋转摆位误差的一致性检验图如图1所示。
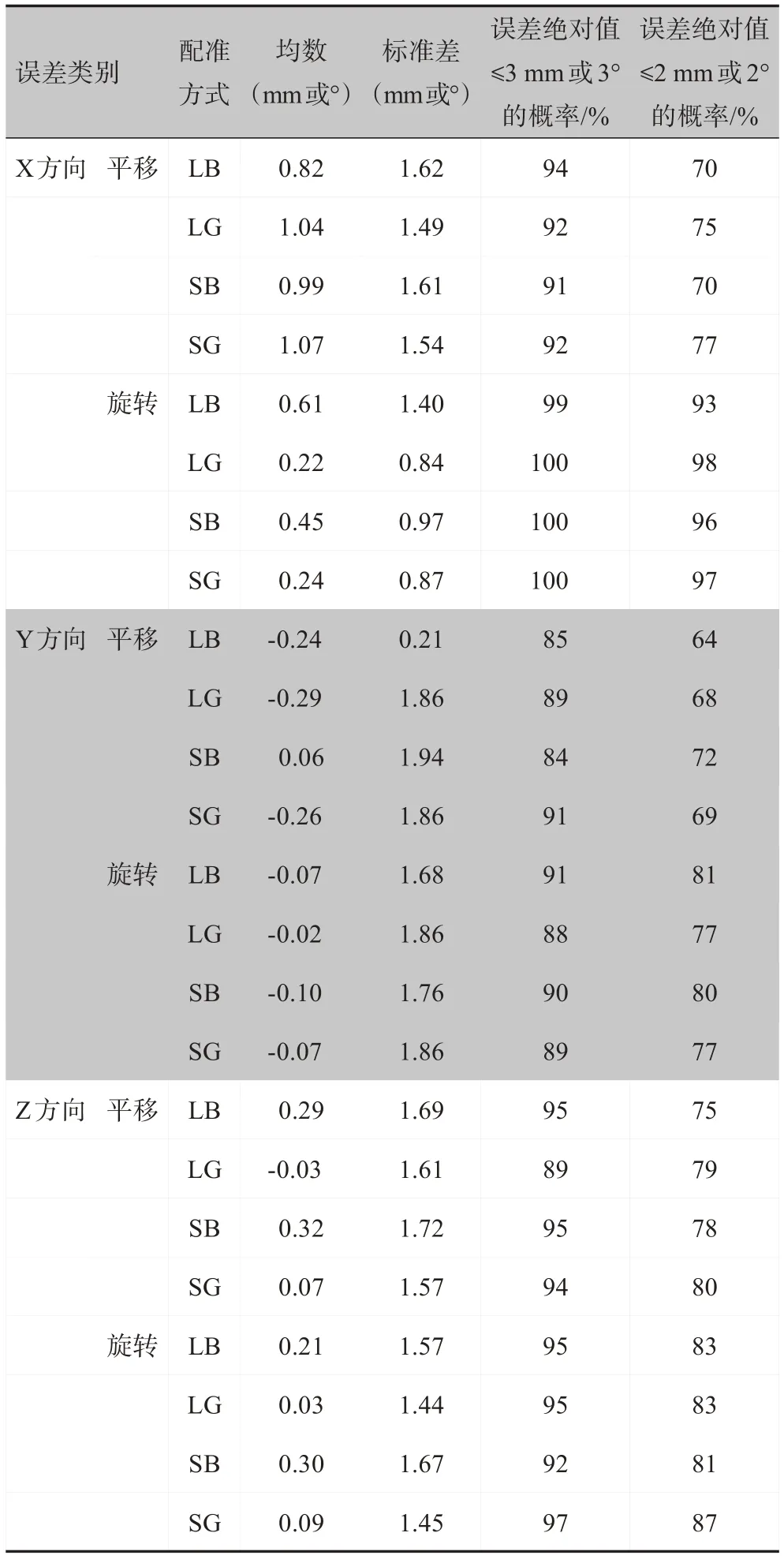
表1 100例鼻咽癌患者四种不同配准方式下的三维方向平移和旋转摆位误差Tab.1 Translation and rotation set-up errors under 4 different registration models in 100 patients with nasopharyngeal carcinoma
3 讨论
千伏级CBCT 图像引导的放疗技术是指在分次治疗前(一次或多次)获得患者在治疗体位下的千伏级CBCT图像,将其与计划CT图像进行配准,用于发现和在线校正患者摆位误差[8-9]。在图像配准的过程中,许多因素都可能对摆位误差造成影响,如自动或者手动配准,配准区域的选择如计划靶区、头部或者颈部、危及器官等,自动配准算法如骨性配准或灰度配准,图像采集的层厚,图像配准操作者如医生、物理师或技师的个体差异及配准软件版本[10]等。
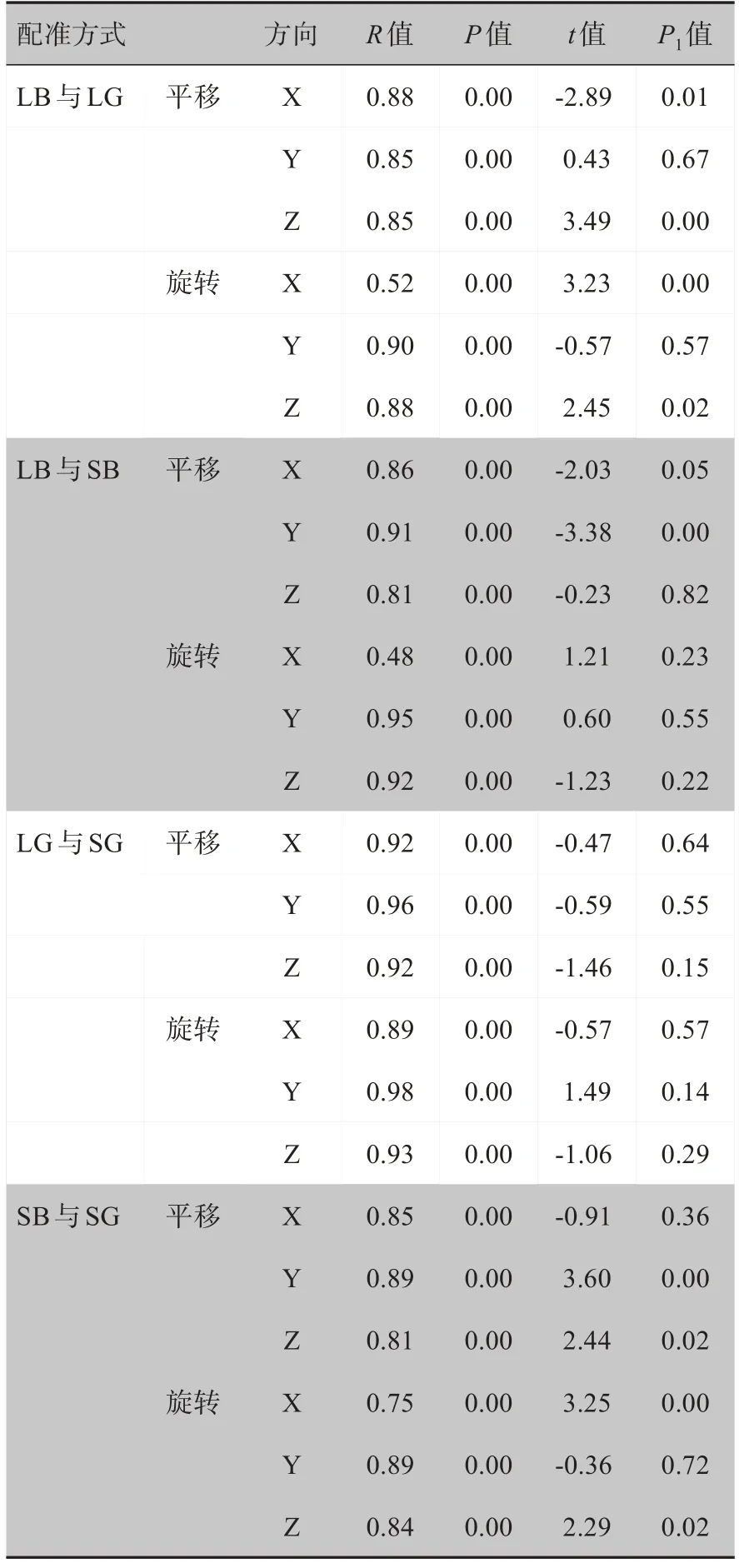
表2 100例鼻咽癌患者不同配准方式下摆位误差Pearson法相关性分析Tab.2 Pearson correlation analysis of set-up errors between different registration modes in 100 patients with nasopharyngeal carcinoma
傅万凯等[11]对220 例鼻咽癌调强放疗患者首次治疗扫描的CBCT图像进行离线配准,分别设置靶区配准区、头部配准区、颈部配准区3 个配准区域行自动骨性配准,结果发现以整个治疗靶区作为配准区域进行配准时,得到的摆位误差值与头部区域较为接近(除前后平移方向差异有统计学意义,P=0.048),与颈部区域相比则有明显差异。原因在于颈部区域骨性结构较头部区域少,配准过程中所占的权重也较小,且颈部易发生扭曲变形,造成头部区域与颈部区域之间存在摆位误差差异,以整个治疗靶区作为图像引导的配准区域行自动骨配准得出的摆位误差值不能完全反映出鼻咽癌ⅠMRT 治疗靶区内各个特定部位尤其是颈部区域的摆位误差情况。同时Zhong 等[12]选择24 例鼻咽癌患者靶区内11 个不同的感兴趣区作为CBCT 图像引导中的配准区域,评价5 mm 的常规靶区外扩可以覆盖哪些配准区域的摆位误差,其结果认为颈椎1~4、下颌骨及蝶窦区域作为配准范围其外扩值小于5 mm,优于头颈部单独的骨性标志如喉部或颈椎5~7。本研究仅选取了靶区和全扫描范围两种配准区域,除骨性配准的Y方向平移误差上有显著性差异(P=0.00)外,其余所有骨性和灰度配准的三维方向上,两种配准区域得出的平移和旋转误差均无显著性差异(P=0.05~0.82),提示配准区域选择靶区或全扫描范围时配准结果差异不明显。虽然与上述研究中的配准区域并不相同,但该结果与上述研究并不矛盾,相比头部配准区和颈椎1~4、下颌骨及蝶窦区域,本研究选择的全扫描范围包含的区域最大,包含的特征信息最多,其得出的摆位误差与基于靶区得出的配准结果相近,鼻咽癌ⅠGRT过程中将全靶区作为配准区域进行自动骨配准时,是以整个配准区域内的骨性结构作为特征信息[13]。相比全扫描范围内的骨性结构,只相差了部分颅骨和颈椎,因此并未对摆位误差结果产生明显的差异。采用灰度配准时,相比靶区全扫描范围增加的灰度特征亦未对误差造成明显差异。
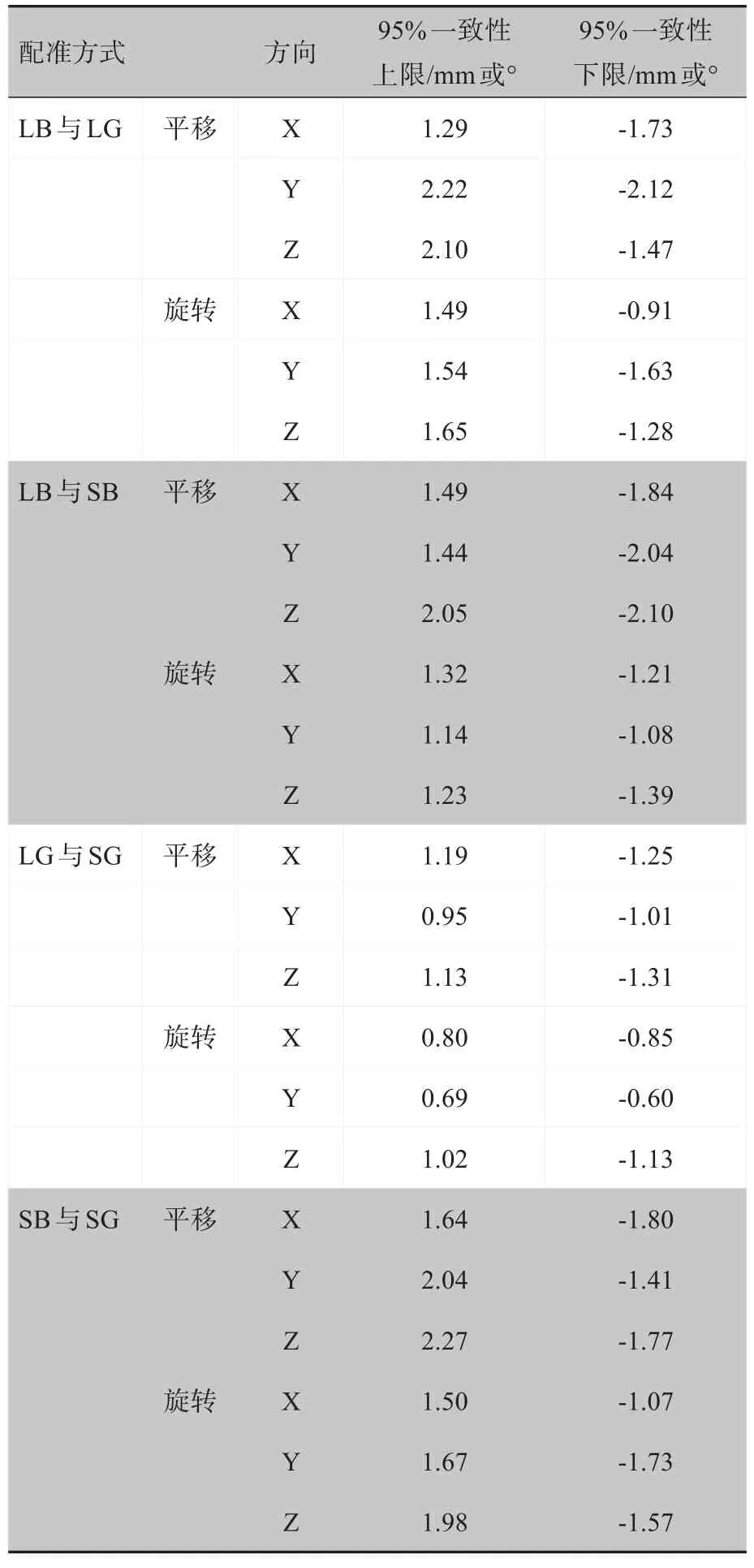
表3 100例鼻咽癌患者不同配准方式下摆位误差95%一致性限度Tab.3 Limits of agreement(95%LoA)of set-up error under different registration modes in 100 patients with nasopharyngeal carcinoma
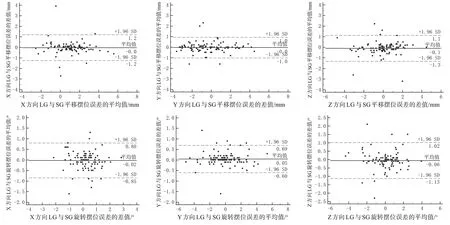
图1 LG与SG平移和旋转摆位误差的一致性检验图Fig.1 Bland-Altman plots of translational and rotational set-up errors between LG and SG
对于配准算法对误差影响的比较,李晓玉等[10]对24 例鼻咽癌ⅠMRT 患者560 次治疗前初次摆位的千伏级CBCT图像做离线配准分析,结果表明骨性与灰度配准方式的靶区中心平移误差在X、Y、Z方向上均不同(P=0.00~0.01),靶区中心旋转误差在X 方向上不同(P=0.00),Y 和Z 方向相近(P=0.05、0.62)。误差绝对值≤2 mm的概率分布方面,除了Y方向的旋转误差灰度配准方式略低于于骨配准外,其余平移和旋转误差灰度配准均高于骨配准。本研究中LG 与LB 相比除Y 方向的平移和旋转误差无显著性差异(P=0.67, 0.57)外,其余所有误差均有显著性差异(P=0.00~0.02)。SB 与SG 相比除X方向平移误差和Y 方向旋转误差无显著性差异(P=0.36, 0.72)外,其余所有误差均有显著性差异(0.00~0.02),提示ⅠGRT配准结果可能因骨性或灰度配准方式的不同而有差别。此外,误差绝对值≤2 mm 或2°的概率分布方面,除Y 方向平移误差SB>SG,旋转误差LB>LG,其余平移和旋转误差灰度配准均高于或等于骨性配准。该结果与上述研究结果类似,而差异可能与体位固定装置、图像采集的层厚、图像配准的操作者等其他因素的影响有关。
本研究结果提示头颈部图像配准结果可能因骨性或灰度配准方式的不同而有差别。配准区域选择靶区或全扫描范围时配准结果差异不明显。同时,4组配准方式的相关性经Pearson 相关分析,三维方向上所有平移和旋转摆位误差结果均呈正相关(R=0.48~0.98,P<0.01),说明它们在用于ⅠGRT配准时得到的摆位误差的的趋势具有一致性,结果不相悖离,只是在数值大小上有相对区别。4组配准方式的一致性经Bland-Altman 法检验,若按照2 mm 和2°界值标准LG 和SG进行配准得出的摆位误差具有足够一致性。按照该界值标准二者可相互替代。相关性和一致性分析的结果支持上述结论。
此外,黄伯天等[14]使用仿真人头颈模体模拟三维方向摆位偏移验证了CBCT 图像引导系统骨性和灰度配准算法的精度。其结果认为头颈模体骨性和灰度配准在X、Y 方向的误差有统计学差异(P=0.00,0.00),而Z 方向误差无统计学差异(P=0.54)。灰度配准精度略高于骨性配准。黄伯天等[7]还对放疗图像层厚与配准范围对自动配准精度的影响进行了探讨。配准范围分别为为眼眶上缘至第七颈椎中间和颅顶至第七颈椎,层厚分别为1 mm和3 mm。结果表明,不同层厚图像的配准误差在3个方向上的差异均具有统计学意义(P=0.00);3 mm 层厚时两种配准范围的摆位误差在3 个方向上的差异同样均具有统计学意义(P=0.00)。上述研究是基于仿真模型对图像配准精度进行的分析,与本研究中得出的摆位误差的结果并不矛盾。Zhang 等[15]探讨了西门子CT-On-Vision 系统在纠正鼻咽癌分次放疗摆位误差中的作用,该研究认为不同层厚的CT 图像重建会影响摆位误差的测量精度,特别是在Y 方向上。3 mm 的图像重建层厚对于利用图像配准测量摆位误差是合适的。不同操作人员对配准误差的影响方面,李庆瑞等[16]随机抽取了20 例肺癌患者作为研究对象,应用容积调强技术加CBCT引导放疗,由计划系统自带配准软件进行CBCT 图像自动配准,再由3 名医技人员进行手动图像配准,包括技师、主管技师与医生,比较配准误差情况。结果主管技师手动配准误差都明显低于技师与医生(P<0.05),也低于自动配准误差(P<0.05)。上述研究表明图像采集的层厚以及图像配准操作者的差异都会对摆位误差造成影响。
在临床工作中,许森奎等[17]认为在头颈部匹配区域的选择上,应包含计划靶区、危及器官和与靶区位置相对固定的邻近组织结构为主。本研究中当选择计划靶区作为配准区域时,脊髓、脑干、腮腺等重要危及器官已包含在配准区域内,选择三维方向上全部覆盖计划靶区的配准区域进行配准对于鼻咽癌的ⅠGRT 是可行的。医科达ⅠGRT 协作组推荐的头颈部肿瘤配准范围是上界到眉弓,下界到第四颈椎下缘,左右界到两侧耳内缘,前界到鼻尖,后界到枕骨后缘。该范围基本与本研究中采用的靶区范围相近,能够包括肿瘤及周围较固定的骨性标志。在配准方法的选择上,因头颈部肿瘤位置和周围骨性结构的位置相对固定,且整体近似刚性,考虑使用骨性配准;如果Clipbox包括明显变形区域,配准结果与实际结果相差较大,可结合手动配准微调纠正,如果不能纠正需重新摆位。
此外,对于旋转误差的处理,各放疗单位视其情况而有差别。广州医科大学附属肿瘤医院放疗科的医科达Synergy 直线加速器未配置六维度治疗床,尚不具有自动校正旋转摆位误差的能力,因此旋转误差的校正并未列入工作常规。对于具备旋转误差自动校正能力的单位对误差阈值的要求也不一致(2°或3°),当超出阈值范围则需重新摆位。虽然头颈部摆位中发生大角度旋转的概率较低但仍不能忽视,有文献报道旋转误差会造成靶区剂量改变,危及器官如脊髓的剂量明显增加[18]。本研究中旋转角度最大的一次出现在LB 头脚方向上,达到了5.6°。在实际操作中应注意因颈部体位扭曲容易发生大角度旋转的个例情况,应严密监测后进行再次摆位或对其进行纠正。当发生案例较多时则可能需要更换精度更高的体位固定装置。
本研究也存在一定不足:本研究中的所有患者均是利用传统的U形面膜来固定体位的,若采用其他体位固定装置(如头颈肩膜、真空垫或发泡胶联合头颈肩膜[19-20]等),对摆位误差的影响并不一样。许森奎等[13]研究认为相比传统的标准定形枕,采用头颈定位泡沫垫对鼻咽癌进行体位固定效果更优,特别是能够改善颈部区域的固定效果。现在本中心头颈部肿瘤放疗患者已改为发泡胶与头颈肩面罩相结合的固定方式。相关研究正在进行中。