mTORC1 信号通路在张应力下对小鼠骨髓间充质细胞成骨分化的作用
彭海艳, 蒋校文, 黄华庆, 陈金勇
南方医科大学附属郴州市第一人民院口腔科 南华大学转化医学研究所,湖南 郴州(423000)
牵张成骨是口腔颌面及整形外科畸形缺损的重要整复手段,具有同时延长软、硬组织等其它整复手段不能比拟的优势,但治疗时间长、并发症较多等一直是限制其广泛临床应用的瓶颈[1-2]。探讨对牵张力最敏感的应答细胞和新骨生成的主要细胞—骨髓间充质细胞(bone marrow mesenchymal cells,BMMSCs)在牵张成骨过程中的具体机制对于丰富牵张成骨的分子机制及研究治疗靶点具有重要意义。多单元细胞拉伸装置能够对细胞施加周期性的牵张力,并具有易控制、易重复的特点,是体外研究牵张力对细胞影响的较好模型[3-4]。
近年来研究发现雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR)信号通路在骨发育及病理生理中具有重要的作用[5,6]。其中研究较多的哺乳动物雷帕霉素复合物1(mammalian target of rapamycin complex 1,mTORC1)信 号 通 路 主 要 由mTOR、mTOR 相关调节蛋白(Raptor)和mTOR 必须蛋白亚基带SEC13 哺乳动物致死蛋白8(mammalian lethal SEC13 protein 8,mLST8)组成,能接受激素、生长因子、营养及能量、应激等刺激,并对大环内酯药物雷帕霉素(rapamycin)敏感[7],但其在牵张成骨方面的研究较少。本实验以多单元细胞拉伸装置为平台对小鼠BMMSCs 施加周期性单轴牵张力后观察内源性mTORC1 信号通路的表达变化规律,同时通过工具药改变内源性mTORC1 信号通路的表达来探讨该通路对张应力下BMMSCs 成骨的影响。
1 材料与方法
1.1 材料与试剂
实验动物为1 月龄雄性小鼠(SYXK < 湘 >2010-0006,南华大学动物实验中心),本研究获得郴州市第一人民医院伦理委员会批准(N2015094562)。多单元细胞拉伸装置(四川大学);分光光度仪(罗氏,瑞士)。Percoll 分离液(Phamacia,美国);LG-DMEM 培养基(Gibico,美国);Ⅰ型鼠尾胶(ABI,美国);BCA 蛋白定量试剂盒(Thermo,美国);ALP 试剂盒(建成,中国);OCN试剂盒(BIM,美国);mTOR 一抗(Abcam,英国);pmTOR 一抗(Abcam,英国);GAPDH 一抗(Santa-Cruz,美国);Raptor 一抗(Cell Signaling,美国);p-Raptor 一抗(Cell Signaling,美国);S6K 一抗(Cell Signaling,美国);p-S6K 一抗(Cell Signaling,美国);Trizol 试剂盒(Gibico,美国);PP242(Cayman,美国);MHY1485(MedChemExpress,美国)。
1.2 小鼠BMMSCs 的分离和培养
无菌条件下分离1 月龄雄性小鼠双侧股骨和胫骨,剪开干骺端用培养基冲出骨髓,离心弃去脂肪层后吹打制成细胞悬液,加入Percoll 分离液后离心吸取界面细胞层,用含5%胎牛血清的PBS 溶液洗涤细胞3 次后弃上清,加入10%胎牛血清的LG-DMEM 培养基吹成细胞悬液接种于培养瓶内,培养2 d 后更换培养基,倒置显微镜下观察当细胞融合达70%~80%时用0.25%的胰蛋白酶消化细胞传代,选用第3 代细胞计数后进行下一步实验,每个检测指标收集8 个样本行检测。
1.3 细胞加力及分组
将高温高压灭菌后均匀涂布1.5 mL(0.012 μg/mL)Ⅰ型鼠尾胶的硅胶膜组装到细胞培养单元上,同时在硅胶膜上放置硅胶膜矩形环(40 × 30 mm)以控制细胞接种范围,将2 mL 密度为2 × 104个/mL 的细胞悬液接种于硅胶膜上后在37 ℃体积分数5% CO2培养箱培养24 h 后取出硅胶膜矩形环,补加含10% 胎牛血清的DMEM 培养基10 mL 培养24 h,更换无血清培养基同步化12 h 后利用多单元细胞拉伸装置(四川大学)施加10%形变量的单轴动态牵张力2 h(频率为0.2 Hz)。装置见图1。

Figure 1 The photo of the multi-unit cell stretching device图1 多单元细胞拉伸装置实物图
在同步化阶段及加力阶段加力单元中,设立mTORC1 信号通路抑制组(加入PP242 100 nM)、对照组(加入等体积PBS)和mTORC1 信号通路激活组(加入MHY1485 10 μM),加力结束后2 h 收集培养液及细胞进行下一步研究。
1.4 mTORC1 信号通路及成骨信号的检测
1.4.1 化学比色法检测细胞碱性磷酸酶(alkalinephosphate,ALP)活性[4]将硅胶膜上的单纯加力五组细胞分别PBS 洗涤、胰酶消化,与3 ml 带血清培养基混匀,离心弃上清,再加入2 ml PBS 经过混匀离心弃上清,最后加入90 μl PBS 液收集细胞。将细胞反复冻融3 次,离心后收集上清液50 μl 加入试剂盒中基质液和缓冲液各500 μl,混匀后37 ℃水浴15 min 后加入显色剂1.5 ml 混匀后,利用分光光度仪检测其405 nm 波长下吸光度值,根据公式[y=2000(Δx-Δ空白)/18.5]计算出ALP 活性,结果以U/ml 表示。
1.4.2 ELISA 法测定骨钙素(osteocalcin,OCN)含量[4]使用标准品450 nm 波长下测量后计算出标准曲线的直线回归方程。将单纯加力五组细胞培养皿内培养液1 ml 离心后收集上清作为待测标本,在酶标包被板中入待测样本10 μl,再加样本稀释液40 μl 混匀后37 ℃温育30 min,弃液洗板五次后甩干,加入酶标工作液50 μl,37 ℃温育 30 min后弃液洗板五次甩干后再加入显色剂50 μl 混匀,37 ℃避光显色 15 min 后加终止液 50 μl 终止反应后检测其 450 nm 波长下比值,通过方程[1](y=3.654x+1.029)计算出培养液内OCN 相对浓度。
1.4.3 Western blot 测定mTORC1 信号通路主要分子(mTOR、Raptor 以及S6K)表达 将硅胶膜上的单纯加力五组细胞裂解后得到总蛋白,以牛血清为标准品,利用BCA 蛋白定量试剂盒建立标准曲线,计算总蛋白浓度,取总蛋白20 μg 行SDS-PAGE电泳,转PVDF 膜,脱脂奶粉封闭后分别一抗工作液孵育过夜后二抗工作液37 ℃孵育1 h 置于自动成像仪暗匣中加显影液,计算机扫描收集图像,检测 mTOR、p-mTOR、Raptor、p-Raptor、S6K 及 p-S6K蛋白表达水平,GAPDH 作为内参。
1.4.4 Real-time PCR 测定 Runx2 mRNA 水平 将硅胶膜上的单纯加力五组细胞按Trizol 试剂盒流程提取细胞中总RNA,通过异丙醇沉淀法浓缩RNA,进一步对总RNA 行过柱纯化。RT-PCR 测定Runt 相关转录因子2(Runt-related Transcription Factor 2,Runx2)mRNA(5'端引物为:5'-CCCAGCCACCTTTACCTACA-3',3'端引物为:5'-TATGGAGTGCTGCTGGTCTG-3'),以 GAPDH 为内参(5'端引物为:5'-AGGTCGGTGTGAACGGATTTG-3',3'端引物为:5'-GGGGTCGTTGATGGCAACA-3')。采用反转录试剂盒在BioRad 1000 TM 上反转录成cDNA。再以第一链cDNA 为模板,采用SYBR Green I 染料进行实时荧光定量RT-PCR 反应。PCR扩增条件为:95 ℃ 30 s,95 ℃ 5 s,57 ℃ 30 s,共 40个循环,72 ℃延伸7 min 后结束扩增反应,取扩增产物进行琼脂糖凝胶电泳,并在凝胶成像系统上观察电泳结果。
1.5 统计学分析
2 结 果
2.1 单纯细胞加力后内源性mTORC1 信号通路及成骨信号的检测
2.1.1 牵张后细胞mTORC1 信号通路激活 Western blot 结果显示,牵张结束后0~8 h 后细胞均表达 mTOR、Raptor、S6K 信号,通过对磷酸化上述因子的检测发现,细胞中的p-mTOR、p-Raptor 与p-S6在牵张结束后表达逐渐上升(0~2 h),在2 h 时表达最高值。2 h 后,上述蛋白表达逐渐下降。见图2。
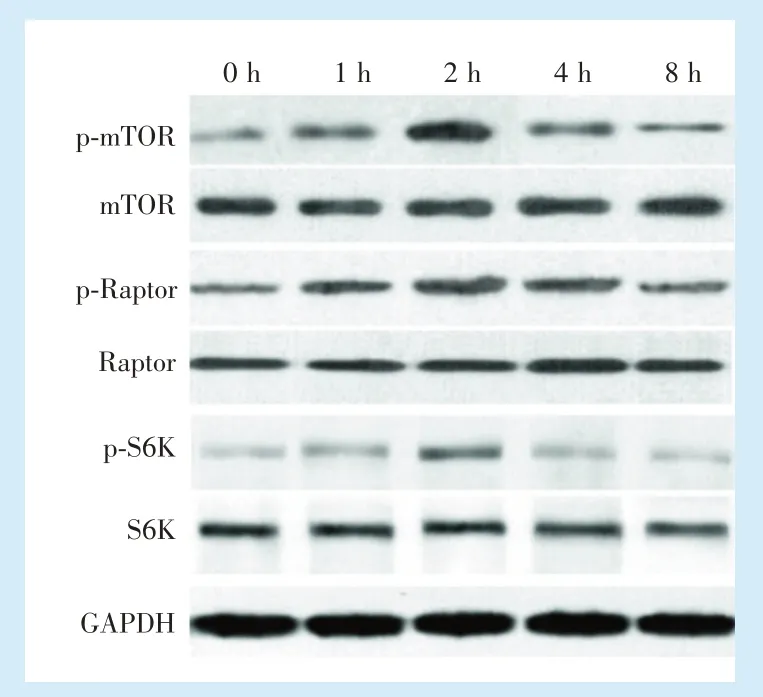
Figure 2 The expression of the major signal molecule protein of mTORC1 signal pathway of BMMSCs at 0-8 hours after the application of 10%uniaxial dynamic tensile force for 2 hours图2 施加形变量10%单轴动态牵张力作用2 h后0-8 h mTORC1 主要信号分子蛋白表达情况
2.1.2 成骨信号表达变化趋势与mTORC1 信号通路一致 细胞牵张结束后0~8 h 后,化学比色法检测结果显示,ALP 的活性在0~2 h 逐渐升高,2 h时达到最高值,2~8 h 呈下降趋势。ELISA 法检测OCN 含量以及 Real-time PCR 检测 Runx2 mRNA 水平的结果显示,OCN、Runx2 趋势与ALP 一致,均出现先上升后下降趋势。见表1、图3。
2.2 内源性mTORC1 信号通路变化后细胞成骨信号的改变
2.2.1 mTORC1 信号通路被抑制或激活 由western blot 结果可见,牵张应力作用结束2 h 后,与对照组相比,mTOPC1 通路抑制组的p-S6K 表达下降,而增强组p-S6K 表达上升,说明抑制组内源性mTOR 信号被抑制,增强组内源性mTOR 信号被增强(图4)。
2.2.2 抑制或增强mTORC1 通路可调节细胞成骨信号的表达 化学比色法检测结果显示,与对照组相比,mTORC1 抑制组的ALP 的活性降低(P<0.001),而增强组ALP 活性升高(P<0.001);ELISA法检测OCN 相对含量,与对照组相比,抑制组的相对含量下降(P< 0.001),增强组则升高(P<0.001);同样地,Real-time PCR 检测 Runx2 mRNA 水平的结果显示,抑制组的水平下降(P< 0.001),增强组水平升高(P<0.001)。见表2。
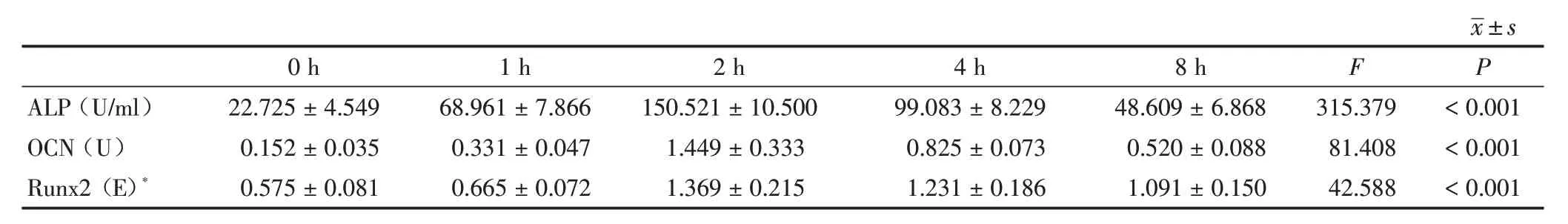
表1 施加形变量10%单轴动态牵张力作用2 h 后0~8 h BMMSCs 成骨信号结果Table 1 The osteogenic signal data results of BMMSCs after the application of 10%uniaxial dynamic tensile force for 2 hours from 0 to 8 h
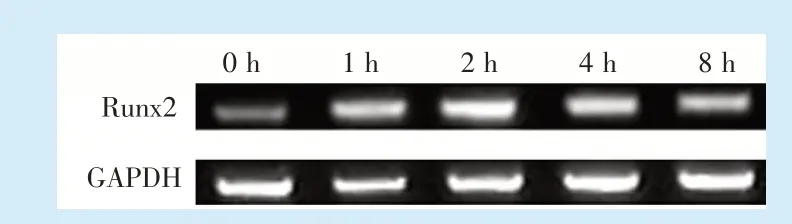
Figure 3 The PCR electrophoresis results of BMMSCs after the application of 10%uniaxial dynamic tensile force for 2 h from 0 to 8 h图3 施加形变量10%单轴动态牵张力作用2 h 后0 至 8 h BMMSCs Runx2 PCR 电泳结果
3 讨 论
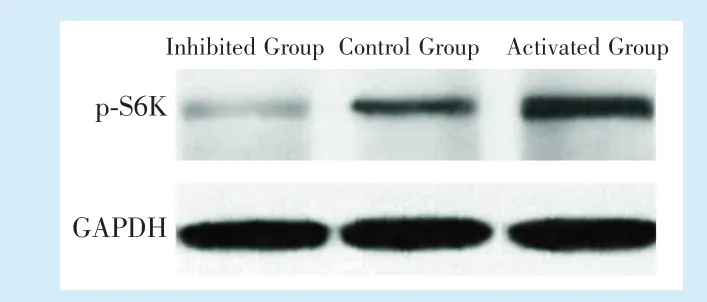
Figure 4 The expression of p-S6K protein among three BMMSCs groups 2 h after the application of uniaxial dynamic tensile force图4 3 组BMMSCs 加力结束后2 h p-S6K 蛋白表达情况
表2 3 组BMMSCs 加力结束后2 h 成骨信号表达情况Table 2 The expression of osteogenic signal at 2 hours after the end of BMMSCs in three groups ±s
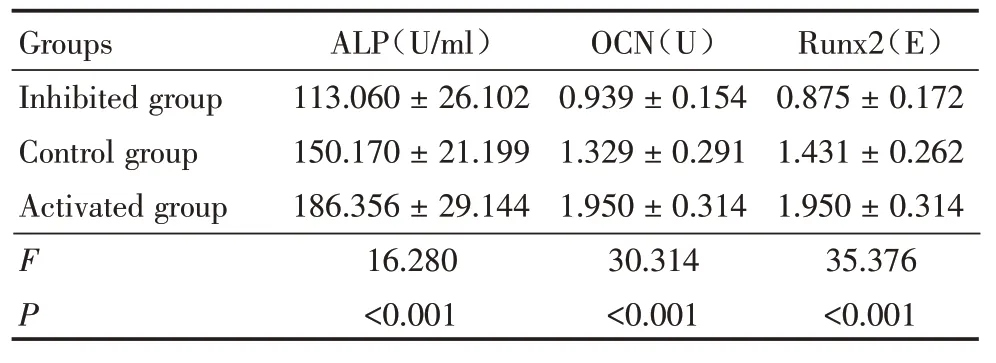
表2 3 组BMMSCs 加力结束后2 h 成骨信号表达情况Table 2 The expression of osteogenic signal at 2 hours after the end of BMMSCs in three groups ±s
Groups Inhibited group Control group Activated group F P ALP(U/ml)113.060±26.102 150.170±21.199 186.356±29.144 16.280<0.001 OCN(U)0.939±0.154 1.329±0.291 1.950±0.314 30.314<0.001 Runx2(E)0.875±0.172 1.431±0.262 1.950±0.314 35.376<0.001
mTOR 是一种保守的丝/苏氨酸蛋白质激酶,在细胞多种生理活动的调控中处于核心地位,使得mTOR 信号通路成为近年基础与临床研究的热点[7-8]。mTOR 需要在细胞内与其它分子形成复合物而保持生物学活性,目前发现主要有两种复合物:mTORCl 和mTORC2。其中研究较多的是mTORCl由mTOR、Raptor 和mLST8,该信号通路蛋白能接受激素、生长因子、应激等刺激,并对rapamycin 敏感[7]。S6K 和真核细胞翻译启始因子4E 结合蛋白l是mTORCl 的主要效应分子。 近年来发现mTORC1 信号通路在成骨过程中起着重要的作用。研究发现发现mTORC1/Raptor 是早期成骨分化所必需的因子[9],并通过促进Runx2 表达来诱导成骨发育[10]。但在大鼠骨折模型及小鼠转基因动物模型发现抑制mTOR 信号却能够促进成骨[11-14]。
本研究发现在形变量为10%的单轴周期牵张力下mTORCl 信号通路的主要信号分子(mTOR、Raptor、S6K)在加力后8 h 内均能被检测,并且发现具有活性的磷酸化分子的表达有动态表达,均在2 h 达到峰值后逐渐下降,这与检测到成骨指标(ALP、OCN 和Runx2)具有相似的表达变化。Zeng等[15]发现周期性张应力能够通过激活mTOR/S6k信号通路促进人成骨样细胞的能量代谢。另外,有研究使用大鼠下颌骨牵张模型发现,p-mTOR 阳性表达升高;对体外培养下颌骨来源BMMSCs 使用Flexcell 加力(6%)模拟牵张成骨发现mTOR、Raptor、p70S6k 等基因水平明显升高。这与本研究结果相似,说明mTORCl 信号通路参与了细胞张应力下成骨过程中。为了进一步研究其在该过程中的作用,本研究利用MHY1485(细胞渗透性mTOR 激动剂)和PP242(通过阻断细胞中负反馈、激活AKT途径来抑制mTORC1 和mTORC2 的新型抑制剂)改变内源性mTORCl 信号表达强度,通过对mTORCl信号下游主要效应分子S6K 表达发现工具药能够增强或抑制内源性mTORCl 信号的表达。随后发现mTORCl 信号被抑制后成骨信号也明显减弱,而激活该信号后成骨活性明显增强,提示mTORCl 信号通路在张应力下细胞成骨的过程中处于核心地位。下一步通过对mTORCl 信号通路在细胞张应力下成骨中的具体分子机制的研究不仅能够完善牵张成骨的机制,也有望成为治疗牵张成骨的靶点之一。

