水飞蓟宾对C2C12细胞胰岛素抵抗的影响及机制研究*
秦 帅 ,吴丽丽 ,秦灵灵 ,张程斐 ,吴呦呦 ,孙伯菊 ,刘铜华 ,**
(1. 成都中医药大学临床医学院 成都 610036;2. 北京中医药大学教育部中医养生学重点实验室 北京 100029;3. 北京中医药大学东方医院 北京 100078)
由于环境污染、久坐缺乏运动、高热卡饮食、人口老龄化等因素的影响使得2 型糖尿病(type 2 diabetic mellitus,T2DM)在全世界范围流行。第9 版《全球糖尿病地图(IDF Diabetes Atlas)》显示全球现有糖尿病患者4.63 亿人,预计到2030 年,该数字将达到5.78亿[1,2]。而我国更成为糖尿病患者最多的国家。T2DM作为全球流行的主要慢性代谢性疾病之一,其发病核心病机是胰岛素抵抗和胰岛β细胞功能不足。T2DM的发生与胰岛素抵抗(insulin resistance,IR)密切相关,IR 贯穿T2DM 的整个过程。因此从天然植物中发现可改善胰岛素抵抗的药物成为研究热点。
水飞蓟宾是从植物水飞蓟(Silybum marianum)中提取的水飞蓟素的黄酮木脂素成分。临床常用其抗氧化和保肝特性治疗肝功能异常疾病[3]。近年来越来越多的研究发现其具有抗肥胖、降脂、抗糖尿病、抗动脉粥样硬化,防治糖尿病并发症等作用[4-7]。作为葡萄糖摄取和储存的主要部位,骨骼肌摄取的葡萄糖约占全身葡萄糖摄取总量的75%[8]。近年来研究发现肌肉组织胰岛素抵抗与STAT3 的磷酸化水平及SOCS3 蛋白表达水平与呈正相关。由棕榈酸钠暴露导致L6 肌管中STAT3 的磷酸化,同时SOCS3 的蛋白丰度增加产生胰岛素抵抗,而STAT3 基因沉默可降低SOCS3 蛋白水平,并改善胰岛素抵抗[9]。研究发现水飞蓟宾作为STAT3 的抑制剂应用于癌症、免疫性等疾病的治疗[10,11]。但水飞蓟宾能否可以通过抑制STAT3/SOCS3信号通路改善肌肉组织胰岛素抵抗尚不明确。本研究应用C2C12 成肌细胞为模型,研究水飞蓟宾对C2C12胰岛素抵抗的影响,并探讨其作用机制。
1 实验材料
1.1 主要仪器
R200D 型分析天平(德国赛多利斯),Sigma 台式高速低温冷冻离心机(Sigma-Aldrich 公司),HDL 型超净工作台(北京东联哈尔仪器制造有限公司),HERA Cell 150i CO2 孵育箱(美国Thermo Scientific),酶标仪(美国 Promega 公司),IX71 倒置显微镜(日本Olympus)。
1.2 实验细胞
C2C12细胞株由北京中医药大学教育部中医养生学重点实验室提供。
1.3 主要试剂及材料
水飞蓟宾(上海源叶生物技术有限公司,纯度>98%),DMEM 高糖培养基(美国Gibco),青霉素-链霉素混合液(Biotopped),胎牛血清(foetal bovine serum,FBS,ORIGIN 公司),马血清(天津康源生物技术有限公司),胰蛋白酶-EDTA 溶液(Biotopped),二甲基亚砜(dimethylsulfoxide,DMSO,北京Solarbio),棕榈酸(北京Solarbio),葡萄糖测试盒(南京建成生物工程研究所),细胞计数试剂盒CCK-8(日本同仁化学),全蛋白提取试剂盒(强)(北京Solarbio),BCA蛋白定量试剂盒(北京 Solarbio);TNF-α,IL-β及 IL-10 ELISA 检测试剂盒(上海优维宁生物有限公司),抗体P-STAT3、SOCS3、β-actin(美国 CST),Blocking one 及 Blocking one-P(日本Nacalai Tesque),30%蛋白凝胶溶液(北京拜尔迪生物技术有限公司),Solution1(日本TOYOBO),Solution2(日本TOYOBO),96及6孔细胞培养板(美国Corning)。
2 方法
2.1 C2C12细胞培养
用含10%FBS 和1%青-链霉素的DMEM 培养基,放置于37℃,5%CO2 的细胞培养箱中培养,隔日更换1 次培养液,待细胞密度覆盖培养皿80-90%时,用胰蛋白酶溶液消化2 min,1:3 传代2-3 次后用于后续实验。
2.2 水飞蓟宾对C2C12细胞增殖能力的影响
实验设空白组、正常组、对照组(含DMSO 100μg·mL-1)、不同浓度水飞蓟宾药物处理组(150μmol·L-1、100 μmol·L-1、50μmol·L-1、30 μmol·L-1、20 μmol·L-1、15μmol·L-1、10μmol·L-1、5μmol·L-1),其中空白组为不含药物及细胞的培养基、正常组为含细胞的完全培养基。将生长至80-90%的C2C12 细胞以3 × 104/mL的密度接种于 96 孔板,200μL/孔,设 6 个复孔,放置细胞培养箱培养24 h后,然后加10μL/孔CCK-8,置于细胞培养箱中反应90 min,置酶标仪中测定吸光度(波长为450 nm),读取数值。
细胞存活率:存活率=(给药组/对照组- 空白组)/(正常组-空白组)×100%
2.3 建立C2C12细胞胰岛素抵抗模型
将生长至 80-90% 的 C2C12 细胞以 5 × 104/mL 的细胞密度接种于6 孔细胞培养板,2 mL/孔,培养2 天,待细胞融合度达到85%以上时,换用含2%马血清的DMEM 诱导培养4 天,隔日更换1 次培养液,直至85%以上的成肌细胞分化为肌管即成熟肌细胞。将分化的肌管细胞分为正常组(Normal)和造模组(Control),正常组用含10%胎牛血清的高糖培养基培养,造模组用 0.5 mmol·L-1棕榈酸造模液培养 16 h[12]。
2.4 水飞蓟宾对胰岛素抵抗C2C12 细胞葡萄糖摄取能力的影响
采用上述方法建立C2C12 胰岛素抵抗模型,弃培养基,用PBS 洗2 次,设正常组、模型组及不同浓度的水飞蓟宾组,其中正常组为不含胎牛血清的DMEM 高糖培养基,设6个复孔,放置于37℃,5%CO2细胞培养箱中培养24 h后弃旧培养基,用PBS洗2次,换不含胎牛血清DMEM 培养基培养6 h,用葡萄糖测试盒测定各组C2C12 细胞培养液中葡萄糖含量,进一步计算葡萄糖消耗量。
葡萄糖消耗量=总葡萄糖含量-不同处理组葡萄糖含量。
2.5 水飞蓟宾对C2C12 细胞分泌 TNF-α、IL-β 及 IL-10的影响
收集2.4 中各组C2C12 细胞培养液,4℃,800 g,离心10 min,收集上清。用ELISA 试剂盒检测TNF-α、IL-β及IL-10炎性因子水平。
2.6 水飞蓟宾对C2C12 细胞P-STAT3、SOCS3 蛋白表达影响
收集2.4 中不同处理组的C2C12 细胞,用全蛋白提取试剂盒提取各组C2C12 细胞总蛋白。用BCA 蛋白定量试剂盒进行蛋白定量,加PBS 和2×蛋白上样缓冲液调整各组蛋白至统一浓度,100℃煮沸5 min 后置-20℃保存备用。
根据蛋白浓度,确定蛋白上样量为20μg/孔,先80 V 预电泳 10 min,再 100 V 电泳 90 min。将 PVDF 膜置于甲醇中活化1 min,用半干法凝胶转膜法恒流200 mA 转膜 30 min,用 1 × TBS 摇床室温洗 3 次,每次 10 min,Blocking one 或 Blocking one-P 室温封闭 1 h,分别加 P-STAT3、SOCS3 和β-actin(1∶1000 稀释)4℃孵育过夜。次日回收一抗,用1×TBST摇床室温清洗3次,每次10 min,加二抗(1∶5000)室温孵育1 h,回收二抗,用1×TBST 摇床室温清洗3 次,每次10 min。加超敏发光液,避光反应1 min,凝胶成像系统显影。用Image J软件对灰度值进行分析。
2.7 数据分析
采用Graphpad Prism 6 统计软件进行数据分析,数据用平均值±标准差()来表示。多组间比较采用One-way ANOVA;两组间比较,当满足方差齐性时用LSD 检验,当不满足方差齐性时用非参数检验;P<0.05表示有统计学差异,P<0.01表示有极显著差异。
3 结果
3.1 水飞蓟宾对C2C12细胞增殖能力的影响
CCK-8 检测结果显示(图1):当水飞蓟宾浓度大于 20μmol·L-1时水飞蓟宾影响 C2C12 细胞增殖能力,当浓度在30μmol·L-1时,细胞存活率仅为87.65%,当浓度高于 30μmol·L-1时,C2C12 细胞的生长增殖能力明显降低,且浓度越高,存活率越低;而当浓度低于30μmol·L-1时,细胞存活率接近于100%,故选5μmol·L-1、10μmol·L-1和 20μmol·L-1浓 度 用 于 后 续 实 验研究。
3.2 水飞蓟宾对胰岛素抵抗C2C12 细胞葡萄糖摄取能力的影响
由表 1 知,与 Normal 组比较,Control 组的葡萄糖消耗量明显降低(P< 0.01),说明Control 组C2C12 细胞对葡萄糖的摄取能力下降,成功建立C2C12 细胞胰岛 素 抵 抗 模 型 。 而 与 Control 组 比 较 ,5μmol·L-1、10μmol·L-1、20μmol·L-1水飞蓟宾组均较 Control 组葡萄糖消耗量明显增加(P<0.01),且呈剂量依赖性,葡萄糖消耗量分别增加了33.5%、45.3%与67.1%。说明水飞蓟宾可增加C2C12 细胞对葡萄糖的摄取能力,改善C2C12细胞胰岛素抵抗。
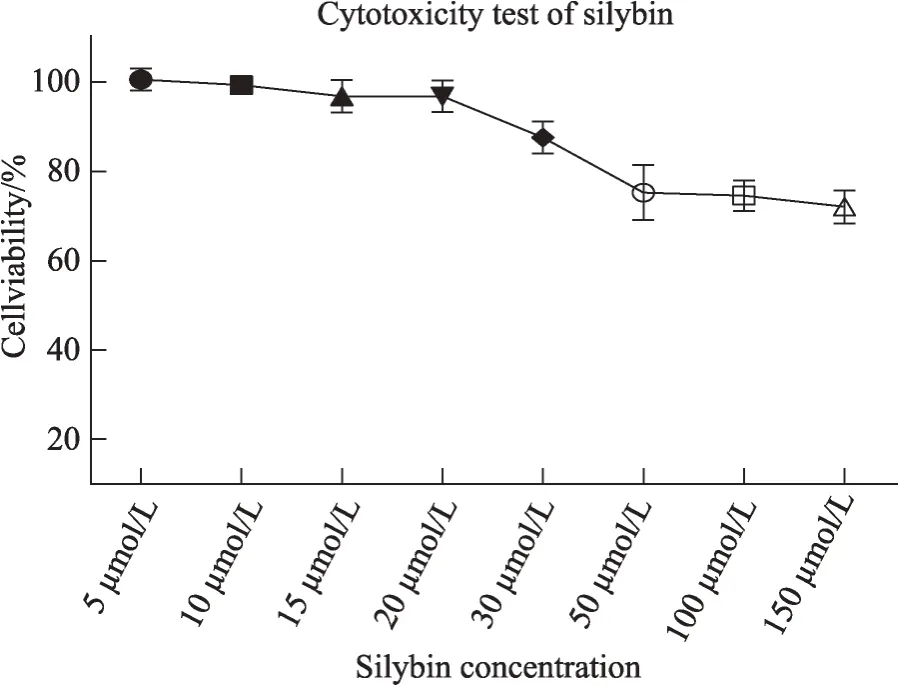
图1 水飞蓟宾对C2C12细胞增殖能力的影响
表1 水飞蓟宾对C2C12细胞葡萄糖消耗量的影响()
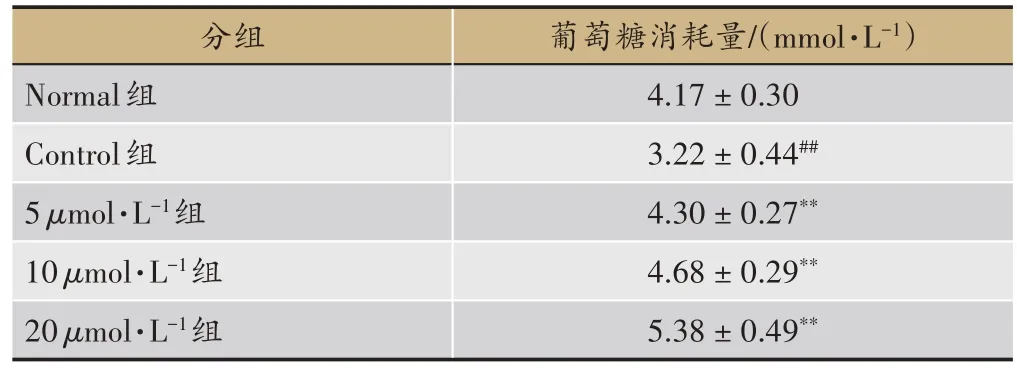
表1 水飞蓟宾对C2C12细胞葡萄糖消耗量的影响()
注:与Control 组对比,*P < 0.05;**P < 0.01;Control 组与 Normal 组对比,#P < 0.05,##P < 0.01(n=6)。
葡萄糖消耗量/(mmol·L-1)4.17±0.30 3.22±0.44##4.30±0.27**4.68±0.29**5.38±0.49**分组Normal组Control组5 μmol·L-1组10 μmol·L-1组20 μmol·L-1组
表2 水飞蓟宾对TNF-α、IL-β、IL-10炎性因子的影响()
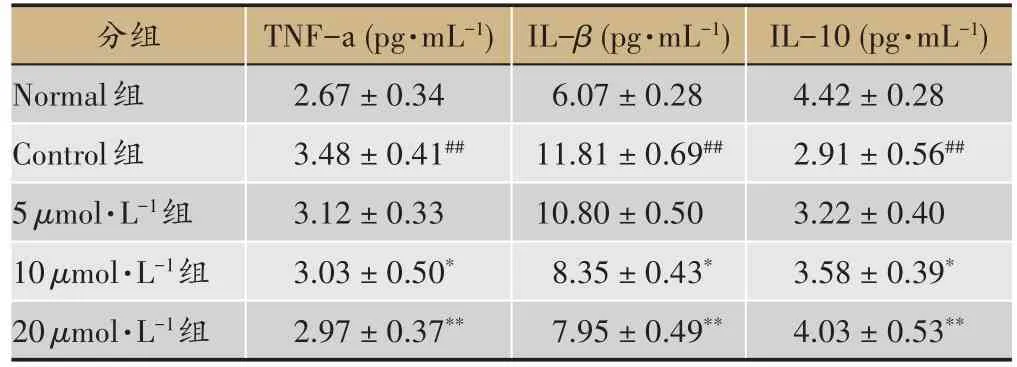
表2 水飞蓟宾对TNF-α、IL-β、IL-10炎性因子的影响()
注:与Control 组对比,*P < 0.05;**P < 0.01;Control 组与 Normal 组对比,#P < 0.05,##P < 0.01(n=6)。
IL-10(pg·mL-1)4.42±0.28 2.91±0.56##3.22±0.40 3.58±0.39*4.03±0.53**分组Normal组Control组5 μmol·L-1组10 μmol·L-1组20 μmol·L-1组TNF-а(pg·mL-1)2.67±0.34 3.48±0.41##3.12±0.33 3.03±0.50*2.97±0.37**IL-β (pg·mL-1)6.07±0.28 11.81±0.69##10.80±0.50 8.35±0.43*7.95±0.49**
3.3 水飞蓟宾对C2C12 细胞分泌TNF-α、IL-β、IL-10炎性因子的影响
由表 2 知,与 Nromal 组比较,Control 组 TNF-α和IL-β水平明显提高(P< 0.01),说明Control 组促炎因子水平明显提高,而抗炎因子IL-10 水平明显减低(P< 0.01)。与 Control 组比较,5μmol·L-1、10μmol·L-1及 20 μmol·L-1水飞蓟宾组可降低 Control 组 TNF-α和IL-β水平,并提高IL-10水平,其中20μmol·L-1可显著减低TNF-α和IL-β水平(P< 0.01),同时提高IL-10水平(P<0.01)。说明水飞蓟宾可抑制C2C12 胰岛素抵抗模型炎症因子分泌。
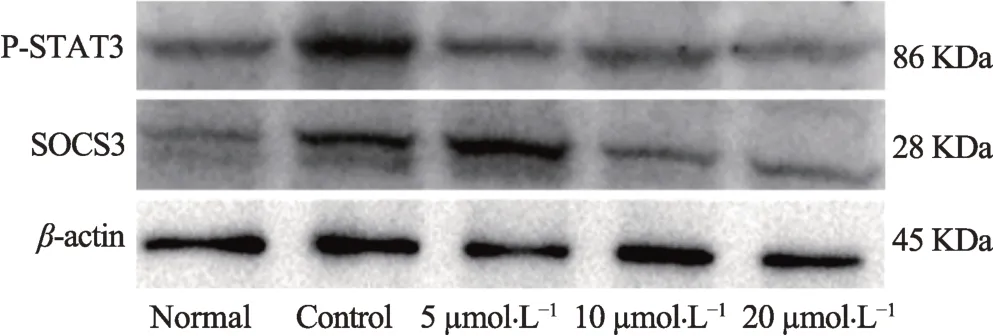
图2 水飞蓟宾对C2C12细胞P-STAT3、SOCS3蛋白的影响
表3 水飞蓟宾对C2C12细胞P-STAT3、SOCS3蛋白表达影响(,n=6)

表3 水飞蓟宾对C2C12细胞P-STAT3、SOCS3蛋白表达影响(,n=6)
注:与 Control 组对比,*P < 0.05;**P < 0.01;Control 组与 Normal 组对比,#P < 0.05,##P < 0.01。
SOCS3/β-actin 0.744±0.042 1.011±0.057##0.951±0.064 0.802±0.050*0.784±0.055**分组Normal组Control组5 μmol·L-1组10 μmol·L-1组20 μmol·L-1组P-STAT3/β-actin 0.445±0.051 0.699±0.062##0.607±0.047 0.588±0.050*0.532±0.046**
3.4 水飞蓟宾对C2C12 细胞P-STAT3、SOCS3 蛋白表达的影响
由图 2 和表 3 知,与 Normal 组比较,Control 组 PSTAT3 和 SOCS3 蛋白水平明显提高(P< 0.01)。与Control 组比较,5μmol·L-1、10μmol·L-1及 20μmol·L-1水飞蓟宾组可抑制STAT3 磷酸化水平,进而降低SOCS3蛋白表达水平。
4 讨论
作为全世界最主要的慢性非传染性疾病之一,糖尿病及其并发症给患者带来沉重的经济和心理负担,严重影响患者的生活及生存质量。自从Hotamisligil等[13]报道在肥胖和T2DM 啮齿动物模型的脂肪组织中存在TNF-α,证明了肥胖、T2DM 和炎症之间存在联系。他们证明在肥胖的fa/fa 大鼠中敲除TNF-α可以改善了胰岛素敏感性。此外,若敲除TNF-α或TNF 受体的糖尿病模型小鼠可提高胰岛素敏感性,降低血糖[14,15]。研究表明多种促炎细胞因子如TNF-α、IL-1β破坏了肥胖症的胰岛素作用并导致胰岛素抵抗[16]。TNF-α通过增强脂肪细胞的脂解作用,调控IKKβ/NF-κB信号通路,同时激活STAT3,增加胰岛素受体底物1(IRS1)的丝氨酸/苏氨酸磷酸化而引起胰岛素抵抗[17]。
IL-10 作为一种重要的抑炎细胞因子,主要由巨噬细胞产生[18]。多项研究表明IL-10 小鼠骨骼肌和成肌细胞中表达,其通过抑制巨噬细胞的活化和阻断抗原的递呈以及炎性细胞因子如TNF-α、IL-1β的释放和活化来抑制炎症反应,从而减少全身及肌肉组织等局部炎症,改善骨骼肌的胰岛素信号通路和肌肉组织对葡萄糖摄取及利用,改善胰岛素抵抗[19-21]。研究发现若过表达骨骼肌中IL-10可以改善饮食诱导的小鼠胰岛素抵抗[22]。
已知STAT 是一个转录因子家族,与其他STAT 蛋白相比,STAT3 具有更高的保守性,是最原始、最普遍的STAT 类型[23]。STAT3 的激活可由多种不同类型的刺激引起,如细胞炎症因子、生长因子、致癌物、氧化应激、感染和辐射。其参与细胞因子和营养物质诱导的胰岛素抵抗[24]。研究发现T2DM 患者STAT3 磷酸化水平提高,而升高的P-STAT3 影响骨骼肌胰岛素信号转导和外周组织如肌肉对葡萄糖摄取,从而引起胰岛素抵抗[25]。
细胞因子信号传递的抑制因子家族(SOCS)最初在1997年被发现,它是一种参与负反馈回路以减弱细胞因子作用的分子[26,27]。在肥胖或者糖尿病患者种,各种组织中SOCS 蛋白的表达升高,这对调节新陈代谢和胰岛素敏感性至关重要。其家族中的SOCS1 和SOCS3 在肌肉高表达,可通过竞争胰岛素受体上的磷酸酪氨酸结合位点来阻止胰岛素诱导的IRS蛋白的激活,从而诱发胰岛素抵抗[28,29]。而STAT3 沉默可下调T2DM 患者 SOCS1 和 SOCS3 的蛋白丰度,从而增强IRS-1 和IRS-2 的酪氨酸磷酸化,从而增强Akt信号通路改善胰岛素抵抗[30]。
水飞蓟宾是一种传统上用于治疗胆囊和肝脏疾病的黄酮寡糖,近年来诸多研究发现水飞蓟宾可通过改善胰岛β细胞的活性,增加肝脏和肌肉细胞的胰岛素敏感性以及减少脂肪细胞中的脂质沉积来改善血糖[31-33]。此外,水飞蓟宾还能有效治疗糖尿病并发症,包括神经病变[34]、视网膜病变、愈合障碍[35]、心肌病、肾病和骨质疏松症等[36-38]。本实验结果发现水飞蓟宾可增加C2C12 胰岛素抵抗模型葡萄糖消耗量,同时抑制促炎因子TNF-α、IL-1β的分泌,提高抑炎因子IL-10分泌,降低P-STAT3和SOCS3蛋白表达。
综上所述水飞蓟宾可能通过抑制TNF-α、IL-1β炎症因子分泌,促进抑炎因子IL-10 分泌和调控STAT3/SOCS3信号通路来改善C2C12细胞胰岛素抵抗。

