甲炎康泰对自身免疫性甲状腺炎大鼠T-bet/GATA3的影响*
张程斐,王明慧,孙伯菊,吴 悠,秦 帅,吴丽丽 ,秦灵灵 ,刘铜华 **
(1. 北京中医药大学东方医院 北京 100078;2. 陕西中医药大学第一临床医学院 咸阳 712000;3. 成都中医药大学临床医学院 成都 610075;4. 北京中医药大学教育部中医养生学重点实验室 北京 100029;5. 北京中医药大学中医养生学研究所 北京 100029;6. 北京中医药大学科技处 北京 100029)
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是器官特异性自身免疫疾病,因免疫功能的紊乱导致甲状腺自身抗体的产生,继而诱发淋巴细胞的浸润,甲状腺组织结构破坏与功能减退为其主要特征。血清中甲状腺球蛋白抗体(TgAb)与甲状腺过氧化物酶抗体(TPOAb)的高表达是AIT自身抗体的主要表现[1]。且在光镜下见甲状腺组织内炎性浸润和不同程度的甲状腺滤泡损坏[2]。临床上通过甲状腺自身抗体以及影像学等检查来确诊。AIT 中年女性多发,且近年患病率呈上升趋势[3]。其可合并其他自身免疫性疾病,如肾上腺功能不全,恶性贫血等,严重影响患者的生活质量。
甲炎康泰是刘铜华教授治疗自身免疫性甲状腺炎多年总结的临床经验方,经甲炎康泰治疗6 个月后临床疗效评定,TPOAb 总有效率为94.44%,TgAb 总有效率为97.22%[4],甲炎康泰治疗AIT临床疗效确切。
前期研究发现,甲炎康泰可下调AIT 模型大鼠血浆细胞因子IL-4、IL-5、TNF-α、IFN-γ、IL-1α的表达水平,从而下调Th1/Th2比率以恢复Th1/Th2细胞免疫平衡并维持内环境稳态[5]。
T-bet(T-box expressed in T cells)是重要的Th1 转录因子,可对Thl 细胞的分化及效应功能发挥重要的作用;GATA3(GATA-binding protein-3)则在Th2 细胞的发育中起到关键的作用。T-bet 和GATA3 对Th1/Th2细胞进行调控,并在分化过程中起重要作用[6]。T-bet 和GATA-3 能直接反映机体Th1/Th2 细胞平衡状态[7]。但甲炎康泰对AIT 模型大鼠Th1/Th2 细胞中转录因子T-bet和GATA3的作用如何?这方面仍未揭示清楚,本次实验以AIT 模型大鼠Th1/Th2 细胞中转录因子 T-bet 和 GATA3 为靶点,从调控 Th1/Th2 细胞中转录因子T-bet 和GATA-3 等途径切入,探讨甲炎康泰是否通过调节转录因子T-bet 和GATA3 而调控了Th1/Th2细胞免疫平衡的作用及机制。现总结如下。
1 实验材料
1.1 实验动物
SPF 级雌性 Lewis 大鼠 50 只,4 - 5 周龄,体质量85 ± 10 g。购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。
1.2 实验药物
黄芪、夏枯草、郁金、穿山龙、柴胡、乌梅、浙贝母、山慈菇、玄参颗粒剂,溶于100 mL 双蒸水中制成药物混悬液,于4℃储藏,甲炎康泰专利号:CN1064216 33A。
1.3 主要试剂及配制方法
猪甲状腺球蛋白(Sigma,批号:018K7012)、弗氏完全佐剂(Sigma,批号:SLBW7430)、弗氏不完全佐剂(Sigma,批号:SLBZ0619)、碘化钠(Maya-R,CAS 号:7681-82-5,99% AR)、T-bet 一 抗(Cell Signaling Technology)、GATA3 一抗(Cell Signaling Technology)、TBET-F:CAACAACCCCTTTGCCAAAG(上海生工,批号:2012383040)、TBET-R:TCCCCCAAGCAGTTGACAGT(上海生工,批号:2012383041)、GATA3-F:TGGGCTCTACTACAAGCTTCACAATAT(上海生工,批号:2012383038)、GATA3-R:TTGCTAGACATTTTTCGGTTTCTG(上海生工,批号:2012383039)、RNGAPDH-F:AggTCggTgTgAACggATTTg(上海生工,批号:BN61204-0001)、RN-GAPDH-R:TgTAgACCATg-TAgTTgAggTCA(上海生工,批号:BN61204-0002)。
碘化钠溶液制备:于100 mL 双蒸水中加入64 mg碘化钠,制成0.064%的NaI 溶液。现用现配,注意避光。乳化剂的配制:首先用PBS 配制需要量为浓度0.1%的猪甲状腺球蛋白(porcine thyroglobulin,PTg),再与弗氏完全佐剂(Freund's complete adjuvant,FCA)等容积比例混合,制成乳剂。Tg 终浓度为0.05%,即100 μg Tg/0.2 mL 乳化剂。弗氏不完全佐剂(Freund’s incomplete adjuvant,FIA)配制方法同FCA。
1.4 主要仪器
低温高速离心机(Beckman公司)、OLYMPUS BH-2 光镜(日本)、高温干燥箱(FD53,Binder,德国)、手术相关器械。
2 实验方法
2.1 造模与分组
自身免疫性甲状腺炎大鼠模型制作[8]方法:正常对照组10只大鼠自由饮用双蒸水,其余鼠均造模。造模鼠适应性喂养1 周后,自由饮用0.064% NaI 溶液直至取材结束。第3 周各组造模鼠接受初次免疫:大鼠颈部皮下、足垫和背部皮下多点注射猪甲状腺球蛋白合弗氏完全佐剂每次每只0.2 mL,共2 次,间隔4 天。第4 周至第8 周于同样部位多点注射猪甲状腺球蛋白合FIA 每次每只0.2 mL,每周1 次。第8 周结束,眶静脉取血离心取上清,酶联免疫吸附法(Elisa)检测血清中TgAb、TPOAb抗体表达水平,以验证造模是否成功。
2.2 给药方法
造模成功后,各组大鼠给药量参照人与动物之间体表面积比例表折算,正常、模型组大鼠每日予以0.9 mL/100 g 双蒸水,甲炎康泰低(0.708 g·kg-1)、中(1.417 g·kg-1)、高(2.834 g·kg-1)剂量组大鼠每天予以同体积药物混悬液且连续灌胃8周,给药期间继续造模。
2.3 检测指标及方法
2.3.1 RT-PCR 检测各组大鼠脾脏中T-bet、GATA3 mRNA的表达情况
-80℃超低温冰箱取大鼠脾脏组织,利用Trizol 法获取脾脏组织总RNA,进行反转录采用GoScriptTMReverse Transcription System 试剂盒,退火 25℃ 5 min,延伸42℃ 1 h,灭活70℃ 15 min,得到cDNA;建立20 uL反应体系包含:0.8 uL 引物混合物、7.2 uL Nuclease-Free Water以及10 uL GoTaq反应液加2 μL cDNA稀释液。将其置于7500 Real Time PCR System 运行反应,运行过程为:95℃ 10 min,95℃ 15 s,60℃ 1 min(共40次循环);95℃ 15 s,60℃ 15 s 溶解。比较各组目标mRNA的表达差异采用2-△△CT相对定量法。
2.3.2 Western Blot 检测各组大鼠脾脏中T-bet、Gata3蛋白的表达情况
脾脏组织蛋白提取及BCA 法蛋白定量→制胶及上样→电泳→蛋白质的电转移和膜封闭→抗原抗体反应及显影(一抗GATA3为1∶2000;T-bet为1∶500,二抗 GATA3 为 1∶2000;T-bet 为 1∶1000)→蛋白图像分析:IPP软件分析目的条带灰度值。
2.3.3 免疫组织化学分析
14 周后处死大鼠,取双侧甲状腺组织置入4%的多聚甲醛中,常规石蜡包埋切片。免疫组化检测主要步骤:切片脱蜡、水化,3%过氧化氢处理,高温抗原修复,山羊血清封闭,一抗4℃过夜,复温PBS 冲洗,滴加二抗,DAB 显色,苏木精染色,盐酸酒精分化,自来水冲洗,脱水,封片。光镜下观察并存取照片,采用Image-Pro Plus 6.0 进行吸光度检测,分析T-bet、GATA3的平均光密度(IOD/Area),进行统计学处理。
2.4 统计学方法
采用SPSS 20.0 统计软件处理数据,数据以均数±标准差()表示,组间比较采用方差分析,P< 0.05为差异有统计学意义。
3 结果
3.1 甲炎康泰对AIT 大鼠脾脏T-bet、GATA3 mRNA的表达变化
较正常组,模型组T-bet、GATA3 mRNA 表达均显著上升(P< 0.01);较模型组,甲炎康泰低、中、高剂量组T-bet、GATA3 mRNA 均下降,高剂量组具有显著意义,T-bet(P<0.01),GATA3(P<0.01)(表1)。
3.2 甲炎康泰对AIT 大鼠脾脏T-bet、GATA3 蛋白免疫印迹的表达变化
较正常组,模型组T-bet、GATA3 蛋白表达均显著上升(P< 0.01);较模型组,甲炎康泰低、中、高剂量组T-bet、GATA3 蛋白表达均下降,高剂量组具有显著意义,T-bet(P<0.05);GATA3(P<0.01)(表2、图1)。
3.3 甲炎康泰对AIT 大鼠脾脏T-bet、GATA3 蛋白免疫组化的表达变化
较正常组,模型组T-bet、GATA3 蛋白表达均显著上升(P< 0.01);较模型组,甲炎康泰低、中、高剂量组T-bet、GATA3 蛋白表达均下降,中剂量组 T-bet(P<0.05)、高剂量组 T-bet(P< 0.01)和中、高剂量组GATA3(P< 0.01)具有显著性意义(表3、图2、图3)。
表1 各组大鼠脾脏T-bet、GATA3 mRNA表达比较(,n = 6)
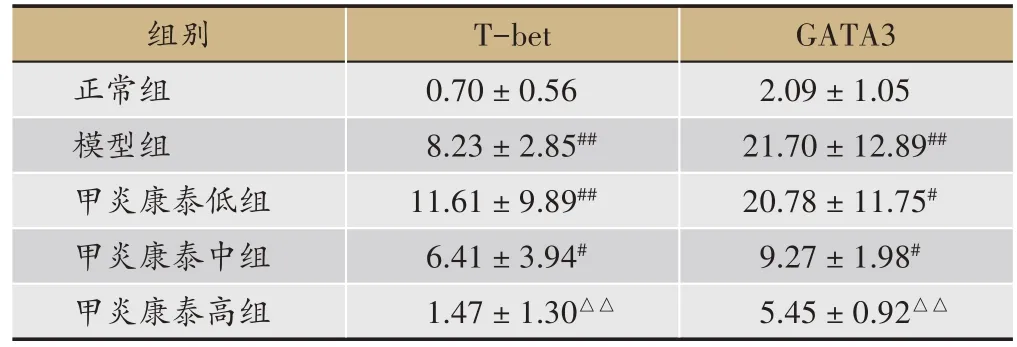
表1 各组大鼠脾脏T-bet、GATA3 mRNA表达比较(,n = 6)
注:#与正常组比较,P < 0.05;##与正常组比较,P < 0.01;△与模型组比较,P < 0.05;△△与模型组比较,P < 0.01。
组别正常组模型组甲炎康泰低组甲炎康泰中组甲炎康泰高组T-bet 0.70±0.56 8.23±2.85##11.61±9.89##6.41±3.94#1.47±1.30△△GATA3 2.09±1.05 21.70±12.89##20.78±11.75#9.27±1.98#5.45± 0.92△△
表2 各组大鼠脾组织中T-bet、GATA3蛋白表达的情况(,n = 6)
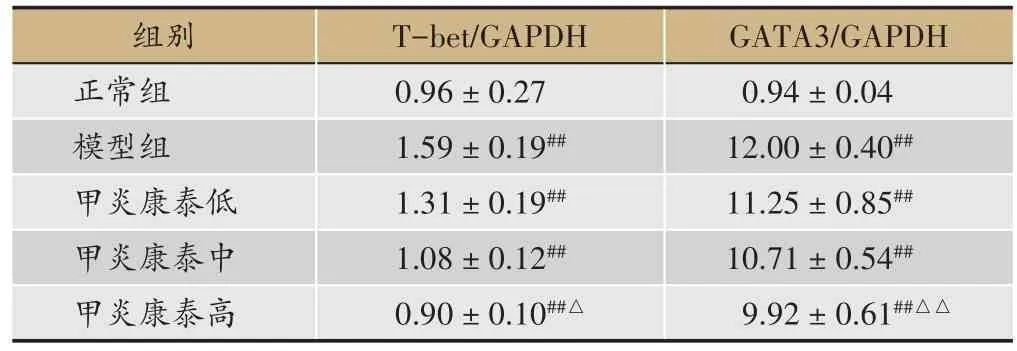
表2 各组大鼠脾组织中T-bet、GATA3蛋白表达的情况(,n = 6)
注:#与正常组比较,P < 0.05;##与正常组比较,P < 0.01;△与模型组比较,P < 0.05;△△与模型组比较,P < 0.01。
GATA3/GAPDH 0.94±0.04 12.00±0.40##11.25±0.85##10.71±0.54##9.92 ± 0.61##△△组别正常组模型组甲炎康泰低甲炎康泰中甲炎康泰高T-bet/GAPDH 0.96±0.27 1.59±0.19##1.31±0.19##1.08±0.12##0.90±0.10##△
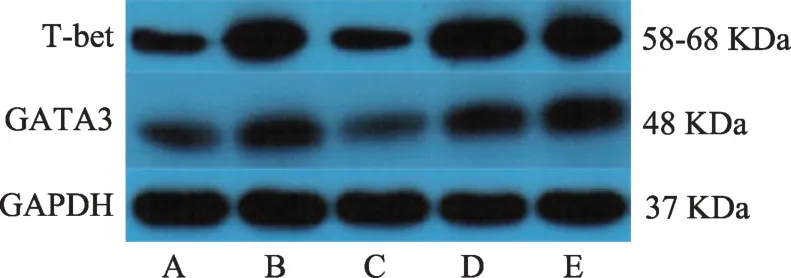
图1 甲炎康泰对AIT大鼠脾脏T-bet、GATA3蛋白表达的影响
表3 各组大鼠甲状腺组织T-bet、GATA3蛋白表达(,n = 6)
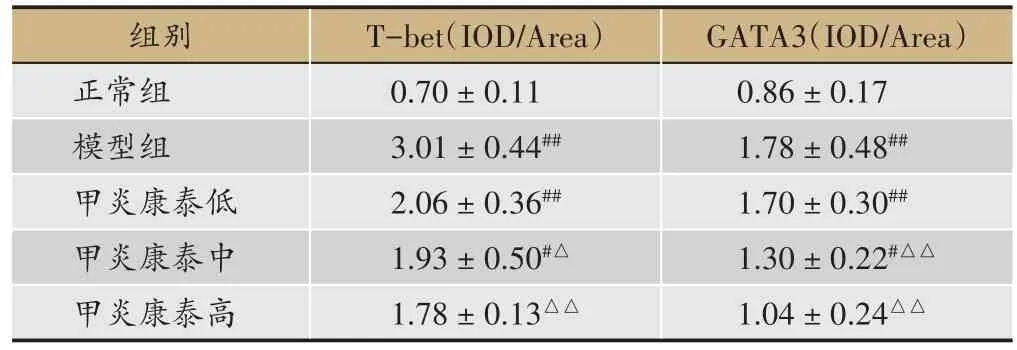
表3 各组大鼠甲状腺组织T-bet、GATA3蛋白表达(,n = 6)
注:#与正常组比较,P < 0.05;##与正常组比较,P < 0.01;△与模型组比较,P < 0.05;△△与模型组比较,P < 0.01。
GATA3(IOD/Area)0.86±0.17 1.78±0.48##1.70±0.30##1.30 ± 0.22#△△1.04±0.24△△组别正常组模型组甲炎康泰低甲炎康泰中甲炎康泰高T-bet(IOD/Area)0.70±0.11 3.01±0.44##2.06±0.36##1.93±0.50#△1.78± 0.13△△
4 讨论
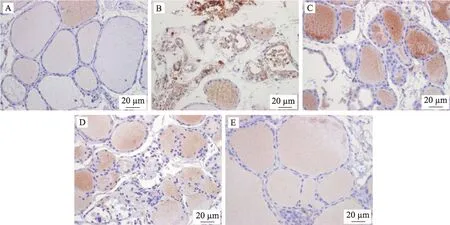
图3 甲炎康泰对AIT大鼠脾脏GATA3蛋白免疫组化的表达变化(200×)
生理状态下,辅助性T 细胞所分化的Th1、Th2 型细胞及其所分泌的细胞因子以网络动态形式相互协同或拮抗,来维持正常免疫应答以维护内环境处于稳态中[9]。当免疫系统被甲状腺组织内的特异性抗原激活后,体内T 细胞及所分泌的细胞因子形成的网络平衡即被打破,Th0 向 Th1 或 Th2 发生偏移[10]。其中,Th1型细胞特异转录因子T-bet 不仅可促进Th1 型细胞的生长发育,亦对Th2型细胞因子的合成起到抑制作用。并且T-bet可触发IFN-γ的基因转录,IFN-γ进一步促进T-bet 的表达水平,更一步促进Th0 进行分化成Th1型细胞;T-bet 亦可将成熟的Th2 型细胞转变成Th1 型细胞并产生IFN-γ,进一步影响Th 辅助细胞向Th1 发生偏移[11]。特异性转录因子GATA3为Th2型细胞转录所必须,其可直接激活IL-4 而促进Th2 型细胞的成形[12],是Th0细胞向Th2极化专有的转录因子[13]。可见,T-bet/GATA3 的表达与Th1/Th2 细胞免疫平衡关系密切,即T-bet/GATA3可调控Th1/Th2细胞免疫偏移。
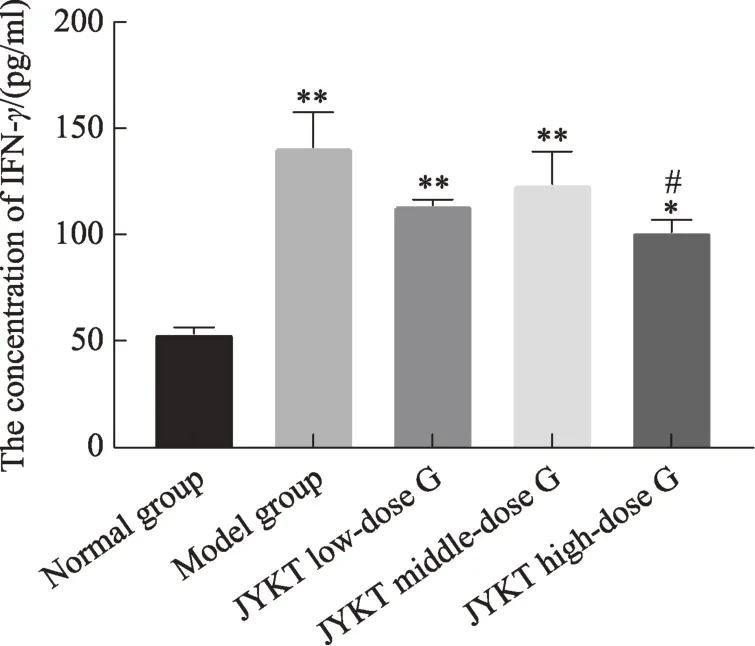
图4 甲炎康泰对AIT大鼠血清中IFN-γ浓度的变化
本次实验结果显示:与正常组比较,模型组T-bet、GATA3 mRNA 及蛋白表达均显著上升(P< 0.01)。即T-bet与GATA3均参与了自身免疫性甲状腺炎的发病机制。前期研究显示:在自身免疫性甲状腺炎的发病进程中,IFN-γ与IL-4 均上调(图4-5),提示IFN-γ与IL-4 的高表达可能与T-bet 与GATA3 的表达升高有关。本研究中,与模型组比较,甲炎康泰低、中、高剂量组T-bet、GATA3 mRNA 及蛋白均下降(P< 0.05,P< 0.01),即甲炎康泰可下调 T-bet、GATA3 表达水平。前期研究示:甲炎康泰可下调IFN-γ、IL-4表达水平与Th1、Th2 比例以纠正Th1/Th2 细胞免疫平衡偏移(图4-6),那么,甲炎康泰及其可能通过调控T-bet、GATA3 的表达而纠正了Th1/Th2 细胞免疫平衡偏移,以缓解自身免疫性甲状腺炎的发展。
综上所述研究结果提示,可以推测甲炎康泰可能通过影响T-bet/GATA3 信号通路,下调T-bet 的表达,抑制Th1 型免疫反应,减少 Th1 型细胞因子 IFN-γ的表达和分泌,以及下调GATA3,一定程度抑制Th2 型免疫反应,从而调控Th1/Th2细胞免疫平衡以缓解AIT的发展。但甲炎康泰是通过什么机制使T-bet、GATA3转录因子发生变化,还待进一步研究。
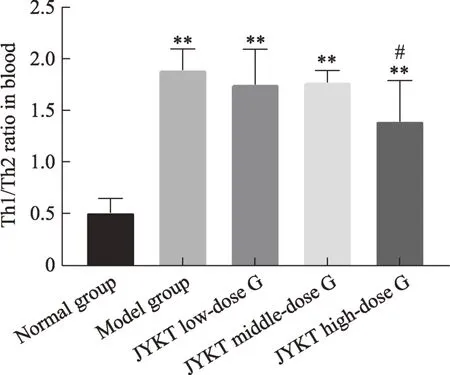
图6 甲炎康泰对AIT大鼠血清中Th1/Th2细胞比率的变化

