CCN1在脂多糖诱导急性肺损伤中的表达调控和在炎症反应中的作用*
董 年, 王蓓蓓▲, 宋晨剑, 陈俊杰, 陈成水△, 石 林
(1温州医科大学附属第一医院呼吸与危重症医学科, 浙江 温州 325000; 2复旦大学附属中山医院呼吸与危重症医学科, 上海 200000)
富半胱氨酸蛋白61(cysteine-rich protein 61,CYR61/CCN1)是即刻早期基因(immediate-early gene)编码的一种分泌型基质蛋白[1],属于CCN家族成员之一,与胚肺发育中的气管生成和上皮成熟相关[2]。近年来逐渐认识到CCN1作为一种分泌型基质蛋白不仅参与生理发育过程,而且作为即刻早期蛋白参与不同肺部疾病的发生发展与转归[3]。作为一种新近认识的炎症调节因子,细菌毒素、缺血缺氧和机械牵拉等不同病理条件刺激皆可以调控CCN1的快速时相表达,异常表达的CCN1又能以自分泌或旁分泌的方式参与炎症反应、损伤后修复等病理生理过程[4]。Dolinay等[5]报道,即刻表达的CCN1可作为机械通气相关肺损伤的一种敏感性生物标志物,Perkowski等[6]同样揭示了高氧相关肺损伤中存在即刻表达的CCN1,然而目前关于CCN1在急性肺损伤中的表达调控机制和多效性的生物功能仍亟待阐明。本研究拟在观察CCN1在正常肺组织中的表达定位和在脂多糖(lipopolysaccharides,LPS)诱导肺损伤小鼠肺组织中表达变化的基础上,探讨LPS调控CCN1表达的分子机制和CCN1在LPS诱导炎症介质表达中的作用,以CCN1为切入点深入揭示急性肺损伤的发病机制和寻找潜在的诊治靶点。
材 料 和 方 法
1 材料和仪器
6~8周20 g左右SPF级雄性C57BL/6小鼠购自北京维通利华实验动物技术公司,动物合格证号为SCXK(京)2016-0011。气道上皮细胞16HBE购自上海中科院细胞库。RPMI-1640培养液和胎牛血清购自Gibco;ERK1/2抑制剂PD98059、JNK抑制剂SP600125、P38抑制剂SB202190和PI3K抑制剂LY294002购自Sigma;BCA 蛋白浓度测定试剂盒、预染蛋白Marker和ECL 发光液购自Thermo;抗CCN1和GAPDH抗体购自Santa Cruz;重组CCN1蛋白购自PeproTech;cDNA逆转录试剂盒购自TaKaRa;TRIzol购自Invitrogen;CCN1-siRNA购自上海吉玛公司。RT-qPCR引物由上海生工生物工程公司设计合成,见表1。
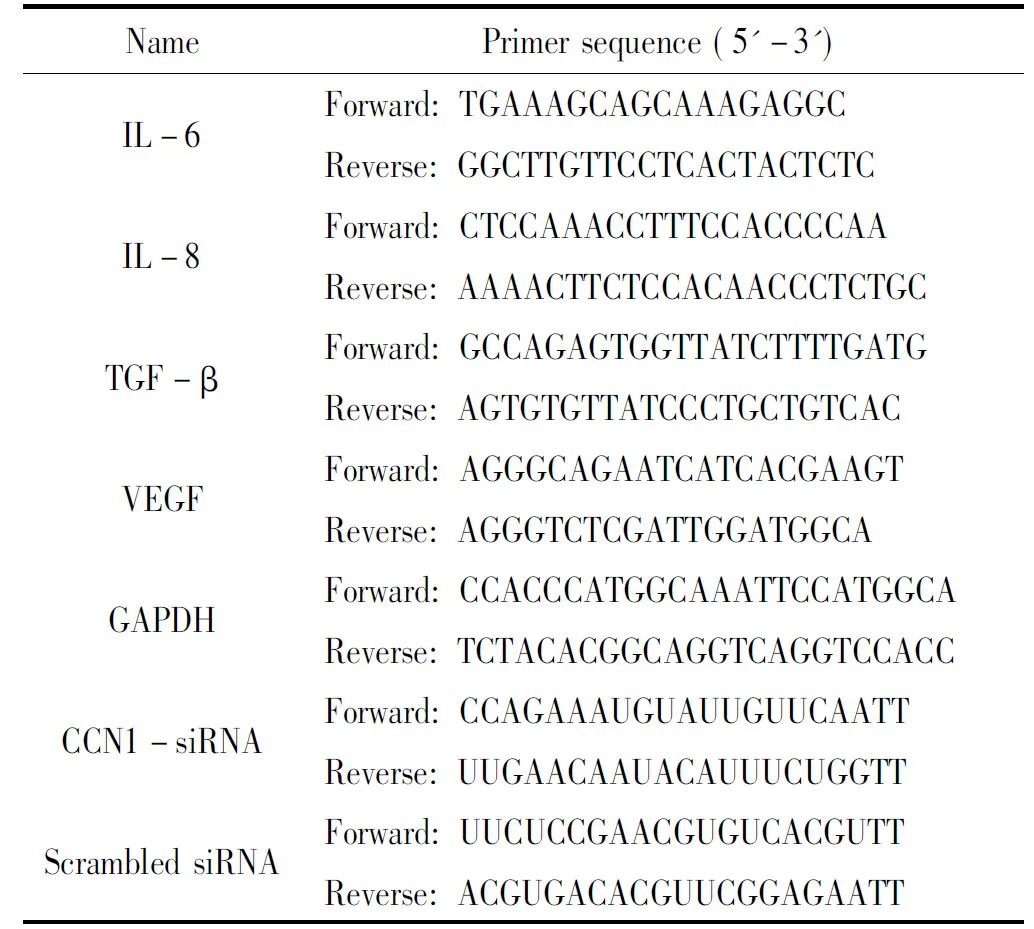
表1 RT-qPCR引物序列
2 实验方法
2.1动物模型复制 选取6~8周20 g左右SPF级雄性C57BL/6小鼠,麻醉后以静脉留置针经口气管插管,接1 mL针筒后以水柱随呼吸上下浮动作为插管成功标志。将LPS溶解于生理盐水中,造模组根据4 mg/kg的剂量给予LPS气道滴入,空白组给予等量的生理盐水气道滴入,造模成功4 h后麻醉处理动物获取肺组织。
2.2免疫组化染色 处死动物后获取肺脏组织石蜡切片,常规使用二甲苯脱蜡,双氧水处理去除内源性过氧化物酶,柠檬酸抗原组织抗原修复液处理切片修复抗原。常规血清封闭, I 抗4 ℃孵育过夜、II 抗室温孵育60 min,PBS清洗后使用DAB显色,以PBS代替 I 抗作为空白对照,中性树脂封片后显微镜进行摄片。
2.3免疫荧光染色 获取生长状况良好的对数生长期的16HBE细胞,玻璃爬片事先置于24孔板,24孔板每孔接种5×104个细胞,待次日细胞贴壁后4%多聚甲醛固定15 min,0.1% GEPAL穿孔破膜10 min,1% BSA封闭1 h,I抗4 ℃孵育过夜,II抗室温孵育0.5 h,DAPI染核5 min,封片激光共聚焦显微镜观察。
2.4RT-qPCR 获取生长状况良好的对数生长期的16HBE细胞,按照TRIzol说明书提取细胞总RNA,分光光度法测定计算提取的总RNA含量及浓度。取总RNA 2 μg反转录为cDNA,再以适量cDNA为模板进行real-time PCR。PCR条件为:95 ℃ 30 s;95 ℃ 5 s、60 ℃ 30 s,共40个循环。结果以GAPDH为内参照,针对目的基因进行相对定量。
2.5Western blot实验 获取生长状况良好的对数生长期的16HBE细胞,细胞裂解液RIPA裂解细胞提取蛋白,使用BCA测定蛋白浓度。获取取蛋白样品30 μg蛋白至SDS-PAGE,湿转至PVDF膜,5%脱脂牛奶室温下封闭2 h, I 抗4℃孵育过夜,TBST缓冲液洗膜3次,每次10 min,II抗室温孵育1.5 h,TBST缓冲液洗膜3次,每次10 min,ECL化学发光法显影,凝胶成像系统摄像分析条带灰度值。
2.6siRNA转染 获取生长状况良好的对数生长期的16HBE细胞,计数4×105个16HBE细胞接种于6孔板,每孔添加2 mL无抗生素的1640培养基,根据每孔8 μL的剂量获取siRNA/每孔4 μL的剂量获取Lipofectamine 2000分别添加入200 μL Opti-MEMⅠreduced serum medium比例稀释,将siRNA-Lipofectamine 2000混合后室温静置20 min,然后添加入每孔,6 h后转换为含血清RPMI-1640培养基进行后续实验。实验中涉及的siRNA序列见表1。
3 统计学处理
使用SPSS 20.0统计软件进行统计分析。数据均以均数±标准差(mean±SD),多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni校正的t检验,以P<0.05为差异存在统计学意义。
结 果
1 CCN1在气道上皮中的定位与表达
为探讨CCN1的组织定位情况,获取正常C57BL/6小鼠肺组织进行免疫组化染色,发现CCN1主要表达于小鼠气道上皮细胞,见图1A。同时对16HBE细胞进行CCN1免疫荧光染色也发现,气道上皮16HBE细胞可明显表达CCN1,且主要定位于胞浆,见图1B。
Figure 1.The location and expression of CCN1 in the bronchial epithelium. A: the location and expression of CCN1 in bronchial epithelial cells from normal lung tissue of mice detected by immunohistochemical (IHC) staining; B: immunofluoescence analysis of CCN1 in bronchial epithelial cells.
图1 CCN1在气道上皮中的定位与表达
2 LPS诱导气道上皮CCN1的表达升高
使用LPS气道滴入构建C57BL/6小鼠急性肺损伤体内模型,获取造模组肺组织后进行CCN1免疫组化染色,发现造模组气道上皮CCN1的表达强度相对于正常对照组升高,见图2A。使用LPS刺激16HBE细胞,分别利用RT-qPCR和Western blot对细胞中CCN1的mRNA和蛋白表达水平进行检测,结果发现CCN1表达水平呈LPS刺激浓度依赖性升高,其中以1 mg/L浓度刺激最为明显(P<0.05),见图2B、C。
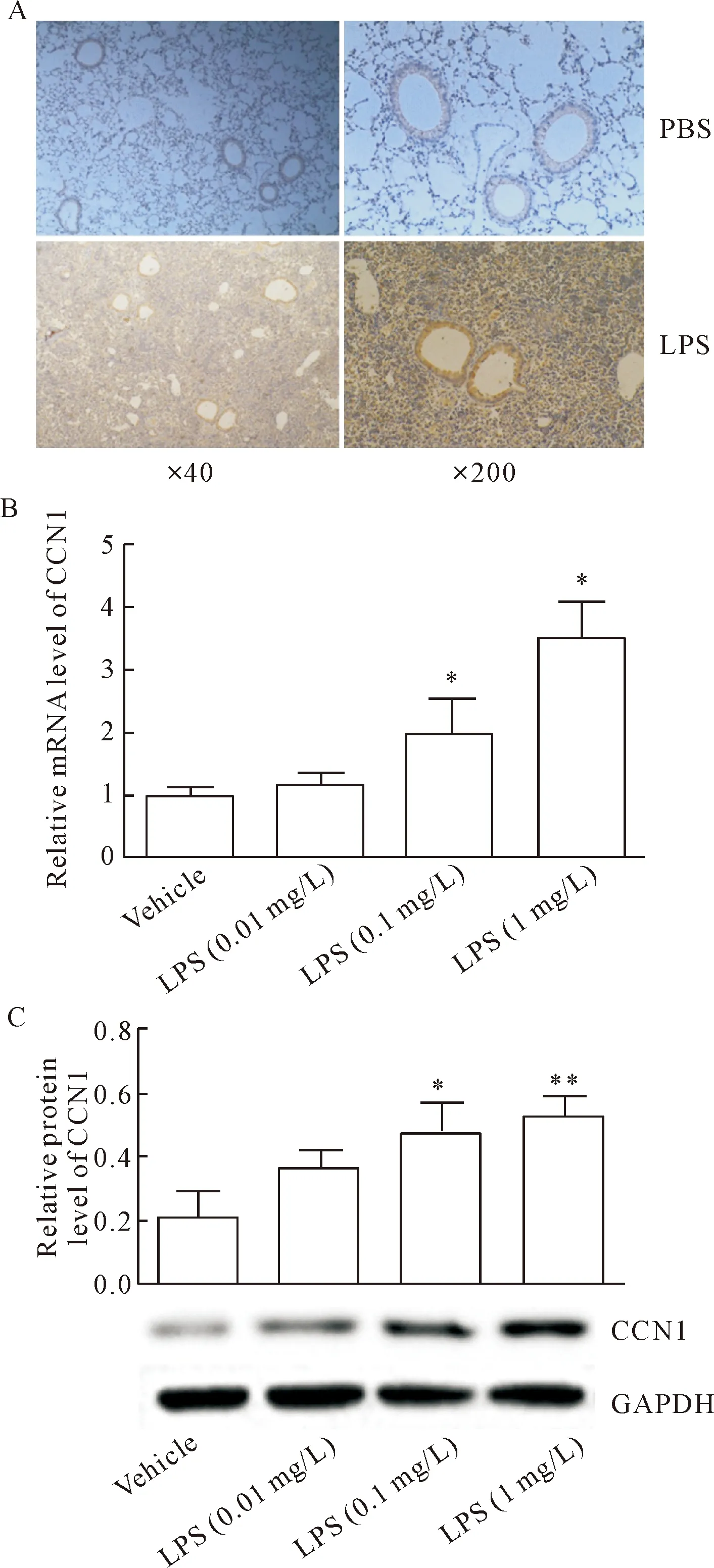
Figure 2.LPS up-regulated the expression of CCN1 in the bronchial epithelial cells. A: the expression of CCN1 in the lung tissues of the mice exposed to LPS was measured by immunohistochemical staining; B: the mRNA expression of CCN1 was measured by RT-qPCR; C: the protein expression of CCN1 was determined by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vsvehicle group.
图2 LPS诱导气道上皮CCN1的表达升高
3 ERK1/2、JNK、P38和PI3K信号传导途径参与LPS诱导的CCN1表达
分别使用不同浓度的P38、JNK、ERK1/2和PI3K信号通路特异性抑制剂预处理16HBE细胞2 h,然后加入LPS共培养4 h,通过Western blot检测CCN1的表达,发现不同浓度的ERK1/2、JNK、P38和PI3K抑制剂均可以部分逆转LPS诱导的CCN1表达升高,并呈一定的抑制剂浓度依赖性(P<0.05或P<0.01),见图3。
4 CCN1参与LPS诱导的炎症介质IL-6、IL-8、TGF-β和VEGF的mRNA合成
使用重组CCN1蛋白刺激16HBE细胞,RT-qPCR检测炎症介质IL-6、IL-8、TGF-β和VEGF的mRNA水平,发现重组CCN1蛋白可以促进炎症介质IL-6、IL-8、TGF-β和VEGF的mRNA表达水平升高,其中IL-6和IL-8在1 h、TGF-β和VEGF在0.5 h升高最为明显(P<0.05),见图4A~D。使用siRNA转染16HBE细胞后,RT-qPCR检测CCN1的mRNA表达,发现相较于scrambled siRNA组,CCN1-siRNA可以显著降低16HBE细胞CCN1的mRNA表达(P<0.05),见图4E。使用LPS刺激siRNA干预的16HBE细胞,发现CCN1-siRNA组IL-6、TGF-β和VEGF的mRNA升高幅度相对于scrambled siRNA组明显降低(P<0.05),而IL-8的差异没有统计学显著性,见图4F。
讨 论
炎症瀑布反应是肺损伤发病的核心环节,涉及免疫细胞/结构细胞、促炎介质/抗炎介质的细胞-介质网络失衡,寻找炎症瀑布中的关键介质是诊治的关键所在[7]。本研究聚焦即刻早期蛋白CCN1的表达定位和表达调控,与Moon等[8]报道相似,本研究通过免疫组化染色进一步揭示了CCN1在正常肺组织中以气道上皮细胞表达为主,免疫荧光染色同样发现CCN1作为分泌型基质蛋白主要定位胞浆,据此推测生理表达水平的CCN1具有维持气道上皮正常生理功能的必要性。固有结构细胞气道上皮细胞在损伤状况下可以扮演启动细胞的角色,即经分泌炎症介质起始扩大初始的炎症反应[9]。针对肺损伤时肺组织的免疫组化染色发现造模组气道上皮CCN1的表达强度相较正常组明显升高,考虑到研究使用的是气道滴注LPS制造肺损伤模型,LPS率先作用气道上皮促发气道局部炎症,据此推测气道上皮即刻表达的CCN1可能在气道局部炎症和失控的炎症瀑布转化中发挥了重要的调控角色。基于以上肺损伤时气道上皮即刻表达的CCN1实验结果,后续的实验围绕气道上皮来源CCN1的表达调控和炎症反应。为了验证以上体内实验结果,使用LPS体外刺激气道上皮细胞,发现CCN1的mRNA和蛋白表达升高。越来越多的研究表明CCN1作为即刻早期蛋白其表达广泛接受细菌毒素、炎症介质等的调控,其中调控机制涉及活性氧簇、内质网应激和P38 MAPK信号传导通路等[10-11]。综合我们之前在MAPK和PI3K信号通路在炎症反应中的作用积累了丰富的经验[12],以及MAPK和PI3K信号传导通路是LPS与TLR4配体-受体结合后常见的信号传导通路[13-14],利用特异性ERK1/2、JNK、P38和PI3K信号传导途径抑制剂预先处理,发现ERK1/2、JNK、P38和PI3K信号传导通路参与介导LPS诱导的CCN1表达。考虑到在疾病状态下CCN1的即刻表达特性,CCN1可能类似于应激蛋白,其表达接受广泛性的调控[15]。
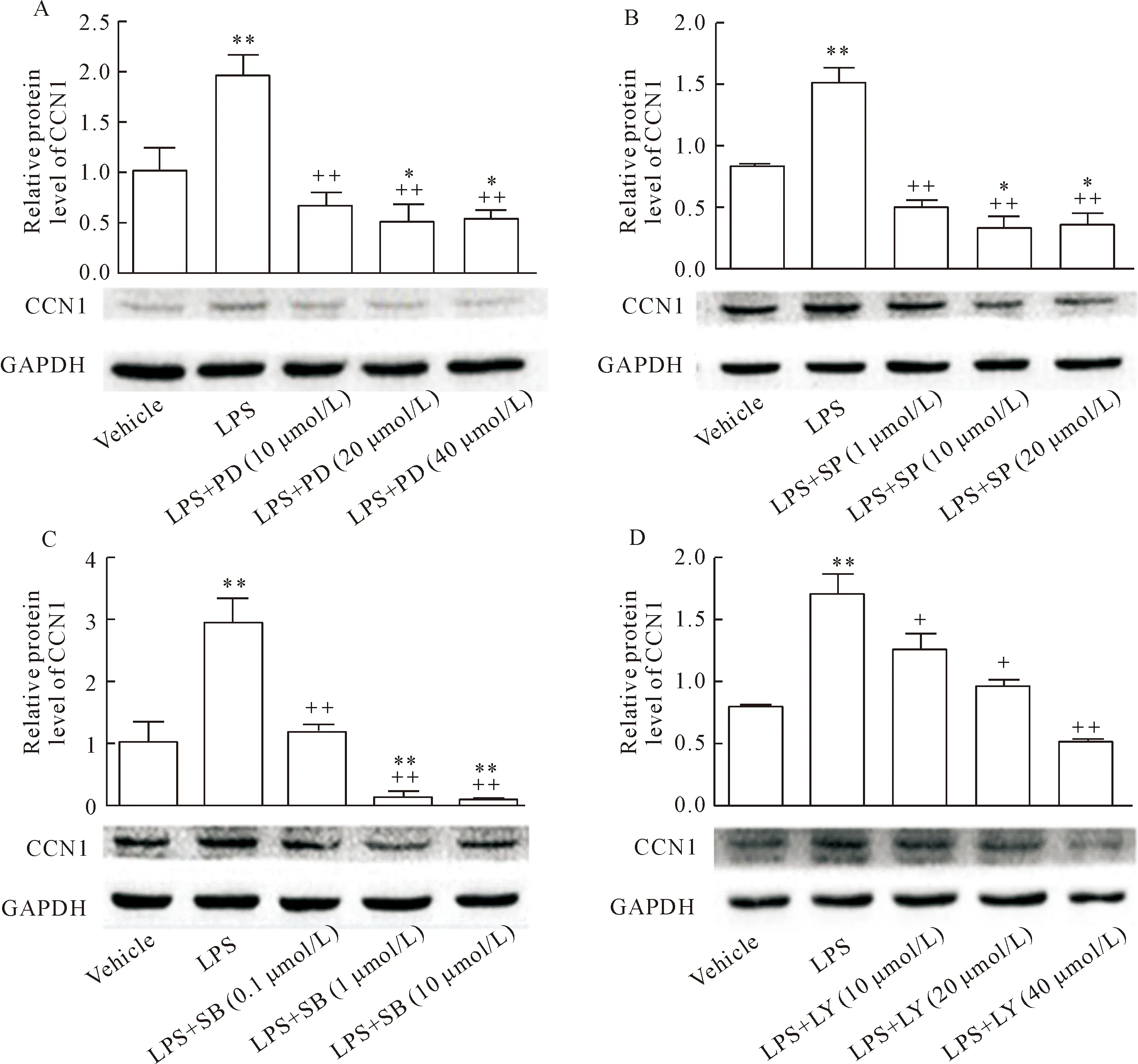
Figure 3.The roles of ERK1/2, JNK, P38 and PI3K signaling pathways in CCN1 up-regulation. A: bronchial epithelial 16HBE cells were pretreated with ERK1/2 inhibitor PD98059 (PD) for 2 h before LPS stimulation for 4 h; B: the 16HBE cells were pretreated with JNK inhibitor SP600125 (SP) for 2 h before LPS stimulation; C: the 16HBE cells were pretreated with P38 inhibitor SB202190 (SB) for 2 h before LPS stimulation; D: the 16HBE cells were pretreated with PI3K inhibitor LY294002 (LY) for 2 h before LPS stimulation. The CCN1 expression was measured by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vsvehicle group;+P<0.05,++P<0.01vsLPS group.
图3 ERK1/2、JNK、P38和PI3K信号传导途径参与LPS诱导CCN1的表达
目前针对CCN1在肺损伤中多效性的功能仍待深入明确。张燕等[16]研究报道在机械通气相关肺损伤中,异常表达的CCN1可以诱导肺泡上皮细胞的过早凋亡,然而有研究报道在高氧相关性肺损伤中,过高表达的CCN1可以逆转肺泡上皮细胞的坏死[17]。之前的综述总结CCN1是一个多效性炎症介质,其多效性具有微环境调控性、组织细胞特异性[18]。本研究拟探讨气道上皮分泌的CCN1在气道上皮炎症反应中的作用,气道上皮分泌的CCN1可以自分泌或旁分泌的方式发挥作用,利用重组CCN1蛋白刺激模拟CCN1的自分泌,发现CCN1刺激可以调控IL-6、IL-8、TGF-β和VEGF的表达,说明即刻表达的CCN1可以起始气道炎症反应的自我扩大过程。利用siRNA干扰技术,我们发现干扰CCN1的表达可以明显降低气道上皮细胞在LPS刺激下的炎症反应程度,结合Moon等[19]研究报道CCN1的表达分泌可以扩大香烟提取物诱导IL-8的水平,说明CCN1是一个炎症调节因子,在炎症的起始和扩大中发挥了重要的调控作用。至于即刻表达的CCN1是如何参与调节LPS诱导的炎症反应需要后续更加深入的研究。
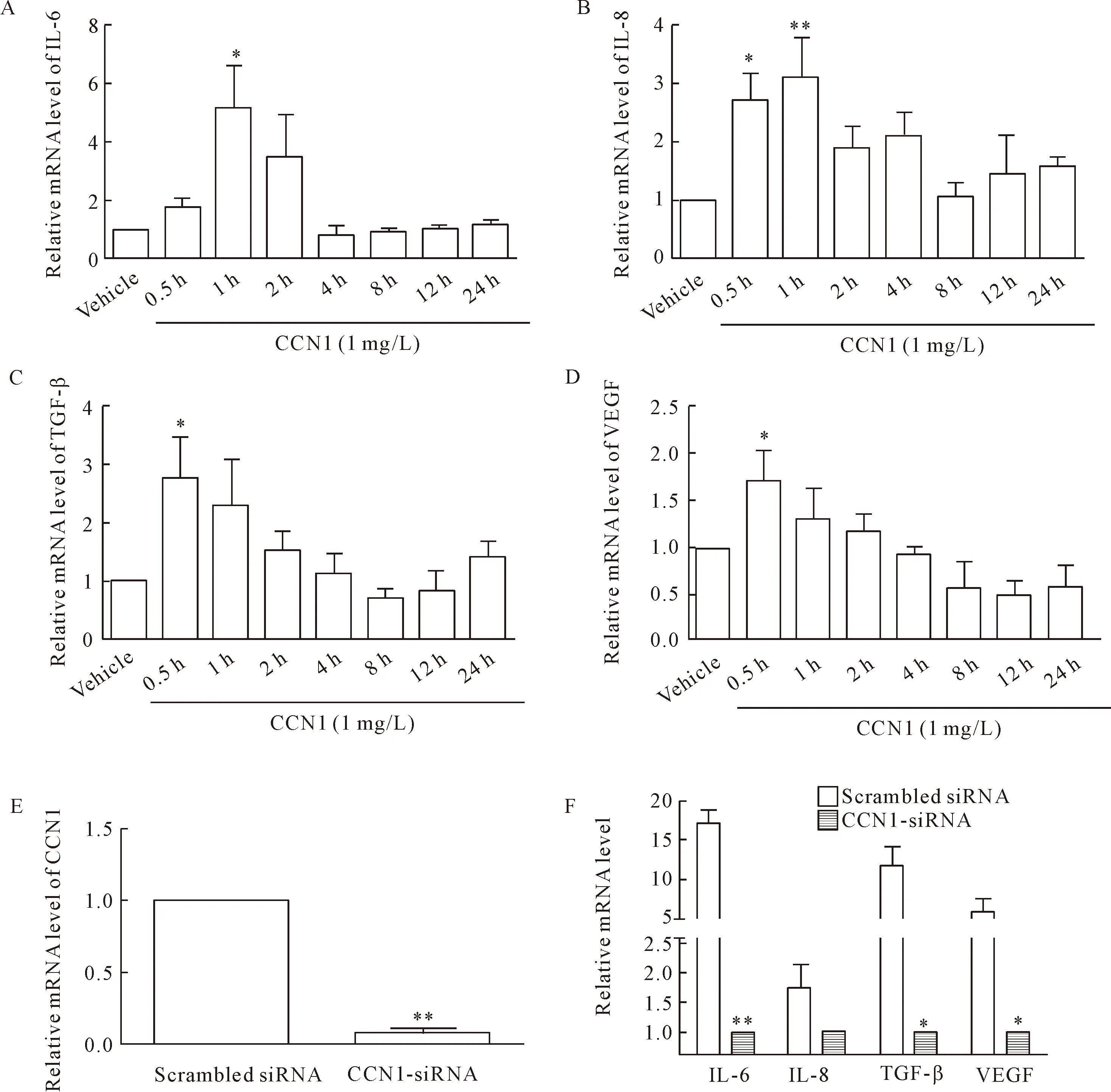
Figure 4.The role of CCN1 in LPS-induced inflammatory response. Bronchial epithelial 16HBE cells were treated with recombinant CCN1 at 1 mg/L for different time. The mRNA expression of IL-6 (A), IL-8 (B), TGF-β (C) and VEGF (D) was mea-sured by RT-qPCR. E: the silencing efficiency of CCN1-siRNA; F: the mRNA expression of IL-6, IL-8, TGF-β and VEGF after transcription with scrambled siRNA or CCN1-siRNA upon stimulation with LPS for 4 h was measured by RT-qPCR. Mean±SD.n=3.*P<0.05,**P<0.01vsscrambled siRNA.
图4 CCN1参与LPS诱导的炎症介质IL-6、IL-8、TGF-β和VEGF的mRNA合成
本研究虽然初步揭示了气道上皮来源的CCN1在表达调控和在炎症反应中的作用,然而尚存着较多的不足之处。首先,研究围绕着气道上皮细胞进行,在研究层次上稍显单一,不同来源的CCN1以及旁分泌的作用形式是后续的研究方向之一;其次,在研究深度上无论是使用特异性抑制剂或是siRNA干扰,说服力仍然欠缺,需要更多方位来说明CCN1的调控机制,目前已成功构建出气道上皮条件性CCN1敲除动物模型[20];最后,本研究仅仅选取了一个气道上皮细胞16HBE,考虑到实验的可靠性,以后势必要在多种气道上皮细胞系甚至在原代培养气道上皮细胞中进行验证。
总而言之,本研究初步探讨了CCN1在气道上皮的表达调控机制,阐明了CCN1是一个炎症调节因子参与气道上皮的炎症反应,以CCN1为切入点揭示了急性肺损伤新的发病机制和未来潜在的诊治靶点。

