小鼠海马结构与脊髓损伤后抑郁症高发病率的关系研究*
王雅丽, 杜若琛, 高渊涛, 李 宵, 李承罡, 原一桐, 王 菲, 田 峰, 李鹏飞, 王春芳△
(1山西医科大学实验动物中心, 山西 太原 030001; 2南昌大学, 江西 南昌 330000; 3山西医科大学第二医院骨科, 山西 太原 030013)
抑郁症是一种广泛存在的慢性疾病,可以影响思想、情绪和身体健康。目前发展中国家的门诊病人中抑郁症和抑郁症状的发生率明显上升,并已高于发达国家,尤其是在一些特殊群体中发病率明显升高[1]。作为一种创伤引起的长期性损伤疾病,脊髓损伤(spinal cord injury, SCI)可导致患者瘫痪、截瘫、四肢瘫痪和其它终生残疾[2-3]。流行病学数据表明,22%的SCI患者临床表现出明显的抑郁症状[4],是全球抑郁症患病率的4.5倍以上[1, 5];超过40%的SCI患者中出现食欲不振、快感缺乏等抑郁情绪[6-8]。因此,心理社会问题在SCI研究中变得更加突出。目前普遍的认识是SCI严重影响患者运动能力和功能独立性,同时对患者以及其家庭和社会带来沉重的负担[9],患者产生心理上的不利因素导致抑郁症状的出现。
在抑郁症中,常可以发现患者有神经可塑性受损[10],根据抑郁症的神经可塑性假说有望开发新的、更有效的治疗手段[11]。神经可塑性主要表现在突触可塑性,与认知、记忆和应激紧密相关,一直是现在抑郁症研究的主要目标[12]。海马作为大脑边缘系统的一个重要结构,是一个情感、动机产生和调节的关键部位。研究表明,抑郁症的发病与患者大脑海马神经元的丢失及突触发生的减少密切相关,海马的结构功能以及突触可塑性极易发生异常变化[13-14]。据此我们推测SCI患者罹患抑郁症高风险的原因与海马突触可塑性有关,即除却心理层面因素外,海马生理结构的改变加剧了抑郁症的发生。因此,探讨海马突触可塑性在抑郁症中的作用,将进一步明确SCI所致抑郁症的发病机制,并提供有效的治疗策略。
然而,关于这一主题的研究很少,缺少一定的实验基础。我们从动物模型出发进行研究,有助于增进对脊髓损伤和神经精神疾病之间复杂相互作用的认识,支持对SCI后抑郁的临床理解。因此,本研究通过建立小鼠SCI模型,探讨SCI引发的高抑郁症风险是否与海马生理结构的改变有关,为阐述SCI后抑郁的发病机制及临床干预提供参考资料。
材 料 和 方 法
1 动物
8周龄FVB雌性小鼠40只,SPF级,体质量25~30 g,购于山西医科大学实验动物中心,许可证号为SCXK(晋)2015-0001。所有小鼠保持在具有12 h光照/黑暗循环的温控室(20~25 ℃),相对湿度为50%~60%的环境中饲养。
2 主要试剂
HE染色试剂盒购自索莱宝公司;PrimeScript RT和TB Green® Premix Ex Taq试剂盒均购自TaKaRa。
3 主要方法
3.1实验动物分组 将实验动物随机分为对照(control)组(20只)和模型(model)组(20只),分笼饲养,每笼5只,适应1周,自由饮食。
3.2SCI动物模型的制作 根据文献[15]的方法应用Impactor M-Ⅲ spinal cord contusion system击打脊髓制作损伤模型。小鼠腹腔注射1%戊巴比妥钠(50 mg/kg),完全麻醉后固定于手术台,皮肤常规消毒,暴露第10胸椎(T10),应用Impactor M-Ⅲ spinal cord contusion system击打脊髓制作损伤模型。术后用红外灯照射,3 d内肌注青霉素G(4 000 U),预防感染。每天早晚各给小鼠排尿1次,直到其恢复自主排尿。
3.3Basso Mouse Scale (BMS)评分 分别在术后1、3、5、7、10,14和21 d进行BMS评分[16]。由3名研究人员单独盲评(n=10)。
3.4糖水偏好实验 在术前1 d对小鼠进行适应训练,每只小鼠单独1笼,前12 h给与两瓶1%蔗糖水,后12 h给与两瓶纯水。在术后1、3、5、7、10、14和21 d对每只模型组小鼠及对照组进行糖水偏好实验,提供充足食物,禁水6~8 h,然后同时给与已称重的纯水及1%蔗糖水,24 h后测各瓶的饮水量,计算出糖水偏好百分比结果用以判断动物快感缺乏情况。糖水偏好百分比(%)=糖水消耗量/(糖水消耗量+纯水消耗量)×100%。
3.5悬尾实验 对照组和模型组小鼠分别在术后5、7、10、14和21 d进行悬尾实验。先将小鼠转移至安静的实验房间适应1 h。将小鼠尾部后1/3处固定于悬尾试验架上,头向下,头部离箱底15 cm,在安静避光环境下,观察5 min,前2 min统计小鼠不动前的潜伏期时间,后3 min记录小鼠不动的总时间。结果用以评价小鼠绝望状态。
3.6HE染色 小鼠腹腔注射1%戊巴比妥钠(50 mg/kg),完全麻醉后暴露心脏,先用0.9%生理盐水灌注,然后4%多聚甲醛灌注小鼠。待灌注成功后,解剖小鼠大脑部位,置于4%多聚甲醛内固定24 h,制作石蜡切片,然后进行HE染色,最后中性树脂封片后镜下观察并拍片记录。通过HE染色观察海马内部细胞的结构变化。
3.7电镜 模型组和对照组每组随机选取3只小鼠,1%戊巴比妥钠(50 mg/kg)腹腔麻醉,完全麻醉后,暴露心脏,灌注4%多聚甲醛和生理盐水,灌注结束后快速断头取脑,参照边缘系统解剖图谱切取海马CA3区1 mm×1 mm×1 mm组织块,置于3%戊二醛中固定2 h,然后磷酸缓冲液漂洗3次。l%锇酸固定液固定2 h,磷酸缓冲液漂洗。常规丙酮脱水、透明,包埋,制备厚度约70 nm超薄切片,采用醋酸双氧铀对切片进行染色30 min,双蒸水漂洗3次,然后用柠檬酸铅染色10 min,漂洗3次,待切片干燥后,采用JEM-1011型透射电镜下进行观察。采用多点平均法测量突触间隙宽度,参照文献[17]报道的方法,测量突触后膜致密物(postsynaptic density, PSD)厚度和突触活性区长度,参考Jones等[18]的方法计算突触界面曲率(突触界面弧长与弦长之比)。通过电镜观察海马亚细胞突触的结构变化。
3.8RT-qPCR 取模型组和对照组小鼠各3只,解剖海马组织。依照说明书TRIzol(TaKaRa)提取总RNA,使用酶标仪测定RNA的浓度及吸光度。反转录试剂盒将总RNA反转录成cDNA,然后使用TB Green® Premix Ex Taq进行扩增,扩增条件为:95 ℃ 30 s预变性;95 ℃ 3 s和60 ℃ 30 s,40个循环。最后采用2-ΔΔCt法对脊髓损伤小鼠海马区突触后致密蛋白95(postsynaptic density protein 95,PSD-95)和突触小泡蛋白(synaptophysin,SYP)在mRNA水平的表达变化进行测定。引物序列如表1所示。
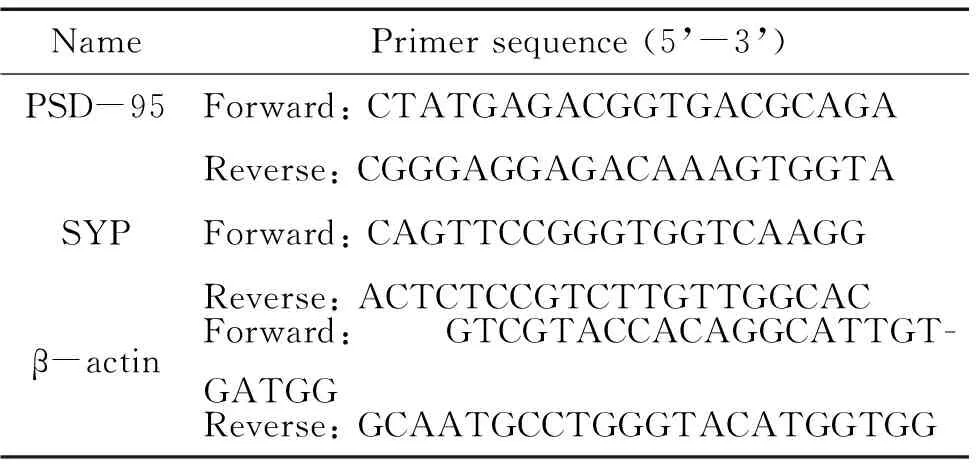
表1 RT-qPCR引物序列
4 统计学处理
采用SPSS 21.0统计软件进行统计学分析。所有数据均以均数±标准差(mean±SD)表示,组间比较采用t检验,以P<0.05为差异有显著性。
结 果
1 行为学实验结果
BMS评分被用于评估术后小鼠的运动功能恢复情况。术后1、3、5、7、10、14和21 d的BMS评分结果显示,术后模型组在1 d和3 d时运动功能完全丧失,7 d时运动功能出现恢复迹象,第21 d时趋于平稳,见图1。
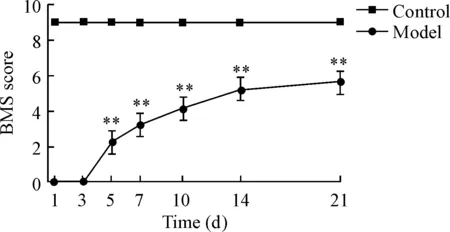
Figure 1.The BMS score of each group. Mean±SD.n=10.*P<0.05,**P<0.01vscontrol group.
图1 各组在不同时点的BMS评分
以糖水偏好实验和悬尾实验反映小鼠的抑郁情况。糖水偏好实验结果显示,对照组1~21 d无显著差异,与对照组相比,模型组除第1天外术后7 d小鼠糖水消耗百分比差异最大(P<0.01),即术后7 d小鼠糖水消耗量最低,然后第10天开始上升,第21天趋于稳定,见图2。
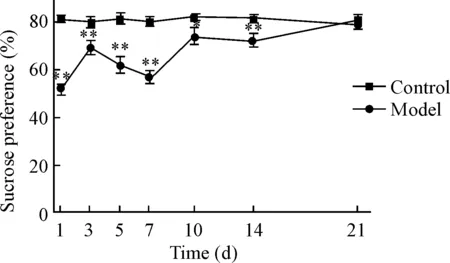
Figure 2.The sucrose preference in each group. Mean±SD.n=10.*P<0.05,**P<0.01vscontrol groups.
图2 各组的糖水偏好度百分比
悬尾实验的结果显示,对照组1~21 d无显著差异,与对照组相比,模型组术后7 d和10 d小鼠不动时间显著高于对照组(P<0.01),随后开始不动时间减少,在第21天趋于稳定,见图3。
通过综合以上行为学实验的结果,我们确定了脊髓损伤后第7天小鼠的抑郁程度最显著,因此选用7 d这个时间节点进行后续的研究。
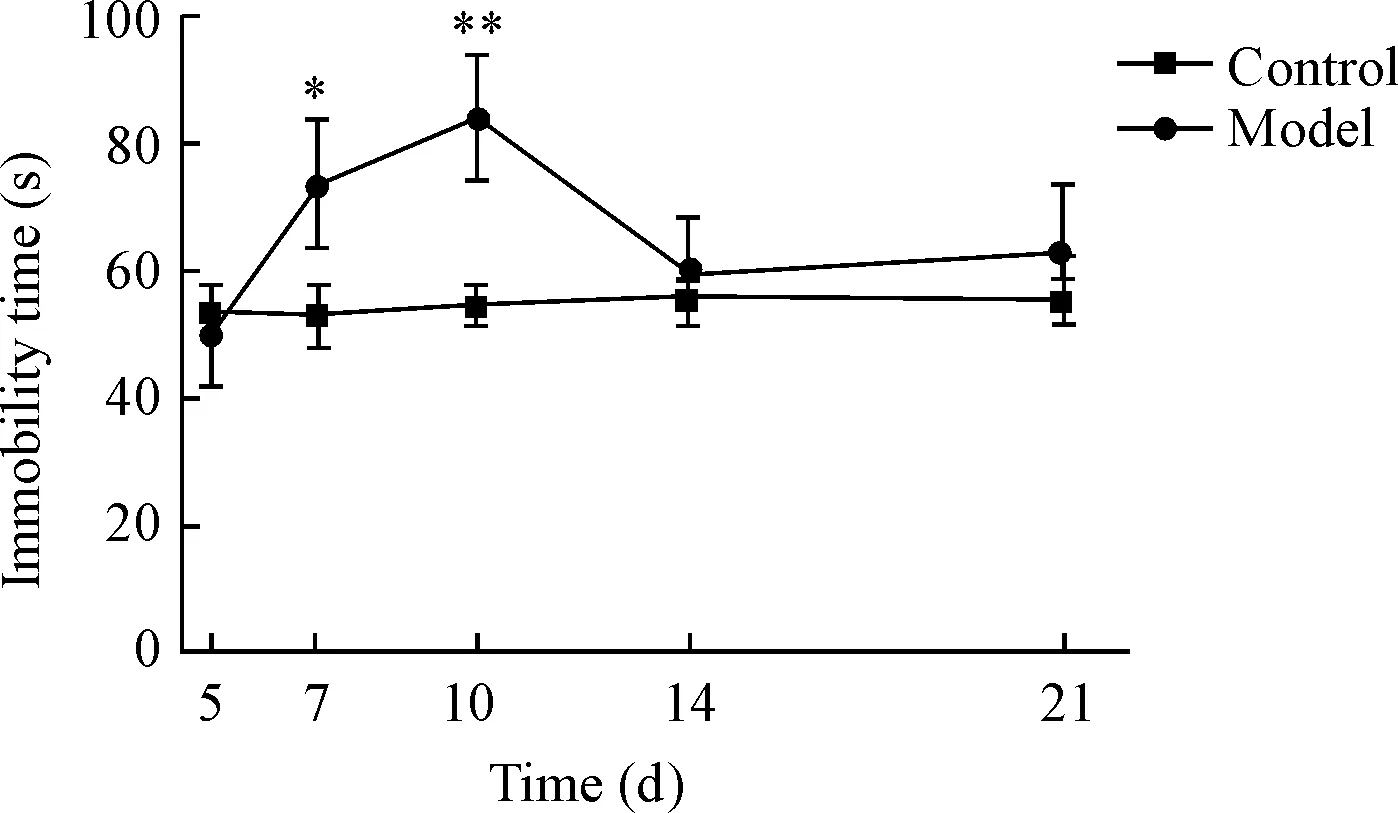
Figure 3.The immobility time of tail suspension test in each group. Mean±SD.n=10.*P<0.05,**P<0.01vscontrol group.
图3 各组的悬尾试验不动时间
2 HE染色法检测海马的形态变化
为了检测SCI引起抑郁时的海马部位病理学的改变,我们在术后7 d取模型组和对照组的海马组织,进行HE染色。在高倍镜(×400)及低倍镜(×200)下观察结果显示,正常对照组小鼠海马细胞形态饱满完整,排列有序,结构清楚;与对照组相比,模型组CA3区细胞排列稍紊乱,数量稍减少,形态欠规则,见图4。
3 透射电镜检测突触的结构变化
为了进一步观察海马的结构变化,我们选取了术后7 d模型组和对照组小鼠海马CA3区组织进行电镜分析,观察海马突触超微结构的变化。和对照组相比,模型组突触数量减少,突触前膜内突触小泡减少,突触后致密物密度降低,见图5。
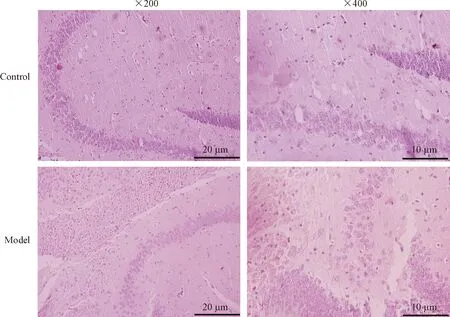
Figure 4.HE staining of hippocampal tissues in each group.
图4 各组海马组织的HE染色
对突触的结构参数进行分析,与对照组相比,模型组突触活动区长度变短,突触后致密物厚度变薄,突触间隙宽度增加,突触界面曲率减小(P<0.05),见表2。
4 RT-qPCR检测小鼠海马突触相关蛋白的mRNA表达
为了进一步检测突触相关蛋白的mRNA表达是否变化,我们通过RT-qPCR检测了术后7 d模型组和对照组小鼠海马组织PSD-95和SYP mRNA的表达情况。结果显示,模型组PSD-95和SYP的mRNA表达量均显著低于对照组(P<0.05),见图6。
讨 论
SCI的主要后果是长期残疾,严重影响运动能力和功能独立性,以及患者心理健康及生活质量,对社会及家庭造成了巨大的负担。然而临床上往往只关注了其身体的状况,却忽视了对其心理造成的影响。有研究表明了心理功能的降低对SCI患者生活质量具有显著的负面影响[19],所以关注脊髓损伤病人的心理疾病将是我们所要研究的重点。在本研究中,我们关注的是脊髓损伤小鼠抑郁模型与其调控情绪的器官海马的结构和功能变化之间的关系。
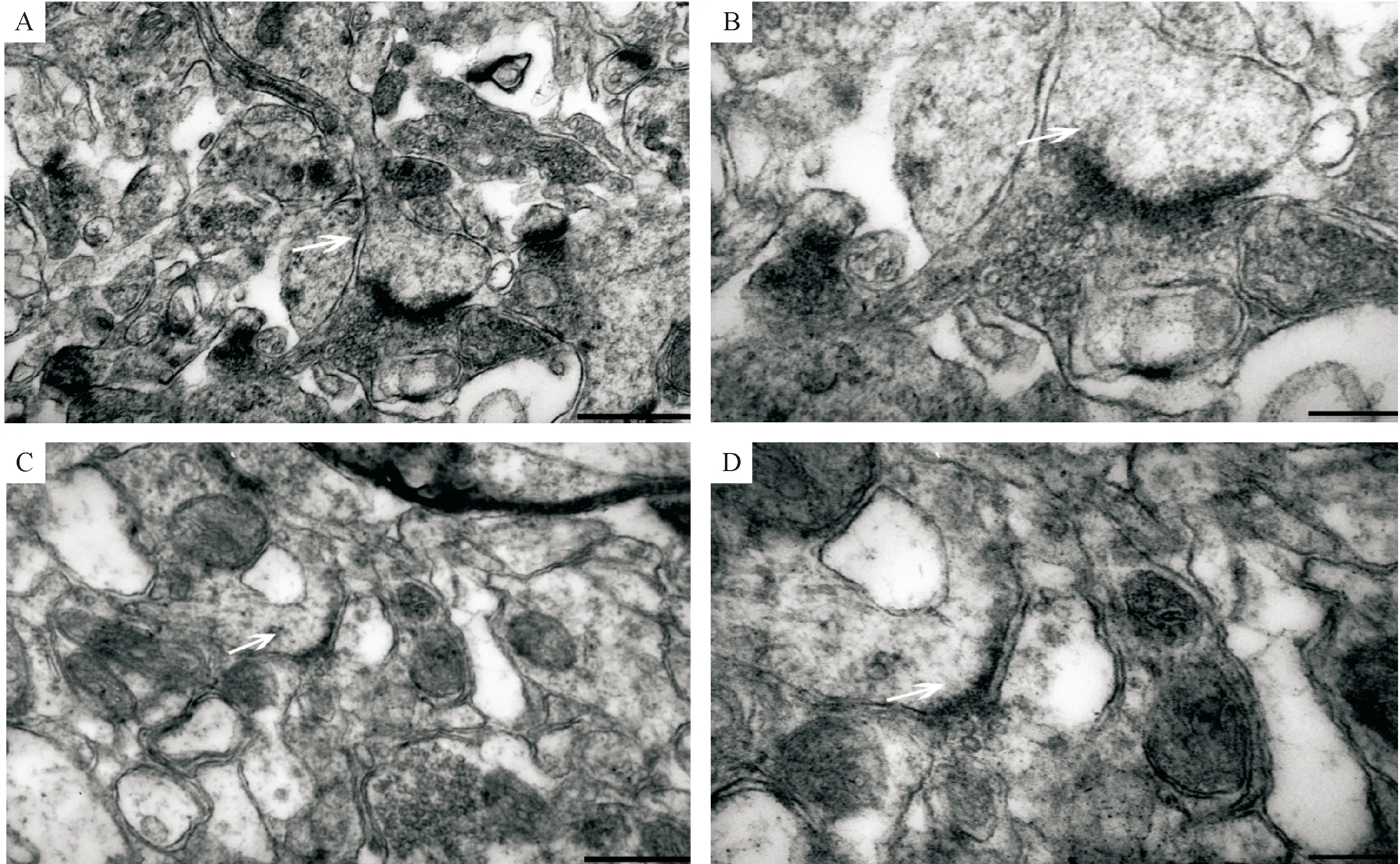
Figure 5.Ultrastructure of synapses in hippocampal CA3 region of mice in each group under transmission electron microscope. A: control group, the scale bar=500 nm; B: control group, the scale bar=200 nm; C: model group, the scale bar=500 nm; D: model group, the scale bar=200 nm. The white arrows represent synapses.
图5 透射电镜下各组小鼠海马CA3区突触的超微结构

表2 各组小鼠海马CA3区突触结构参数
*P<0.05vscontrol group.
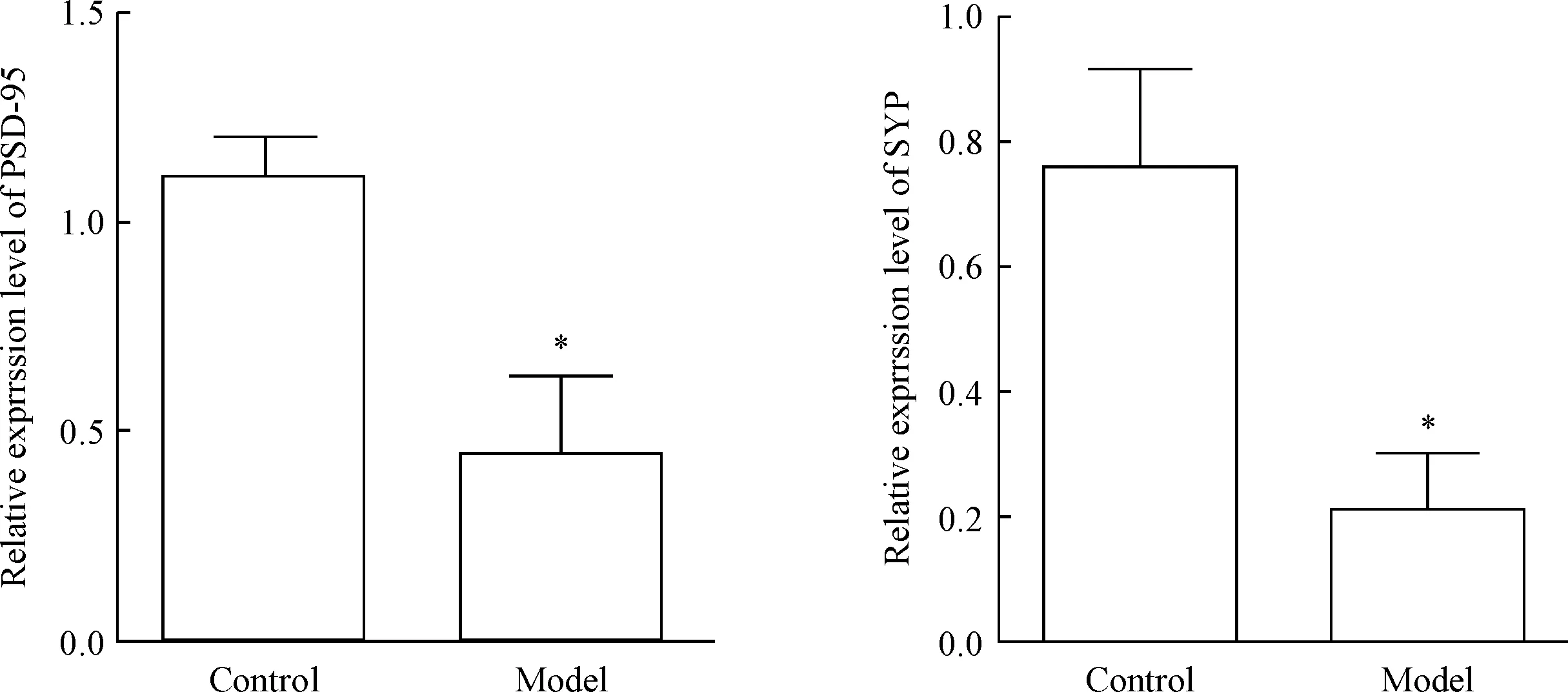
Figure 6.The relative mRNA expression levels of PSD-95 and SYP in hippocampal tissues of mice in each group. Mean±SD.n=3.*P<0.05vscontrol group.
图6 各组小鼠海马组织PSD-95和SYP的mRNA表达量
我们首先制作小鼠脊髓损伤模型,然后通过糖水偏好实验和悬尾试验,与对照组小鼠相比,模型组小鼠表现为快感缺失,不动时间增加,说明脊髓损伤小鼠发生了抑郁样行为。并且糖水偏好实验结果显示术后1 d和7 d糖水消耗量最低,术后第1天小鼠由于疼痛,虚弱而摄入饮水大量减少,所以该天的数据受多种因素的影响而去除。悬尾实验的结果显示术后第7天和第10天有显著差异,所以综合以上结果最终我们选择了第7天来进行进一步的研究。
海马参与情感、记忆、内分泌整合等过程,与人类情感性疾病的发生关系密切[20-21]。有研究报道,抑郁的发病与海马突触可塑性有关,以往对抑郁症的研究发现,抑郁患者的海马结构发生改变,突触数量减少,结构破坏[22],我们推测其脊髓损伤引起抑郁的生物学机制有可能与该假说有关。突触是实现神经元间信息传递的基本结构,可以传递生物信号,形成神经环路[12]。突触可塑性是大脑基本的功能之一:感知、评估和存储复杂信息的能力,以及对随后相关刺激做出适当的适应性反应的能力[23]。这种关键的大脑功能在短期和长期记忆中都扮演着重要的角色,而这些变化背后的机制与病理生理学和包括抑郁症在内的多种神经生物学疾病的治疗有关。因此,我们进一步研究了模型组小鼠的抑郁样行为的机制,评估突触可塑性在抑郁发展中的意义。在本研究中,我们的结果表明脊髓损伤模型小鼠的海马形态发生改变,突触结构异常,符合了这一特征。
突触蛋白标志物主要有PSD-95和SYP。PSD-95是膜相关鸟苷酸激酶(membrane-associated guanylate kinase, MAGUK)家族蛋白的成员之一,是突触后密度中丰富的支架蛋白,存在于成熟的兴奋性谷氨酸能突触内,是一种重要的神经细胞骨架蛋白,是神经信息传递的重要基础,且与离子通道功能、突触活动、细胞内信号转导的调节有关,是突触后成分的标志物,在突触可塑性中起重要作用,调控突触的数目,促进突触的形成[24-26]。SYP是一种特异性存在于所有神经末梢的突触前囊泡蛋白,与突触功能密切相关,是突触前成分的标志物,并且研究表明SYP的功能与突触可塑性关系密切[27-30]。在本实验中,通过RT-qPCR验证了SYP与PSD-95 mRNA表达的水平,与对照组相比,模型组该基因水平显著降低,意味着海马神经突触前、后结构均发生了变化,使突触可塑性降低,进一步说明脊髓损伤后的抑郁与突触结构和功能的改变有关。
总的来说,上述结果表明脊髓损伤促进了一种重要的神经精神病学特征,这种特征与突触可塑性假说有关。我们认为突触结构及功能的变化可能是脊髓损伤后抑郁发病的潜在机制之一。所以,临床上在治疗SCI的同时应当关注其抑郁情况,且干预手段不应仅限于抗抑郁类药物,海马结构的破坏这一生理变化也可能是SCI后抑郁症高发病率的原因之一。

