益气活血软坚解毒方对肝癌H-22细胞增殖的影响*
张旼旼 黄新宇 戴 慧
杭州市肿瘤医院 浙江 杭州 310002
晚期肝癌患者常伴有体力、免疫功能、营养状况低下等状况[1],往往不能耐受放疗、化疗等积极治疗措施。寻求能够抑制肿瘤生长,抑制肝癌细胞增殖,且患者更易耐受的治疗方法成为治疗所需。益气活血软坚解毒方(YHRJ)是由生黄芪、炒白术、藤梨根、白花蛇舌草、田三七、半枝莲、水红花子等中药组成的复方制剂,前期研究中已发现,该方剂在肝癌的治疗中有增效减毒的作用。本文中,我们将探讨YHRJ在抑制肝癌细胞生长和增殖作用中的分子作用机制。
1 材料与方法
1.1 动物与瘤株:动物:BALB/c小鼠,购于上海西普尔-必凯实验动物有限公司,动物许可证号SCXK(沪)2013-0016。饲养条件:恒温22±2℃,湿度50%~60%,光照每12小时明暗交替,换风次数15~20次/小时。由浙江中医药大学动物实验研究中心饲养,实验饲养室许可证号SYXK(浙)2013-0184。瘤株:H-22肝癌细胞瘤株,购自中国科学院上海生命科学研究院细胞资源中心。
1.2 药物与试剂:药物:益气活血软坚解毒方(YHRJ)组成:生黄芪、藤梨根、白花蛇舌草、半枝莲各30g,炒白术15g,田三七、水红花子各8g,凌霄花9g,炮山甲10g。常规水提取,配成等效剂量YHRJ 3.4g/ml、高剂量YHRJ 6.8g/ml,4℃保存备用。奥沙利铂(OXA):江苏恒瑞医药股份有限公司产品,用5%葡萄糖液调配成1g/L的溶液,遮光保存。试剂:苏木素染液为servicebio产品,伊红染液购于珠海贝索生物技术有限公司,增殖细胞核抗原(PCNA)抗体为Affinity产品,免疫组化试剂盒产自MDL,逆转录试剂盒、PCR试剂盒均为康为世纪公司产品。
1.3 动物模型制备:取48只小鼠,收集对数生长期H-22肝癌细胞,调整细胞浓度为1×107个/ml,于颈部右侧皮下接种0.2ml,继续饲养2周,待肿瘤增殖至可以触及时,将动物随机分为6组:A组:对照(NS)组;B组:OXA组(1.5mg/kg);C组:等效剂量YHRJ组(3.4g/ml生药,0.3ml);D组:等效剂量YHRJ+OXA组(B+C联合给药);E组:高剂量YHRJ组(6.8g/ml生药,0.3ml);F组:高剂量YHRJ+OXA组(B+E联合给药)。对照组及YHRJ单药组采用灌胃的给药方法,每天分别给于0.9%NaCl及YHRJ(等效剂量浓度为3.4g/ml生药,高剂量浓度为6.8g/ml生药)各0.3ml,1次/d,连续14d;OXA组采用腹腔注射OXA(剂量为1.5mg/kg,用5%葡萄糖液调配成0.5ml/鼠,1次/d)连续14d;联合组每天灌胃给予YHRJ 0.3ml及腹腔注射OXA 0.5ml,1次/d,连续14d。
1.4 实验方法:分述如下。
1.4.1 YHRJ对H-22肝癌细胞小鼠皮下移植瘤生长的影响:每隔3天观察肿瘤的生长情况,测量肿瘤长径(L)和横径(W),单位为毫米(mm)。2周后处死小鼠,肿瘤体积=(L×W2)/2;肿瘤抑瘤率=[(A-B)/A]×100%。A为模型组对照组的肿瘤体积,B为给药实验组的肿瘤体积。
1.4.2 HE染色观察肝癌组织细胞的形态变化:取肿瘤组织放入10%中性甲醛固定,取材包埋切片。经常规脱蜡、脱水,苏木素染色,盐酸乙醇分化,伊红液染色后脱水、透明、中性树胶封片。400倍显微镜下观察、拍照。
1.4.3 免疫组化检测肝癌组织中细胞增殖核抗原(PCNA)的蛋白的表达:将肝组织石蜡切片脱蜡、脱水,进行抗原热修复,消除内源性过氧化物酶活性,按照免疫组化试剂盒说明进行免疫杂交后,DAB显色,苏木素复染,脱水、透明、中性树胶封片。切片在200倍显微镜下随机选取不重复6个视野(其中棕色部分即为蛋白表达区域,蓝色为细胞核。图片采用Image pro plus软件分析,计算棕色蛋白表达面积和累计光密度)。
1.4.4 RT-PCR检测小鼠肿瘤组织中PCNA、转录因子NF-KB、细胞周期蛋白Cyclin D1的mRNA的表达:将肿瘤组织用Trizol法提取总RNA,根据逆转录试剂盒操作说明进行逆转录反应,逆转录反应条件:42℃,15min;85℃,5min。按照PCR试剂盒说明进行PCR反应,反应条件:95℃,10min变性;95℃,15s;60℃,60s;40次循环。RT-PCR所用引物序列信息见表1。

表1 引物序列信息
1.5 统计学方法:数据分析采用SPSS 19.0统计软件,所有数据以均值±标准差(±s)表示,作图采用Graph-Pad Prism 8软件。两组间比较采用两个独立样本的t检验,多组间均数比较采用单因素方差分析;P<0.05为差异有统计学意义。
2 结果
2.1 YHRJ对H-22肝癌细胞小鼠皮下移植瘤生长的影响:与NS组相比,各给药组肿瘤体积均有所缩小,其中,除等效剂量YHRJ组外,其他各组中肿瘤体积均缩小显著(P<0.05或P<0.01);两联合组抑瘤率均达35%以上,且均大于OXA组,其中,高剂量YHRJ+OXA组较OXA组有统计学差异(P<0.01),表明YHRJ可抑制肝癌细胞的生长,浓度越高,抑瘤效果越显著。详见表2。
表2 各组小鼠肿瘤终体积及抑瘤率(±s)

表2 各组小鼠肿瘤终体积及抑瘤率(±s)
注:与A组比较,*P<0.05,**P<0.01;与B组比较,▲P<0.05,▲▲P<0.01。
images/BZ_26_1310_656_2302_727.png—30.03 7.09 38.25 24.29 50.26 A组B组C组D组E组F组8 8 8 8 8 8 465.4±118.1 325.7±65.3*432.4±102.4▲287.4±93.7**352.4±94.3*231.5± 68.2**▲▲
2.2 HE染色观察肝癌组织细胞的形态变化:从图1可知,NS组肿瘤细胞生长活跃,细胞密集,细胞呈现多边形或不规则形,细胞核较大,核仁清晰、核膜完整、核分裂相明显。给药后,等效剂量YHRJ组、高效剂量YHRJ组中肿瘤细胞有一定程度坏死轻微,核深染的肿瘤细胞数量以及核分裂象有一定程度减少。等效剂量YHRJ+OXA组、高剂量YHRJ组、高剂量YHRJ+OXA组相较于NS组疗效明显,可见肿瘤组织中出现肿瘤细胞坏死现象。肿瘤细胞发生坏死程度从高到低依次为:等效剂量YHRJ+OXA组、高剂量YHRJ+OXA组、OXA组、高剂量YHRJ组、等效剂量YHRJ组。

图1 HE染色观察YHRJ对小鼠肝癌增殖的影响(HE染色,400倍)
2.3 免疫组化观察检测PCNA的表达:各组小鼠肿瘤组织中均有PCNA表达,与NS组相比,各给药组中PCNA表达均有一定程度下降,表明YHRJ可下调PCNA的表达,其中高剂量组效果更显著(P<0.05)。等效剂量YHRJ+OXA组、高剂量YHRJ+OXA组中PCNA的表达较OXA组也有显著性下降(P<0.05)。见表3。
表3 YHRJ方对小鼠肝癌中PCNA表达的影响(±s)
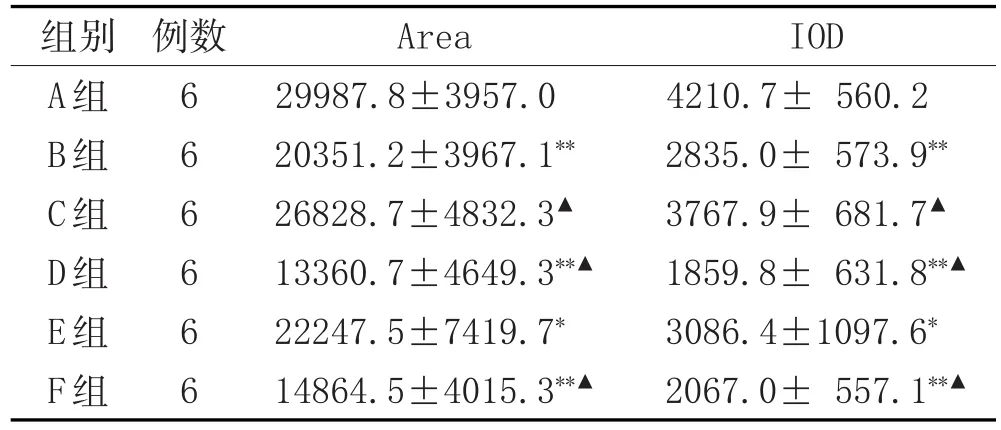
表3 YHRJ方对小鼠肝癌中PCNA表达的影响(±s)
注:与A组比较,*P<0.05,**P<0.01;与B组比较,▲P<0.05。
images/BZ_27_177_385_1160_443.png4210.7±560.2 2835.0±573.9**3767.9± 681.7▲1859.8±631.8**▲3086.4±1097.6*2067.0±557.1**▲A组B组C组D组E组F组6 6 6 6 6 6 29987.8±3957.0 20351.2±3967.1**26828.7±4832.3▲13360.7±4649.3**▲22247.5±7419.7*14864.5±4015.3**▲
2.4 实时定量PCR:与NS组比较,各给药组肿瘤组织中PCNA、NF-KB及Cyclin D1的mRNA水平均显著性下调(P<0.05或P<0.01)。与OXA组比较,等效剂量YHRJ联合+OXA组、高剂量YHRJ+OXA组肿瘤组织中PCNA、NF-KB及Cyclin D1的mRNA水平均下调,但未见显著性差异(P>0.05)。见表4。
表4 肿瘤组织中PCNA、NF-KB及Cyclin D1的mRNA水平(±s)

表4 肿瘤组织中PCNA、NF-KB及Cyclin D1的mRNA水平(±s)
注:与A组比较,*P<0.05,**P<0.01。
images/BZ_27_173_1460_1173_1518.pngA组B组C组D组E组F组1.00±0.09 0.72±0.07*0.79±0.07*0.68±0.08**0.75±0.11*0.60±0.07**3 3 3 3 3 3 1.00±0.09 0.68±0.11*0.77±0.11*0.61±0.08**0.74±0.08*0.58±0.10**1.00±0.09 0.7±0.12*0.80±0.08*0.66±0.06**0.72±0.10*0.61±0.08**
3 讨论
细胞周期紊乱是肿瘤最主要的发生机制,细胞周期中各类分子、蛋白的异常表达都可能引起肿瘤的发生[2]。本研究通过测量小鼠肝癌H-22细胞移植瘤大小,证实YHRJ可以抑制肿瘤的生长,HE染色结果也表明,YHRJ可以诱导肿瘤细胞发生坏死,抑制细胞增殖。为探讨其可能作用机制,作者检测了细胞周期中参与细胞生长、增殖等过程的相关蛋白、基因的表达情况。
增殖细胞核抗原(PCNA)是一种分子量为36KD的酸性蛋白,为DNA聚合酶δ的辅助因子,PCNA在G1晚期表达增加,S期达到高峰,其量的变化与DNA合成一致,是评价细胞增殖状态的一个指标。在肿瘤细胞中,PCNA呈现过表达状态[3]。本研究通过免疫组化检测组织细胞中PCNA蛋白、PCR法检测细胞中PCNA mRNA水平发现,YHRJ可下调PCNA蛋白和mRNA的表达,提示YHRJ可能通过抑制组织细胞中PCNA蛋白的合成、PCNA mRNA的表达来发挥抑制细胞增殖的作用。
NF-KB是细胞内重要的核转录因子,其在癌症增殖,侵袭和转移中起重要作用,且与较差的预后相关[4]。细胞周期蛋白D1也在许多恶性肿瘤的细胞生长中起关键作用[5-6]。有文献报道,NF-κB可通过磷酸化p65和IκB等分子,上调其下游分子Cyclin D1,促使细胞发生分裂与增殖。Cyclin D1蛋白的过表达会使细胞增殖不断进行,导致肿瘤的发生[7]。本研究中的结果也论证上述观点,YHRJ可抑制NF-KB/Cyclin D1信号传导来抑制肝癌H-22细胞增殖,抑制肿瘤的生长。
综上所述,YHRJ能够显著抑制肝癌H-22细胞移植瘤的生长,对肝癌H-22的增殖具有抑制作用,其发挥抑制作用的机制可能是通过下调PCNA的表达、抑制NFKB/Cyclin D1信号传导来实现的。这一结果,将为YHRJ在肝癌的治疗研究中提供更为有力的证据。

