纳米粒子与细胞相互作用的力学-化学偶联研究进展
展金秀,冯峰,许敏,姚立,*,葛茂发,*
1中国科学院化学研究所,北京分子科学国家研究中心,分子动态与稳态结构实验室,中国科学院分子科学科教融合卓越创新中心,北京 100190
2中国科学院大学,北京 100049

1 引言
随着纳米材料在生物医学领域的广泛应用,微纳粒子与人体系统发生相互作用的机会越来越多。同时,大气灰霾的污染也让人体可能暴露于超细粒子的环境之中。这些情况让人们越来越关注微纳粒子的安全性问题,有必要了解微纳米颗粒与生物系统相互作用的全面知识,建立微纳米粒子的安全评价体系,保证其在各种领域的安全应用。已经有大量的研究表明,纳米粒子(NPs)可能对细胞活力或细胞功能产生不利影响,如导致细胞凋亡、诱发炎症、损伤DNA等1-3。然而,有关NPs与细胞相互作用的确切机制仍然不清楚。NPs细胞毒性已经受到科学家的广泛研究,越来越多的报道开始关注这些微纳米粒子对细胞力学-化学偶联(即细胞力学机械特性及其分子生物学机制)的影响。
细胞力学在细胞增殖、分化、凋亡等基本细胞功能中起着重要作用,胚胎发育、肿瘤转移以及伤口愈合等复杂活动也受到细胞力学的影响。因此,全面了解纳米粒子-细胞相互作用的细胞力学是十分必要的。细胞力学主要由细胞粘附系统和细胞骨架两种细胞成分构成,通常涉及细胞产生力和通过粘附复合体传递力这两个不同的过程。一方面,细胞可以通过粘附系统探测来自周围环境的外力。细胞通过细胞-细胞/基质的粘附与细胞外基质(extracellular matrix,ECM)及邻近细胞发生相互作用。这个过程涉及不同的粘附或连接结构和蛋白质。另一方面,细胞也可以对环境施加机械力。例如,细胞骨架通过细胞骨架蛋白及运动蛋白复合物的动态组装和拆解对其周围施加力来重塑ECM。
NPs可以与细胞膜、细胞骨架和细胞器相互作用,从而导致细胞力学性质的改变。由于NPs的性质可以根据各种应用环境进行精心设计和控制,所以它们在体内的功能及其对生物系统的影响并不一致。目前的研究表明,NPs可以诱导细胞粘附和细胞骨架结构发生改变4-6。并且细胞刚度和迁移动力学与细胞粘附系统和细胞骨架结构密切相关。因此,细胞力学性质的扰动可以破坏细胞骨架结构,并进一步导致细胞刚性和收缩性发生相应变化。细胞骨架结构和功能的任何修饰以及细胞粘附性质的变化也会影响细胞的迁移性质,进而在胚胎发育、伤口愈合或免疫应答中发挥重要作用。
鉴于细胞力学-化学偶联研究的迫切性和必要性,本文针对细胞机械力学的分子结构特性,总结了近五年来纳米粒子与细胞相互作用的力学-化学偶联研究相关进展。在介绍与细胞力学-化学偶联性质相关的分子基础(图1)和涉及的纳米生物技术(图2)之后,重点介绍了纳米粒子影响细胞机械性质的最新工作(见后文第4节中的图3),并在此基础上进一步指出纳米生物力学-化学偶联的挑战与展望。
2 细胞机械力学的分子基础
2.1 细胞膜表面
细胞膜表面的粘附系统连接细胞内部骨架和细胞外部环境。细胞微环境的机械性质对细胞的分化和生长有着重要的影响。目前发现的影响细胞生长及行为的微环境机械力学因素包括ECM硬度及其拓扑结构、细胞在微环境中的空间受限程度、细胞所受周围流体剪切力的大小及方向、细胞与细胞之间的挤压与拉伸等7。细胞微环境对细胞所产生的影响是多参数相互平衡的结果。
在细胞膜表面的粘附系统中,ECM与细胞之间的相互作用主要通过整联蛋白(integrin)调节完成8。整联蛋白是位于细胞膜上的异质二聚体蛋白受体,调节细胞与ECM之间的粘附、细胞骨架的组装和细胞内信号通路的激活。在细胞与ECM相互作用的过程中,整联蛋白在传递化学信号的同时又转导机械信号9。在细胞粘附的早期阶段,整联蛋白在细胞边缘形成粘着复合物(focal complexes),将细胞感知的外部微环境信号传递至细胞内部,同时将细胞内部的响应信号进行向外传导,调整自身的活化状态10。整联蛋白进行信号传递时,位于粘着复合物上的衔接蛋白(如踝蛋白talin、纽蛋白vinculin、桩蛋白paxilin)和一些激酶(如粘着斑激酶Focal adhesion kinase FAK、Src及其反应底物p130 Cas)发挥着至关重要的作用11,12。例如,在传递细胞所感知的有关ECM机械性质的信号时,衔接蛋白talin首先与整联蛋白形成弱相互作用键,对粘着复合物等初期粘附结构的形成起到关键作用13,14。当整联蛋白所感知的机械力足够大时,与之相连接的talin的结构会被打开并暴露出vinculin的结合位点,而vinculin与talin结合后会进一步增强整联蛋白上的力学信号传导15。同时,整联蛋白在进行机械信号传导时也会引起络氨酸激酶、FAK和Src的磷酸化,将机械力学信号转化为生物化学信号,参与调控细胞基因的表达和表型的表达16。随着整联蛋白激活信号传导,通过募集斑联蛋白zyxin,细胞最初粘附所形成的粘着复合物也会逐渐成熟,聚集在一起形成较大的粘着斑(focal adhesion,FA),调控细胞的粘附与迁移等力学行为17。

图1 细胞机械力学信号分子Fig.1 Cell mechanotransduction and molecules.
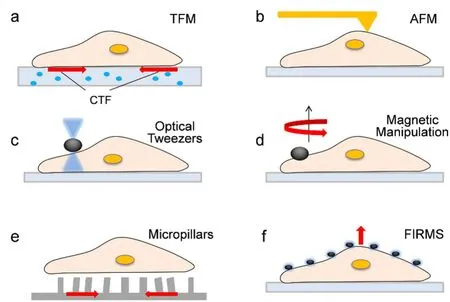
图2 测量细胞机械力学的纳米技术Fig.2 Nanotechnology-driven tools to determine cell mechanics.
细胞与细胞之间的粘附在维持组织完整性方面起着至关重要的作用,并且它们在细胞群之间传递张力从而调节集体细胞行为。细胞可以通过下调E-钙粘蛋白(E-cadherin)介导的粘附连接来改变细胞-细胞粘附的力传递。钙粘蛋白的转换(从表达E-cadherin转变为N-cadherin)伴随着从细胞-细胞粘附连接到细胞-基质粘连的力的重新分布18。因此,理解粘附连接处力传递的分子机制十分重要。其中,机械张力诱导的α-连环蛋白(α-catenin)构象变化可以控制钙粘蛋白-连环蛋白粘附连接处的力传递。α-连环蛋白还可通过调节与F-肌动蛋白、vinculin的力依赖性结合而起到机械传感器的作用19。钙粘蛋白也和整联蛋白、肌动蛋白等细胞骨架相关联,有研究表明它们之间的机械张力驱动对于细胞之间的力传导是必不可少的20。vinculin是以力依赖性方式募集细胞-基质和细胞-细胞粘附的关键分子之一,其在相应粘连处的酪氨酸残基处会被磷酸化,有利于连接的强化21。除整合素和钙粘蛋白受体外,还有其他几种细胞表面受体,如G蛋白偶联受体、受体酪氨酸激酶、离子通道和糖萼,也与细胞粘附系统密切关联22。此外,免疫球蛋白(Ig)家族的L1细胞粘附分子(L1-CAM)和神经细胞粘附分子(N-CAM)都与肌动蛋白直接或间接相关23,24。
2.2 细胞骨架
细胞骨架主要由微丝、微管和中间丝三部分组成,其中研究最多的当数微丝。细胞骨架微丝主要由肌动蛋白(actin)和肌球蛋白(myosin)组成。微球状肌动蛋白(G-actin)可自组装形成微丝状的肌动蛋白(F-actin)。辅肌动蛋白(actinin)将不同的微丝状肌动蛋白编制在一起形成细胞骨架的主要结构。Myosin位于F-actin之间,主要受到Rho及其下游效应子ROCK等蛋白的调控,为细胞的收缩运动提供原动力。近期研究发现,RhoA、Cdc42、Rac等多种Rho GTP酶是细胞粘附、迁移、骨架收缩等活动的主要调控蛋白10。RhoA可以通过myosin和成蛋白(formin)直接改变肌动球蛋白(actomyosin)收缩和应力纤维形成。Formin会使细胞骨架微丝进行直线型组装,形成杆状或者棒状骨架,最终诱导细胞丝状伪足(filopodia)的形成,并主要受蛋白因子Cdc42调控。与formin相比,Arp2/3则调节细胞骨架微丝组装成网状结构,有助于细胞片状伪足(lamellipodia)的形成,而Rac在其中发挥着主导作用。Cofilin和Cap蛋白在细胞骨架微丝的解聚和封端过程中发挥作用。细胞微管作为一种动态的结构,可以通过抑制FA的收缩性和定位来阻止FA生长25。同时细胞微管为细胞内物质的运输提供特定的轨道。细胞中间丝有助于细胞骨架的加固,与微管、微丝一起维持细胞形态和参与胞内物质运输。
2.3 细胞核
由于细胞骨架的收缩,细胞核会受到很大的挤压力。核被膜(nuclear envelop,NE)在感知机械信号和调整细胞核的形态及功能方面起着至关重要的作用。NE是双膜结构,并且与亚核结构相关联,例如核骨架和细胞骨架的连接复合物(LINC)、核孔复合物等。LINC复合物跨越NE结构,包含Nesprin和SUN(Sad1 Unc-84)蛋白。LINC复合物在细胞质和核质之间提供直接的物理连接,有利于来自ECM的机械信号转导。在外部NE中,Nesprins与细胞骨架网络和核周区域内的SUN蛋白相互作用。在内部NE中,SUN蛋白与核纤层蛋白和核质成分结合26,27。LINC复合物在许多方面类似于整联蛋白在细胞表面的粘连,可作为跨核膜的机械力学传导蛋白,允许力穿过NE以进行适当的核定位28。除了结构相似性之外,LINC复合物可以像细胞表面整联蛋白一样,进行结构重塑以响应力的传导,从而加强细胞质和核层之间的交流29。
基底几何形状可以调节细胞骨架介导的应力和细胞核的形态。最近的证据表明由肌动球蛋白收缩力调节的染色体的相对取向可对基因组调控产生较大影响30,31。基质硬度、形貌和细胞几何形状等机械因素可以控制细胞核和细胞质之间转录辅助因子(如YAP和TAZ)的穿梭及其与细胞质的相互作用,其中F-actin的聚合与Hippo信号通路的激活对活化YAP/TAZ起到关键作用,进而影响非编码RNA的活性、组蛋白的翻译修饰和细胞中基因的表达32-34。
3 研究细胞机械力学的纳米技术
3.1 牵引力显微镜
细胞牵引力(CTF)是细胞与ECM/基质相互作用时对底物产生的力,它来源于肌动球蛋白的收缩和肌动蛋白的聚合。牵引力显微镜(Traction Force Microscopy,TFM)可以通过分析细胞附着时基底上嵌入的荧光微纳粒子的位移来测量细胞在二维或三维基底上产生的力35。由于细胞形状、迁移及其他重要的细胞功能受CTF影响,因此可以利用牵引力显微镜来测量影响细胞迁移、分裂、形态变化和癌症侵袭的收缩力及细胞粘附力等。
3.2 原子力显微镜
原子力显微镜(Atomic Force Microscopy,AFM)可以测得pN量级微弱的相互作用力,适用于生理和病理条件研究生物系统内细胞、蛋白质和DNA等的相互作用36。目前,AFM已被用于分析单个细胞的机械性质,如膜的刚度、细胞骨架和细胞核的弹性和粘度。除了使用常规商业纳米尺寸AFM尖端的细胞膜压痕法来探测细胞力学,还可对AFM尖端进行修饰使其作为探针以获得更优秀的性能,如使用附着于悬臂尖端的SiO2珠,增加探针与细胞膜的接触面积,从而允许在细胞上进行深度压痕(≈ 3 μm)而不穿透细胞膜,以进一步研究亚细胞结构的机械性质。
3.3 光镊
光镊(Optical Tweezers,OT)是一种光学捕获技术,它可以对作用在细胞膜和细胞质上的力进行直接研究,因而被广泛用于研究细胞机械力学性质37。通过光捕获和操纵,产生由微粒、细胞、蛋白分子之间相互作用引起的光学力。在细胞的机械性质研究中,被光学操纵的微粒可以连接到质膜上,由细胞质内化或者被功能化从而靶向特异的膜转运蛋白。近年来,光镊技术发展快速。多光镊装置的发展允许多个光镊在单个细胞上同时使用以提供不对称应力。此外,光镊也可以和AFM、荧光共振能量转移等技术结合以进行更深入、全面的细胞机械性能研究。
3.4 磁控
磁控(Magnetic Manipulation)是研究机械传导和生物力学的极其有用的工具。在细胞的机械性质研究中,磁控主要是通过外加磁场操纵磁性粒子将小而精确定位的力引入特定细胞区域及表面受体,进而操纵与粒子相连的生物分子38,39。目前,磁控技术已经能够量化细胞质和细胞核的机械性质,并且用于研究机械信号转导途径40。磁性粒子也可以制备成不同的尺寸和形状,如纳米球形颗粒、微米珠和棒状结构。作为细胞力学探针的磁性粒子可以连接到质膜上、由细胞内化或者被功能化以靶向膜受体,甚至可以靶向细胞内的特定位点。与光镊和AFM等其他技术相比,磁控具有以非侵入的方式对特定细胞区域和受体施加良好控制力的优点。
3.5 微柱
微柱系统(Micropillars)通过使用弹性微针状柱阵列来操纵和测量细胞与基底之间的机械相互作用,通常用于研究细胞牵引力41。在微柱系统中,每个柱子具有已知的弹簧常数,且柱的偏转独立于相邻柱发生,因而可以直接分析牵引力的亚细胞分布。由于作用在柱子上的力与柱子的变形成正比,因此可以通过柱位移的变化来测量施加在弹性柱上的细胞力。使用微柱研究细胞力学的优点是细胞与基底之间的相互作用力可以直接由柱子偏转位移计算得来,且微柱刚度可调。但是,细胞粘附可能受到不连续基底的影响,并且微制造技术限制了刚度范围。
3.6 力诱导剩磁谱
力诱导剩磁谱(Force-Induced Remnant Magnetization Spectroscopy,FIRMS)使用高灵敏度的原子磁力仪,以磁性颗粒作为分子探针,通过磁标记的形式测量分子及细胞的剩磁信号作为外界微扰力的函数42。采用磁性微珠作分子探针时,随着外界微扰力振幅的逐渐增加,不同的分子间非共价键将在不同的微扰力下发生解离,相应剩磁信号的降低表明解离过程的发生,可用于分析核酸、蛋白分子之间相互作用力,研究生物分子识别的机理43,44。采用纳米磁探针标记细胞时,既可以通过剩磁信号随外界微扰力的变化测量细胞的粘附力,也可以通过剩磁信号随时间的变化测量细胞的迁移率45,46。FIRMS可以测得pN量级的分子及细胞相互作用力,具有优异的检测灵敏度、空间分辨率和分子特异性。此外,FIRMS还具有高通量性能,适合于复杂体系的细胞力学研究。
4 纳米粒子对细胞机械性质的影响
NPs会与细胞膜表面的粘附分子和细胞内部的骨架蛋白相互作用,进而影响细胞刚度及细胞的粘附迁移等力学机械性质。因此,阐明NPs对细胞力学-化学偶联的影响有助于加深理解NPs与细胞的相互作用。本小节将主要讨论NPs对细胞力学的影响,包括细胞膜表面的粘附、细胞内部的骨架、细胞刚度及细胞迁移。
4.1 细胞粘附
细胞的粘附发生于细胞与底物(如ECM、细胞或组织)接触时。根据细胞粘附或连接的功能可分为三类:第一类是紧密连接,形成穿过上皮细胞层的不可渗透屏障;第二类是通讯连接,允许细胞之间小分子的运输;第三类是锚定连接,连接细胞骨架(如肌动蛋白和中间丝)到其临近细胞或ECM。锚定连接包括细胞-ECM粘附的粘着斑、细胞-基底层粘附的半桥粒、细胞-细胞粘附的桥粒和粘附连接。已经有大量研究表明,内化或附着于细胞膜的NPs会对细胞粘附产生影响,但是明确的机制仍然未知。
细胞粘附涉及整联蛋白和ECM配体的结合与聚集、肌动蛋白和细胞骨架的收缩等。整联蛋白受体簇是细胞粘附的重要标志物。可以通过监测粘着斑及整联蛋白受体簇的形成过程来表征NPs对细胞-ECM粘附的影响。Qin等人用直径为1.7 nm的具有特殊表面电荷和官能团的富勒烯醇纳米粒子处理人乳腺癌细胞(MCF-7和MDA-MB-231),发现富勒烯醇纳米粒子会导致肌动蛋白细胞骨架重组从而影响整联蛋白在细胞内的分布47。他们观察到标记的整联蛋白主要分布在对照细胞的丝状伪足中,而富勒烯醇处理的细胞则主要位于细胞质中。丝状伪足是肌动蛋白束的主要支撑结构,对细胞运动和粘附很重要。他们认为富勒烯醇处理减少了丝状伪足的数量和长度,同时抑制整联蛋白在丝状伪足上形成簇,从而导致处理后癌细胞的低粘附能力。血管内皮细胞钙粘连蛋白(VE-cadherin)是细胞间连接的重要蛋白。Peng等人的工作表明,TiO2、SiO2NPs的存在会破坏VE-cadherin之间的相互作用,从而破坏了细胞间的粘附连接,导致内皮细胞泄露,促进了乳腺癌细胞的转移(图3a)48。
已经有许多研究表明纳米粒子对细胞粘附的影响存在浓度依赖性。Pöttler等人使用超顺磁性氧化铁纳米颗粒(SPIONs)处理兔声带成纤维细胞(VFF),发现SPIONs对VFF粘附表现出浓度依赖性抑制49。当SPIONs浓度为20 μg·cm-2时,与未用SPIONs处理的对照组相比,并没有观察到显着差异。然而,当SPIONs浓度增加为40和80 μg·cm-2时,细胞的粘附能力显著降低。
除了考虑纳米粒子浓度因素,纳米粒子对不同种类细胞的机械性质的影响也是不同的。Tay等人的工作表明TiO2、SiO2和羟基磷灰石(HA) NPs能够通过增加成熟粘着斑的表达增强TR146上皮细胞的粘附强度5。他们使用牵引力显微镜直接测量细胞粘附强度,未经处理的对照组平均牵引力为72 ± 11 Pa,而TiO2、SiO2和HA NPs处理的细胞牵引力则分别显著增加至126 ± 8、99 ± 9和109 ± 7 Pa。这与大部分研究报道的NPs处理后细胞的粘附能力降低的情况存在差异。
4.2 细胞骨架
真核细胞的细胞骨架由微管、肌动蛋白微丝和中间丝三种类型的蛋白丝组成。微管是由α和β微管蛋白聚合构建的,其中聚合的成核由γ微管蛋白介导。肌动蛋白微丝是通过G-actin的聚合形成的,而中间丝在各种类型的细胞中由不同蛋白质组成,包括角蛋白、波形蛋白、神经丝蛋白、核纤层蛋白和巢蛋白等。目前的研究发现,NPs与细胞骨架蛋白之间可以通过静电力、范德华力、疏水作用或氢键发生相互作用,从而影响细胞骨架的完整性,导致肌动蛋白微丝的不稳定和降解以及诱导微管的不稳定和功能紊乱,最终造成细胞损伤甚至死亡。
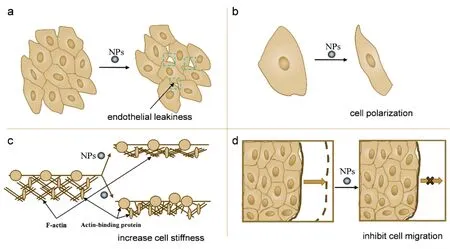
图3 纳米粒子影响细胞的机械性质。(a) TiO2纳米粒子的存在可破坏VE-cadherin之间的相互作用,从而破坏细胞间的粘附连接,导致内皮细胞泄露。(b)高浓度的氧化铁纳米粒子改变细胞骨架结构,使细胞发生明显的极化。(c)纳米粒子引起细胞硬度的增加可能是由于细胞内actin堆积更为紧密或者是actin结合蛋白的增多。(d)纳米粒子的加入可使细胞粘附增强,从而阻碍细胞迁移Fig.3 Nanoparticles affect cell mechanics.(a) TiO2 nanoparticles induce endothelial leakiness through disruption of the VE-cadherin homophilic interactions at the adherent junction.(b) High iron oxide nanoparticles concentrations affect cellular cytoskeleton and lead to cell polarization.(c) Nanoparticleinduced cell stiffness increasement could be explained by actin polymerization or increase of actin-binding protein.(d) Nanoparticles enhance cell adhesion and inhibit cell migration.
Li等人研究了两种不同尺寸的硅纳米粒子Nano-Si64和Nano-Si46对L-02细胞系中多核细胞形成的影响50。发现在纳米粒子处理组中,肌动蛋白以各向异性网络组织排列,具有相当差的细丝束且微丝的数量明显减少。另外,L-02细胞中微管的分布也发生了改变。在对照组中,微管均匀分布细胞质中,而在纳米粒子处理的细胞中微管则聚集在细胞核周围。Xie等人的工作也表明NPs会破坏肌动蛋白结构51。他们用直径约为52 nm的AgNPs处理MG-63细胞。荧光结果显示,暴露于AgNPs后,MG-63细胞中F-actin的荧光强度减弱。特别是在5 μg·mL-1的剂量下,观察到MG-63细胞的收缩以及F-actin结构稀疏和无序。此外,Cuyper等人发现在较高的磁性纳米颗粒(MNPs)浓度下(1000 μg·mL-1),小鼠C17.2神经祖细胞(NPCs)和原代人血液生长外周内皮细胞(hBOECs)的细胞骨架都发生了明显的变形(图3b)52。从actin和微管的荧光共聚焦图来看,MNPs处理后的细胞较对照组细胞都产生明显的极化。
然而NPs对细胞骨架影响并不总是负面的。Qin等人使用20 nm的AgNPs研究了其对尿源性干细胞(USCs)成骨分化的影响53。发现4 μg·mL-1的AgNPs处理可以激活USCs细胞的RhoA信号通路,诱导肌动蛋白聚合,并增加细胞骨架张力,从而导致USCs进入成骨分化,而2 μg·mL-1的AgNO3并没有这种作用,因此他们认为AgNPs促进USCs中的成骨分化是由AgNPs本身产生的,而不是它们释放的银离子。
4.3 细胞刚度
细胞刚度反映细胞对外部诱导变形的抵抗力,通常用杨氏模量表示。研究表明细胞骨架在细胞刚度和收缩性方面发挥着重要的作用。例如在癌细胞中肌动蛋白纤维排列有序性下降,杨氏模量更小54。NPs诱导细胞刚度改变涉及十分复杂的机理,纳米粒子的参数以及不同的细胞类型都会对细胞刚度的改变产生不同的影响。
原子力显微镜(AFM)的压痕实验通常用来测量细胞刚度。Mao等人使用AFM研究铁-铁氧化物核-壳磁性纳米粒子(直径为16 ± 1.5 nm)对牛关节软骨细胞(BACs)力学性能的影响55。他们发现与纳米颗粒共培养的BACs显示出更高的刚度,并且其杨氏模量随着纳米粒子浓度的增加而增加。用浓度为0,5,10,20和50 μg·mL-1的纳米颗粒培养细胞的杨氏模量值分别为1.78 ± 0.82,1.82 ± 1.07,3.02 ± 1.56,3.60 ± 1.71和3.80 ± 1.69 kPa。Ogneva等人的研究也表明在Si和SiB NPs存在下间充质干细胞MSC的刚度升高,且同时伴随着F-肌动蛋白含量的改变(图3c)56。他们认为,刚度升高可能与纳米粒子导致的皮质细胞骨架的结构重组(应力原纤维之间的“交联”数量增加)以及细胞表面的修饰或相互作用有关。
然而与上述结论不同,Qin等人的研究表明纳米粒子的存在会干扰肌动蛋白动力学从而降低细胞刚度47。他们通过AFM测量乳腺癌细胞(MDAMB-231和MCF-7细胞)和正常细胞(MCF-10A细胞)的杨氏模量值,发现12.5至200 μg·mL-1富勒烯醇处理的细胞杨氏模量明显降低。
4.4 细胞迁移
细胞迁移/运动在胚胎发生、伤口愈合及免疫应答等过程中起到了重要作用。细胞迁移过程主要涉及四个步骤:细胞的极化、细胞膜或片状突起的突出、片状伪足的形成与延伸、在ECM上形成新的粘附或细胞收缩这四个步骤。目前研究结果表明,NPs能够通过不同的机制改变细胞迁移的速度。细胞骨架、细胞粘附以及细胞迁移相关蛋白/分子表达的改变都会影响细胞迁移性质。
细胞骨架对细胞迁移起着重要作用。肌动蛋白丝在细胞膜下特别丰富,形成高度有序的结构,调节细胞迁移的网络。Tian等人研究发现内化的氧化石墨烯(GO)纳米片可以通过破坏肌动蛋白丝来阻止A549细胞迁移57。实验表明,GO纳米片表现出对肌动蛋白单体强的结合能力,导致其二级结构发生显着变化并破坏肌动蛋白丝。分子动力学模拟结果显示,GO纳米片可以通过范德华相互作用插入肌动蛋白四聚体的链间间隙并破坏四聚体,从而破坏肌动蛋白丝的整体结构。
NPs对细胞粘附性质的改变也影响着细胞迁移行为的变化。Tay等人的研究结果表明,TiO2、SiO2和HA NPs能够通过增加成熟粘着斑的表达增强TR146上皮细胞的粘附强度,促进细胞在基质上的稳定锚定,从而限制细胞迁移(图3d)5。Sun等人发现TiO2-PEG NPs可抑制NCI-H292细胞的迁移过程58。其中,NPs与整合素β1的结合促进了整合素β1到溶酶体的内吞作用,导致整合素β1的表达降低。而由于上游整合素β1的活化减少,pFAK表达降低,削弱了pFAK和F-肌动蛋白之间的结合,并导致F-肌动蛋白结构的解束和破坏,从而抑制细胞迁移。这种抑制效果具有NPs尺寸依赖性。
此外,Vieira等人发现AgNPs和AuNPs可以通过减少与细胞迁移相关蛋白的表达抑制人成纤维细胞迁移59。免疫荧光分析显示,AgNPs或AuNPs处理降低了胶原蛋白和层粘连蛋白的产生。并且AgNPs处理降低了胶原受体(极晚期抗原2,α2β1整联蛋白)和层粘连蛋白受体(极晚期抗原6,α6β1整联蛋白)的表达。细胞骨架重组的分析表明,这两种纳米颗粒处理增加了应力纤维的形成和细胞突起的数量,导致细胞极性受损。
5 总结与展望
纳米材料在生物医学领域的广泛应用使得其生物安全性越来越受关注,然而目前有关微纳米粒子与生物系统(细胞、组织等)详细作用的机制仍然不清楚。大部分研究都通常集中在具有特定物理化学性质的微纳米粒子的细胞毒性、细胞摄取等方面,研究纳米粒子与细胞的力学-化学偶联作用成为新的研究前沿。因此,本综述重点总结了近五年纳米粒子对细胞机械力学方面影响的相关研究以及用来研究细胞机械力学的主要纳米技术。从细胞表面粘附受体、细胞骨架及细胞核三个方面阐述了涉及细胞力学-化学偶联的主要分子及信号通路。其中,整联蛋白和钙粘蛋白在感知细胞外部机械力和力传递方面发挥着重要作用。肌动蛋白和微管作为细胞骨架网络的重要组成部分起着机械传导的桥梁作用。细胞核也可以通过基质的收缩受到周围细胞骨架的机械力。此外,核被膜在感测机械信号和调整细胞核的形态和功能方面也起着至关重要的作用。
在介绍了细胞机械力学相关的分子基础上,我们进一步总结了近几年有关纳米粒子对细胞机械力学影响的相关研究进展。值得注意的是,纳米粒子对细胞机械力学的影响涉及复杂的机制,纳米粒子的种类、尺寸、浓度、官能团的修饰以及带有电荷与否都会直接或间接地影响其与细胞的相互作用,可能产生不同的影响。因此,很难完全明确地认定某种粒子对生物体是否有害,粒子参数的多种因素都应被考虑在内。基于目前的文献调研,在表1中总结了纳米粒子对细胞力学-化学偶联的影响,主要表现为:(1)可以通过破坏紧密和粘附连接并调节细胞-ECM粘附改变细胞的粘附能力;(2)可以和细胞骨架蛋白(肌动蛋白和微管蛋白)相互作用导致微管和F-肌动蛋白结构的重构或破坏;(3)可以通过细胞骨架的结构重组改变细胞刚度;(4)可以通过细胞骨架、细胞粘附以及细胞迁移相关蛋白/分子表达的改变影响细胞迁移性质。
细胞机械力学在生物体发育、生理学和疾病发展中起着重要作用。借助纳米技术可对细胞或组织的机械力学性质进行表征,从新的视角诠释生命活动规律,十分具有发展前景。本文对目前研究细胞机械力学主要的纳米技术(如TFM、AFM、光镊、磁控、微柱以及FIRMS)也做了简要介绍。然而,目前纳米粒子对细胞力学-化学偶联的影响尚未被深入研究。未来增强认识纳米粒子影响细胞机械性质的分子机制,对完善纳米生物安全评价体系是十分有必要的。此外,发展基于纳米生物力学-化学偶联的诊断与治疗新方法也将为纳米材料在生物医学领域的应用拓展新方向。
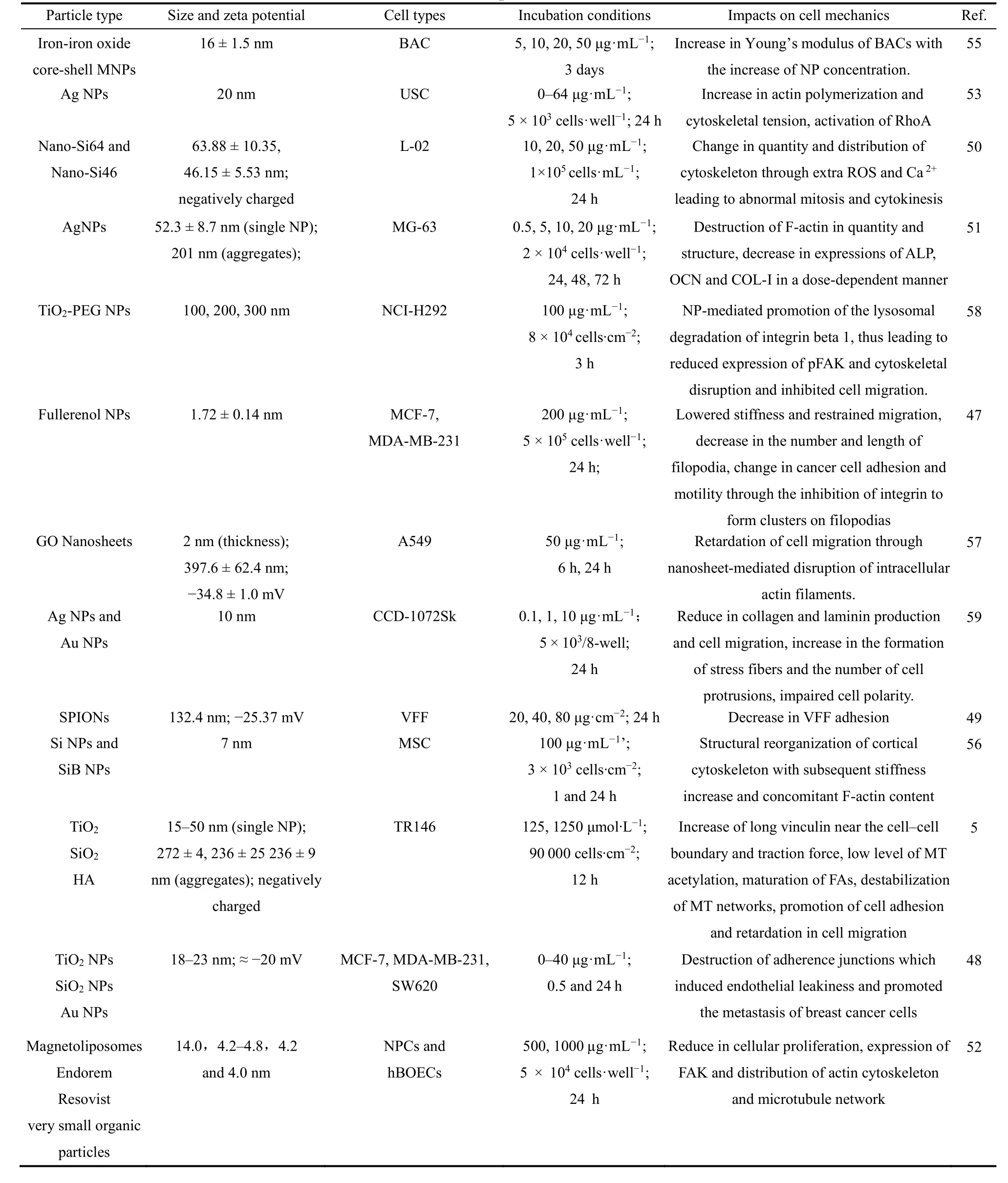
表1 纳米粒子对细胞机械性质的影响Table 1 Effects of nanoparticles on cell mechanics.

