五种植被覆盖下红壤的细菌群落结构组成及其特征
黎 烨,雷少楠,程志强,张 婷,金玲月,舒 琳,林春梅,赵 珂,田宝玉
(福建师范大学生命科学学院细胞逆境响应与代谢调控福建省高校重点实验室,福建 福州 350108)
土壤微生物在物质和能量循环、维持土壤肥力及促进植物生长方面发挥着不可或缺的作用[1],紧附于植物根系薄层土壤内的微生物是连接土壤和植物间的桥梁[2].土壤的酸碱性、植物营养状况、温度、湿度、基因型以及宿主发育阶段均能影响根际微生物群落结构和组成[3-5].随着16S rDNA测序技术在研究拟南芥[6-7]、玉米[8]、水稻[9]、马铃薯[10]、番茄[11]、烟草[12]和大豆[13]等经济作物土壤微生物群落中的广泛应用,人们发现了大量不能通过传统培养方法分离的微生物种类,根际细菌群落组成和多样性及其与不同植物间的关系被逐渐揭示[14].与无植被覆盖的土壤环境相比,植物根部的渗出物为根际微生物提供营养,增加了根际微生物的生物量和代谢活性[15-16],影响了根际细菌群落的结构和功能.研究证实,不仅植物种类和栽培品种影响着根际土壤微生物群落[6,8-9,13,17],植物基因型差异也对根际微生物的细菌群落结构和组成产生影响[18-19],如突变型与野生型大麦根际土壤的微生物多样性和部分物种丰度差异明显[3].先前对植物和土壤微生物互作关系的研究大多集中在重要农业或经济作物,对自然发育植物的土壤微生物关注很少[19].为了解不同植物对土壤微生物的潜在影响,以及探索新的微生物资源,还需进一步对土壤微生物多样性、差异性进行深入研究.
红壤是我国南方地区典型的土壤资源,也是我国重要的经济农作物产区.红壤是土壤生态系统中一种典型的特殊生境,具有与其它类型土壤不同的细菌群落组成结构和多样性[20].尽管关于红壤水土流失治理的研究颇有成效,但待探究的微生物信息还很多.本研究于福建省福州市旗山下自然发育5种植被的红壤进行采样,利用Miseq高通量测序技术对红壤中细菌16S rDNA基因V5~V7可变区进行测序,详细对比了样本中和样本间的细菌菌群组成和多样性,为揭示红壤环境下的核心微生物组以及不同植被对红壤微生物群落组成结构的影响提供参考.
1 材料与方法
1.1 样品收集
于2018年11月25日在福建省福州市旗山附近一片红壤地点(N26°01′,E119°12′),根据统计学5点取样法收集5种植被土壤样品,取样草坪均为自然发育形成.5个取样点覆盖植被分别为艾草(Artemisiaargyi)、一年蓬(Erigeronannuus)、马唐(Digitariasanguinalis)、鬼针草(Bidenspilosa)和飞扬草(Euphorbiahirta),其中艾草属多年生草本植物,其它4种均为一年生草本植物.选取处于营养后期(生长时间达6~7个月)且覆盖较多的位点.除去腐植和散土,取紧附根际的薄层土,每种植被取5个样品,混合后样品分别标记为AaS(艾草土样)、EaS(一年蓬土样)、DsS(马唐土样)、BpS(鬼针草土样)和EhS(飞扬草土样).过筛进一步除去植物根组织及其它杂质,收集10 g土壤于无菌自封袋中,4 ℃冰箱保存.土壤速效磷含量的测定采用碳酸氢钠浸提—钼锑抗比色法(Oslen法),速效钾含量的测定采用乙酸铵提取—火焰光度法,铁含量的测定采用二乙三胺五乙酸浸提—原子吸收分光光度法.
1.2 土壤总基因组DNA的提取和16S rRNA基因片段的扩增
1.2.1 样品处理与全基因组的提取 分别称取0.5 g土壤于2 mL EP管中,土样总DNA的提取参考FastDNA Spin Kit for Soil试剂盒说明书进行.使用超微量分光光度计(Thermo NanoDrop 2000,USA)检测总DNA浓度和纯度(D260nm/D280nm).提取后的DNA储存于-20 ℃冰箱中备用.
1.2.2 细菌16S rRNA基因片段的扩增 以提取土样的DNA为模版,通过细菌16S rDNA特异性引物799F(5′-AACMGGATTAGATACCCKG-3′)和1193R(5′-ACGTCATCCCCACCTTCC -3′)来扩增各样本16S rRNA基因的V5~V7可变区.聚合酶链式反应(PCR)体系为50 μL:DNA模板2 μL,引物1(1193R)和引物2(799F)各1 μL,DNA Tag聚合酶25 μL,灭菌双蒸水21 μL.反应30个循环:95 ℃初始变性5 min,然后在94 ℃变性30 s,在60 ℃退火1 min,在72 ℃延伸90 s,在72 ℃下最后延伸7 min.通过1%琼脂糖凝胶在100 V条件下持续电泳30 min,通过UV照射凝胶成像系统判断扩增产物的片段大小,并使用QuantiFluor-ST 蓝色荧光定量系统(Promega,USA)做定量检测[21],DNA检测合格后等量混合用于高通量测序.
1.3 扩增子Miseq高通量测序
扩增的PCR产物送至上海生物工程有限公司进行高通量测序.测序使用Illumina Miseq平台,采用PE 2x250 bp测序策略.
1.4 原始序列的处理与统计
高通量测序获得的原始序列按样品Barcode标签拆分后,采用FLASH(version 1.2.3)软件对成对的短读取序列(reads)进行拼接[22].利用Cutadapt(version 1.9.1)软件去除已拼接序列中的Barcode和引物序列.接着使用USEARCH (version 8.1.1861)软件对序列进行初步质控,去除低质量序列,包括含有模糊碱基、引物错误、平均质量分数低于25或者长度小于200 nt的序列[23].初步质控过滤后的序列利用USEARCH软件的de novo方法进行嵌合体序列检查和去除,最终得到用于聚类和分类分析.
1.5 土壤细菌菌群结构和多样性分析
1.5.1 细菌菌群结构分析 为了保证结果的均一性,首先对每个样品按最小的序列数进行随机抽平处理.抽平后的序列利用Usearch平台进行聚类分析,将序列相似度≥97%的序列命名为一个操作分类单元(OTU).选取每一聚类中丰度最高的序列作为该OTU的代表序列.得到的代表序列使用QIIME程序包RDP Classifier的方法与SILVA数据库进行比对注释,得到每个OTU对应的物种分类学信息.统计各个样品的OTU序列数目和分类信息,生成OTU表,绘制各个样品不同分类水平物种结构组成柱状图.
1.5.2 细菌多样性分析 基于得到的OTU表,利用R语言pheatmap统计丰度排名前60的OTU并绘制热图;使用VennDiagram包绘制Venn图揭示样品间共有的OTUs.使用QIIME包计算各样品的α-多样性并绘制OTU稀释曲线.α-多样性用来衡量各样品内的物种多样性和丰度差异,主要通过Chao1指数、Shannon指数、覆盖率等指标来表达.采用QIIME进行基于unweighted_unifrac距离矩阵的主成分分析(principal component analysis,PCoA)和相似度分析来评估样本的β-多样性及不同样本群落组成相似性和差异.
2 结果与分析
2.1 不同土壤微生物群落的α-多样性
5个样品经严格质控后总共获得了124 548条有效序列,为了保证每个样品序列总数一致,对5个样品按序列最小值23 012进行随机均一化处理,最后得到115 060条有效序列以及2 741种OTU(表1).
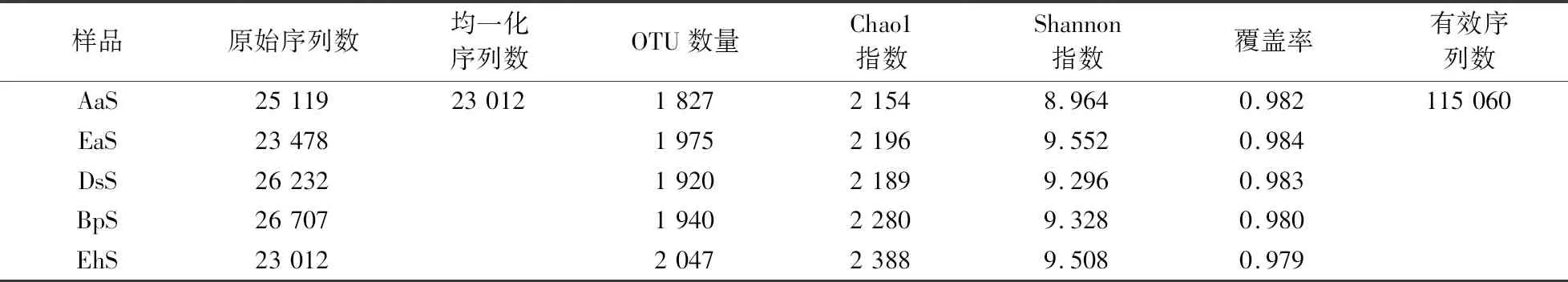
表1 所有样品序列数与α-多样性指数Table 1 Total sequences numbers and α- diversity indexes
由图1可得,随着测序条数的增加,样本物种丰度(Chao1指数)和多样性(Shannon指数)曲线先急剧上升随后趋于平缓.测序覆盖率约98.0%,说明测序深度覆盖了样本的绝大多数物种,测序结果范围合理.
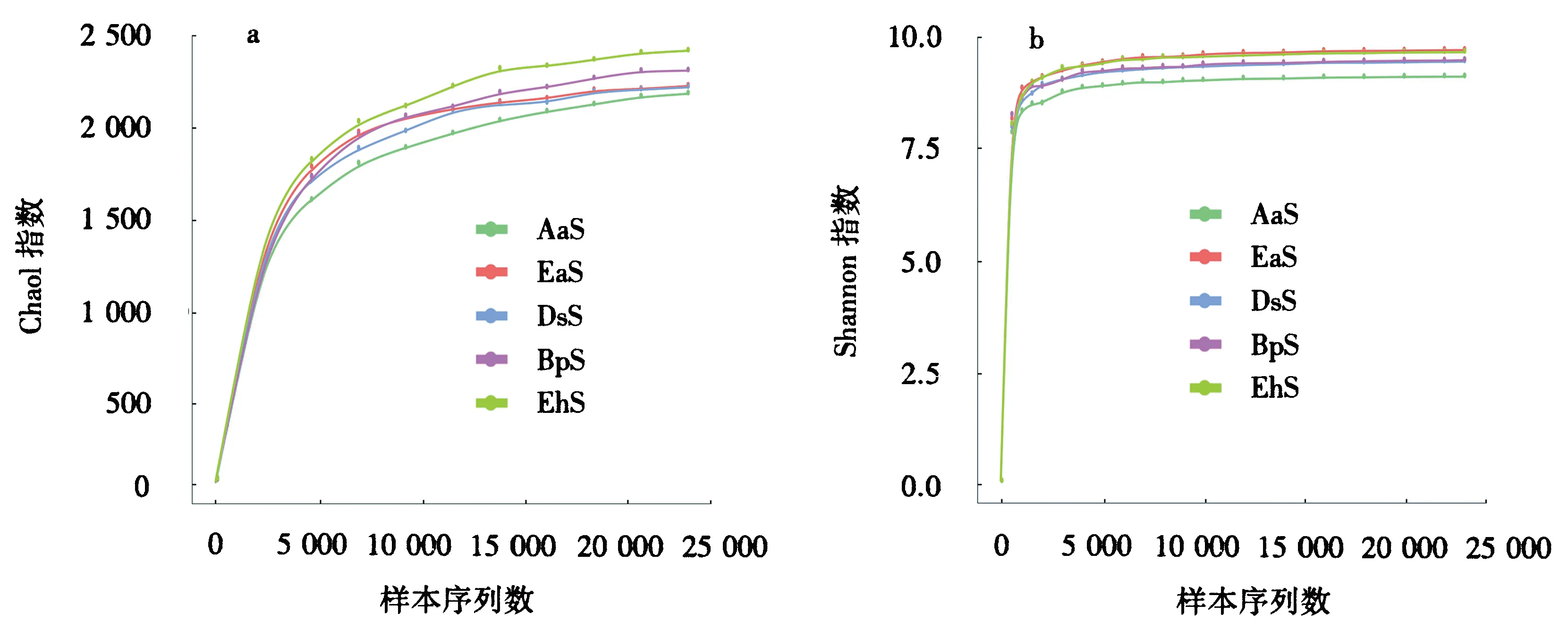
图1 所有样本Chao1指数曲线(a)和Shannon指数曲线(b)Fig.1 OTU rarefaction curves and Shannon index curves of all samples
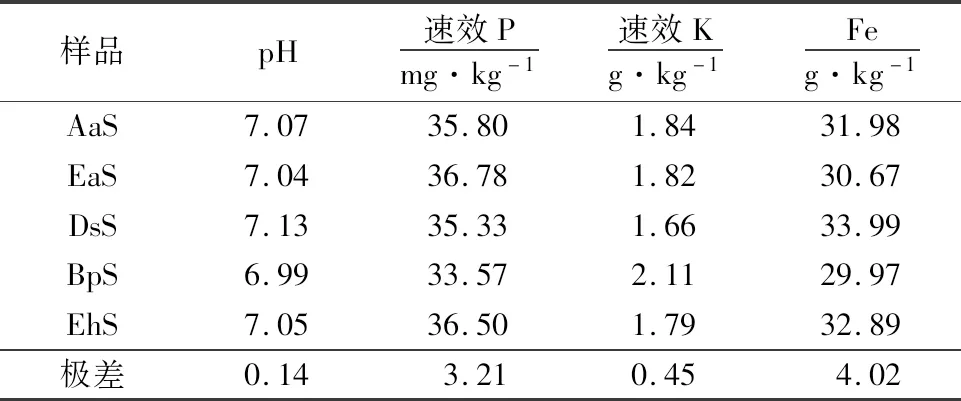
表2 土样的部分理化参数Table 2 Basic parameters of soil samples
多样性指数统计结果(表1)显示,EhS的Chao1指数最高(2 388),AaS的Chao1指数最低(2 154);EhS和EaS的Shannon指数(9.508和9.552)高于其它样品,AaS的Shannon指数最低(8.964).综合Chao1指数和Shannon指数,EhS群落α-多样性最高,说明其物种丰度相对丰富和均匀,而AaS群落α-多样性最低,表明该群落优势种群相对突出,单个物种的丰度较高.
5种植被下土样的部分理化性质如表2所示,各项指标无显著性差异,表明此片红壤菌群落组成和多样性差异主要来源于地上植被的影响.
2.2 土壤细菌群落结构组成和核心种群
通过将样品的OTU代表序列与SILVA数据库进行比对,一共注释到37个门分类与210 个目分类,其中各样品相对丰度前15的门与目分别占所有门和目分类的98%和60%以上(图2).结果显示,在门水平上红壤细菌菌群主要由变形菌门(Proteobacteria,37.8%±2.1%)、酸杆菌门(Acidobacteria,17.7%±3.8%)、拟杆菌门(Bacteroidetes,16.5%±6.15%)、疣微菌门(Verrucomicrobia,8.9%±1.1%)、绿弯菌门(Chloroflexi,3.4%±1.5%)、放线菌门(Actinobacteria,3.9%±2.4%)、浮霉菌门(Planctomycetes,4.4%±0.9%)、芽单胞菌门(Gemmatimonadetes,2.7%±0.9%)和硝化螺旋菌门(1.8%±1.0%)等构成.总体上5个样本在门水平上的群落组成结构没有显著性差异,其中变形菌门在5个样本中都占据了较高的比例(35.6%~39.9%),但在个别门的丰度上存在较大差异,如EaS中硝化螺旋菌门(Nitrospiraes,2.8%)比其它样品(0.8%~1.1%)高出近1.5倍;BpS的拟杆菌门(Bacteroidetes,22.8%)大约是其它样品(10.5%~14.5%)的2倍;EaS中的放线菌门(Actinobacteria,6.3%)高出其它样品(1.5%~3.5%)约2倍.
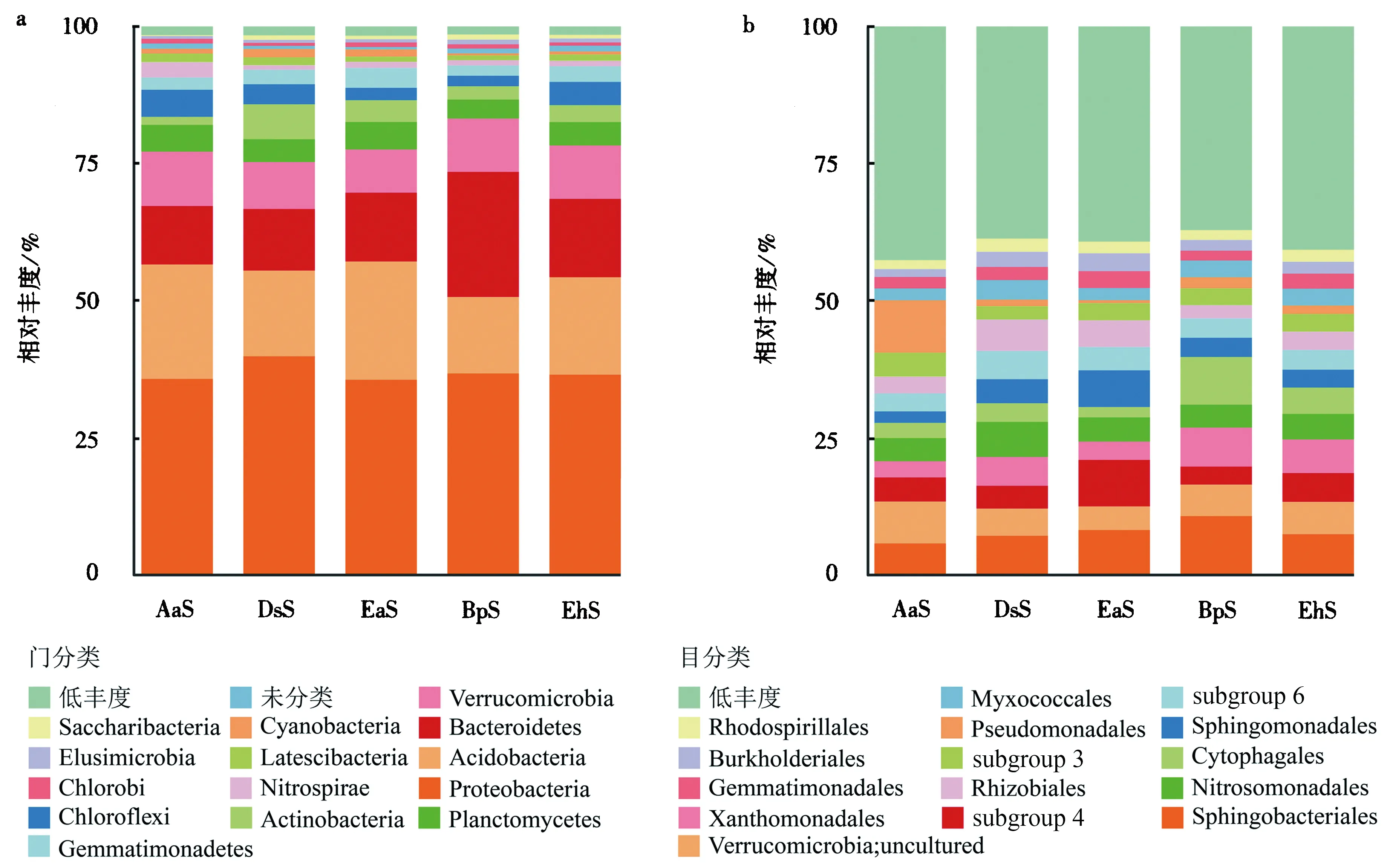
图2 不同样品中群落在门水平(a)和目水平(b)上的组成和相对丰度Fig.2 Bacteria composition and relative abundance of different samples at phylum level (a) and order level (b)
但不同土壤样品在目分类水平上的细菌菌群丰度差异明显,如AaS中变形菌门中的假单胞菌目(Pseudomonadales,9.6%)的丰度较高,其它样品中假单胞菌目的丰度仅0.5%~2.0%,相差最高达20倍;BpS中噬纤维菌目(Cytophagales,8.7%)相对丰度高于其它样品(1%~4%).不同样品间物种丰度差异明显的原因可能归结为根际效应,即植物根系分泌的有机物可以使得微生物形成正(负)趋化性,从而对群落结构产生影响[25].由此可得,红壤环境具有较稳定的核心微生物群落结构和组成,但个别物种丰度可能因不同植被而发生变化.
图3显示,5个土样一共有984个共有OTUs,大部分共有OTUs归属于变形菌门、酸杆菌门、拟杆菌门、硝化螺旋菌门、疣微菌门、绿弯菌门和放线菌门等优势菌门.共有OTUs数目在各样品中占其OTUs总数的47.9%~53.6%,其中属于变形菌门的占11.8%,酸杆菌门的占15.9%,拟杆菌门的占11.5%.AaS、EaS、DsS、BpS、EhS所特有的OTUs数目分别为62、50、82、19、33,主要归属于梭杆菌门(Fusobacteria)、迷踪菌门(Elusimicrobia)、SHA-109和Aerophobetes等相对丰度较小的细菌门类,占各样品OTUs总数的1.0%~4.0%.由此得出,不同红壤样品间细菌物种组成差异较小,相似性更高,不同植被条件下红壤的核心微生物群落组成较稳定;但不同植被条件会造成土壤环境中个别种群在种类和丰度上存在差异.
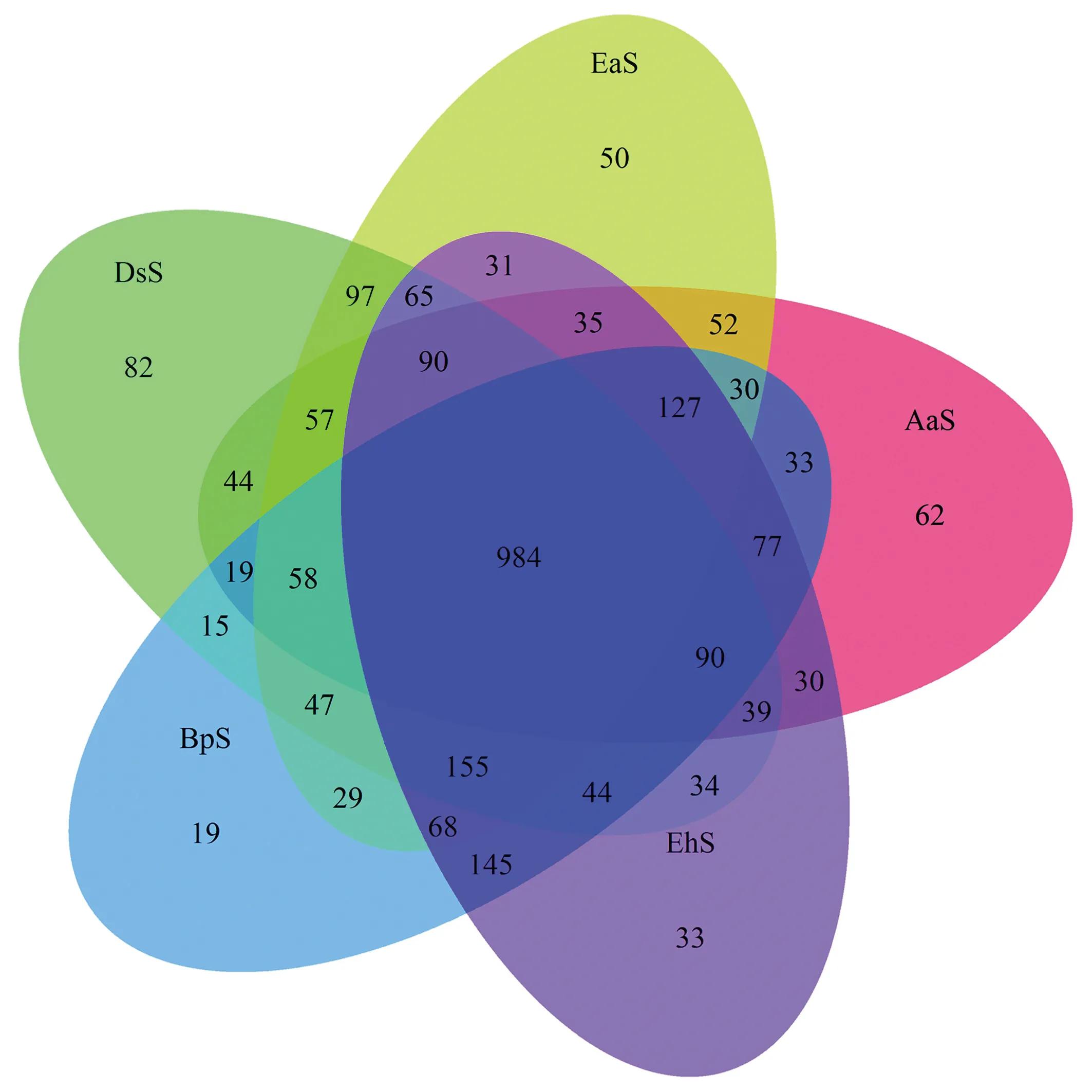
图3 不同样品OTU分布的Venn图Fig.3 Venn profile of OTUs in different samples
2.3 不同土壤样品菌群结构相似性和β-多样性
PCoA分析可根据不同样品间的相对距离判断各样本间的差异.由图4可得,样品BpS与EhS在第1主成分(41.12%)、第2主成分(32.06%)以及第3主成分(17.62%)上的相对距离较小,表明二者间差异较小;DsS与前二者在第1主成分与第2主成分上的相对距离较大,表明DsS与BpS和EhS的差异较大.
基于距离矩阵的相似度分析结果(图5)与PCoA分析结果(图4)一致:所有样品最后聚为两枝,两枝的差异性相较明显;其中BpS和EhS样品的群落结构和多样性相似度高,相聚1枝;AaS、EaS和DsS间的差异性相对小,聚为1枝.DsS与BpS之间的差异系数最大(深绿色),说明DsS与BpS的群落组成结构差异高于其它样品间的差异.
图6是基于丰度排名前60的OTU绘制的Heatmap,反映了丰度最高的OTUs在不同样品间的丰度差异和不同样品基于丰度差异的聚类关系.由图6可得,丰度最高的优势OTUs在不同样品间丰度差异明显.AaS中假单胞菌属(Pseudomonas)的丰度显著高于组内其它细菌属以及组间同属,而芽单胞菌属(Gemmatimonas)、马赛菌属(Massilia)、金黄杆菌(Chryseobacterium)在DsS中相对富集,显著较其它样本高(红色),Hirschia和Chthoniobacter丰度分别在BpS和EhS中较其它样本高.图6左侧聚类树枝为细菌属间丰度相似度水平,聚类树枝越长表明细菌属之间的丰度差异越大.根据图6上侧聚类树枝得出样品两两之间物种丰度及多样性的差异大小,样品聚类结果与主成分分析以及相似度分析的结果相一致,表明了5个样品组内、组间的群落组成结构差异信息.

图4 主成分分析Fig.4 Principal coordinate analysis of all samples
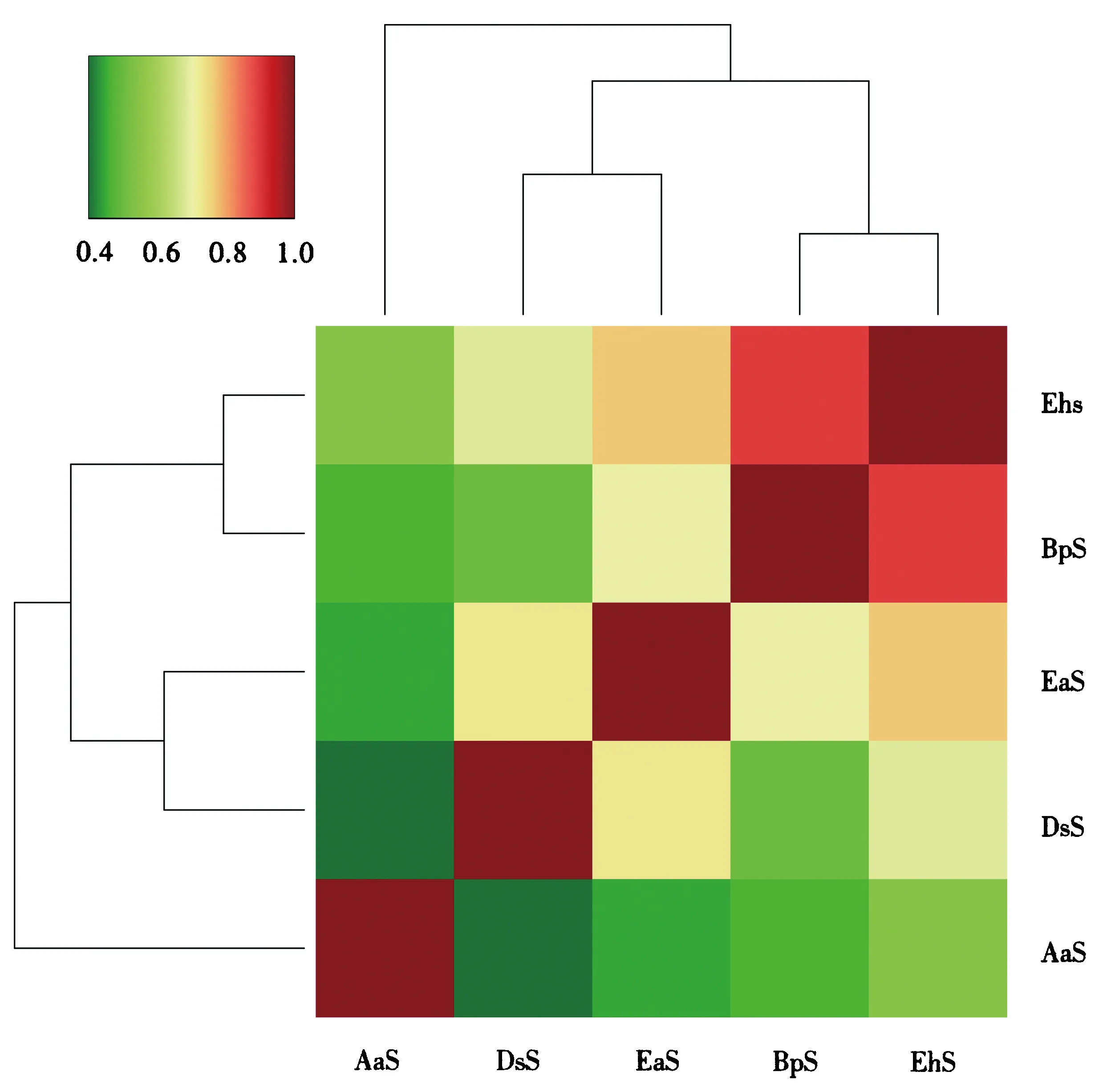
图5 基于距离矩阵的不同样品间相似度分析Fig.5 Similarity analysis between different samples based on Bray-Curtis
3 结论与讨论
土壤微生物群落结构是植物、微生物和复杂土壤理化环境互作的结果.本研究通过高通量测序分析了同一土壤条件下不同植被对土壤菌群结构组成和多样性的影响,其中Chao1指数与Shannon指数不具统计学上的显著性差异,但样本间在个别物种丰度上存在明显的差异.EhS的物种丰富度和多样性指数最高,AaS的物种丰度与多样性最低,并且假单孢菌目相对富集,丰度差异倍数高达20倍.拟杆菌门、放线菌门、嗜纤维菌目则在BpS、EaS和BpS中相对富集.基于PCoA组成的β-多样性显示部分样品出现明显分离,其中DsS与BpS、EhS在坐标上明显分开(图4),跨越植物物种的根际土壤微生物群落和组成变化可由不同植物种类来解释[22].由于样品源于同一片土壤,土壤理化指标并无显著性差异,因此推测样品间的差异来源于植物发育对微生物组成及功能的影响,例如植物分泌大量(摩尔质量占达11%~40%)光合作用衍生碳化物(糖,氨基酸,有机酸,脂肪酸和次级代谢物),使得土壤环境多样化[25].土壤环境为主,不同植物为辅共同影响了植物根际土壤的群落结构和物种丰度;并且在不同植被条件下,根际细菌种类及丰度的差异可能表征了对应植被在整个营养周期中的发育过程.
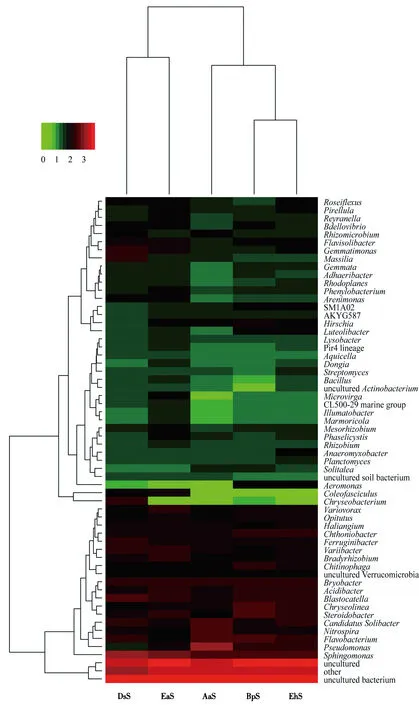
图6 不同样本属水平细菌群聚类热图Fig.6 Heatmap of different microbial communities at genus level
本研究界定了该地红壤环境下细菌物种多样性及核心种群.在5个红壤样品中,酸杆菌门、变形杆菌门、拟杆菌门和疣微菌门是4个优势细菌门(图2),其中变形菌门是最主要的优势细菌种群,酸杆菌门细菌次之.进一步分类显示了变形菌门各个类群在不同样品中的丰度变化和差异,比如Alphaproteobacteria(13.5%)和Betaproteobacteria(14.4%)分别富含于EaS和DsS,Gammaproteobacteria(13.4%)富含于AaS,Deltaproteobacteria分布较为均匀,平均占比5.2%±0.6%.酸杆菌门细菌是红壤样品的第二大优势细菌类群,丰度为13.9%~21.5%.酸性细菌的丰度与pH值显著相关,当pH值降低时,酸性细菌丰度增加[26].本研究中酸杆菌门的丰度为13.9%~21.5%,然而本研究中5个土样都不呈酸性(pH≈7.06),由此推测酸性pH并不是酸性细菌在样品中富集的直接原因,酸性细菌的富集可能是受到了相应区域中植物分泌的有机碳源的影响[27].除了酸性杆菌和变形杆菌等优势门外,红壤环境还包含Nitrospira和Actinobacteria等植物益生菌门,前者是参与氮元素循环的关键环节,为植物提供相应的营养元素.
与不同类型的土壤生境相比,红壤显示出了较独特的微生物多样性模式,包括特殊的微生物群落、与氮与硫循环相关以及光合自养微生物.例如Desulfobacterales(隶属于Proteobacteria),Rhizobiales ,Chloroflexi和Ectothiorhodospiraceae(隶属于Proteobacteria)在红壤中丰度相对较高.其次,与植物疾病预防相关的细菌也富含于红壤,例如Pseudomonas和Streptomycetales(隶属于Actinobacteria).研究显示,假单胞菌和链霉菌在植物病害时会大量出现,形成根际效应,并与植物发生互作从而激活植物免疫系统[24].此外,该片红壤γ-变形菌的丰度较高,γ-变形菌可以使用环境中的硫作为电子供体进行CO2固定,固定占比高达40%~70%[30].表明红壤中具有较丰富的初级生产者,这将有助于维持红壤的有机物水平,保持土壤肥沃程度,进而丰富腐生微生物的多样性,例如拟杆菌,厚壁菌和放线菌在红壤中的富集,这种特殊的群落结构为从红壤分离出具有潜在利用价值的微生物提供了线索.
综上所述,虽然不同植被下红壤的微生物群落整体未表现出显著性差异,但不同植被下土壤细菌显示出与相对应植物相关的独特的物种种类和丰度变化.同时还出现由于研究条件限制无法分类且丰度较高的OTUs,为继续探索和开发未知种类的微生物信息提供了方向.

