新型铜绿菇多糖的制取、结构性质及其抗氧化活性的研究
贾金霞,任晓婕,李宝花,王昱沣
(南京农业大学食品科学科技学院,江苏南京 210095)
铜绿菇又名铜绿红菇、青脸菌、紫菌,是红菇科、红菇属的一种[1],在我国多地均有分布,其子实体一般呈暗铜绿色,形态表现为中部稍下凹的扁半球形。因其色味鲜美,粗纤维、多糖、蛋白质和氨基酸等含量丰富被人们所喜爱[2-4]。
多糖是组成食用菌的一种大分子碳水化合物,在生命过程起着能量和结构物质的作用,同时具有多种生物活性,如抗氧化、抗肿瘤、促进伤口的愈合作用和免疫刺激活性[5-9]。食用菌多糖具有生物相容性、可生物降解性、无毒和无免疫原性等特点,被广泛应用于在食品、医疗保健和化妆品行业[10]。铜绿菇作为一种在我国广泛分布的药食同源大型食用菌,具有安全低毒性的特点,研究其富含的菌多糖有利于其药用价值的推广[11]。国内外研究者对铜绿菇的研究仅集中于探究纯培养条件、野生菌种分离以及子实体核糖核酸酶的提取及活性研究[12-14],而在子实体多糖的提取、分离纯化、结构性质和体外抗氧化活性等方面研究尚未见任何报道。
本研究首次建立新型铜绿菇多糖的制备工艺,初步探索其两种纯化多糖的结构性质和抗氧化活性,为铜绿菇及其多糖的进一步在食品、药品及功能性食品中的研究和利用提供实验依据。
1 材料与方法
1.1 材料与仪器
铜绿菇 云南楚雄哀山;DEAE-纤维素-52、Sephadex G-150 索莱宝公司;单糖标准品、菲咯嗪、1,1-二苯基-2-三硝基苯肼(DPPH) Sigma公司;1-苯基-3甲基-5-吡唑啉酮(PMP) 阿拉丁公司;其他试剂 均为国产分析纯。
RE52-99旋转蒸发仪 上海亚荣生化仪器厂;S-4800酶标仪 Thermo公司;HL-2S恒流泵 上海沪西分析仪器有限公司;LC-20AD岛津高效色谱仪 岛津公司;Nicolet IR200红外光谱仪 Nicolet公司;SU8010扫描电镜 日立公司;Dimension Icon原子力显微镜 布鲁克公司。
1.2 实验方法
1.2.1 工艺流程及铜绿菇多糖得率的测定 根据文献[15]并进行了适当修改,采用水提醇沉法提取粗多糖。将铜绿菇子实体烘干制粉过50目筛后备用。首先取5.0 g菇粉,按料液比1∶20 (g/mL)与蒸馏水混合,在80 ℃的水浴锅中浸提2 h,浸提结束后将浸提液以5000 r/min离心10 min,将离心后的上清液浓缩至20.0 mL。加入80.0 mL的95%(v/v)乙醇醇沉10 h,真空抽滤醇液,后依次用无水乙醇、丙酮和无水乙醚洗涤各3次,得到铜绿菇粗多糖(Crude RLP)。铜绿菇多糖的含量测定参考文献[16],绘制葡萄糖标准曲线为y=17.96786x-0.01432(R2=0.99396),线性范围为0~60 μg/mL,并计算铜绿菇多糖得率:
多糖得率(%)=提取的多糖质量/铜绿菇菇粉质量×100
1.2.2 多糖提取条件的优化
1.2.2.1 单因素实验 按照1.2.1提取多糖,分别研究提取温度、提取时间和料液比对多糖得率的影响。首先在提取时间和料液比分别为2.0 h和1∶20 g/mL时,研究提取温度50、60、70、80和90 ℃对多糖得率的影响;然后在料液比和提取温度分别为1∶20 g/mL和80 ℃时,研究提取时间1.0、2.0、3.0和4.0 h对多糖得率的影响;最后在提取温度和提取时间分别为80 ℃和2.0 h时,研究料液比1∶10、1∶20、1∶30、1∶40和1∶50 g/mL对多糖的得率的影响。
1.2.2.2 响应面试验设计 根据1.2.2.1的单因素的结果,应用Box-Behnken中心组合设计,以铜绿菇多糖得率为响应值,以提取温度、提取时间和料液比为自变量,设计如表1的三因素三水平表并进行响应面试验设计。
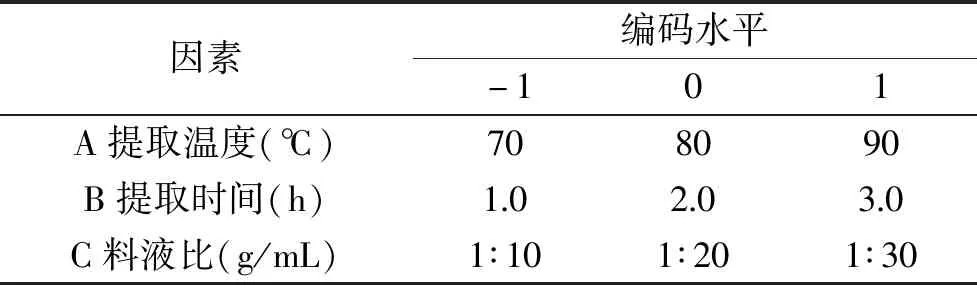
表1 Box-Behnken试验设计因素水平表Table 1 Factors and levels table for Box-Behnken design(BBD)
1.2.3 多糖的分离纯化 参考文献[17]并进行适当修改,取100 mg的粗多糖(Crude RLP)溶于10.0 mL的去离子水中,糖液离心后取上清液,上样于装柱体积为1 BV的DEAE-纤维素-52层析柱(26.0 mm×300.0 mm),依次用去离子水和0.10 mol/L的NaCl洗脱,以1.15 BV/h流速,10 min/管收集。取奇数管用苯酚硫酸法检测每管的吸光值A490,绘制A490随管数变化洗脱曲线。将不同洗脱液下的收集物分别浓缩、透析除杂和冻干,得到RLP-1和RLP-2两种初级纯化多糖。
参考文献[18]并作适当修改,称取RLP-1和RLP-2各30.0 mg溶于3.0 mL去离子水中,离心后取上清液,上样于装柱体积1 BV的Sephadex G-150层析柱(16.0 mm×300.0 mm);以0.35 BV/h的流速,10 min/管收集。同理绘制洗脱曲线和收集纯化组分,得到两种最终纯化产物即RLP-1-1和RLP-2-1。(1 BV=52.0 mL)
1.2.4 相对分子质量测定 采用高效凝胶过滤色谱法[19],将葡聚糖标准品和铜绿菇纯化多糖样品分别配制成5.0 mg/mL,过0.45 μm的滤膜,上样于配备ELSD检测器和TSK G4000PWXL(7.8 mm×300 mm)柱的LC-20AD 高效液相色谱仪,在柱温为35 ℃条件下,进样20 μL,用流速0.5 mL/min的去离子水洗脱,以保留时间为横坐标,葡聚糖相对分子质量的对数值为纵坐标做标准曲线,将样品保留时间带入计算其相对分子质量。
1.2.5 单糖组成测定 HPLC检测条件:使用的LC-20AD高效液相色谱仪,检测器为SPD-20A,检测柱为RP-C18(4.6 mm×250 mm),柱温条件30 ℃,进样量20 μL,流速1.0 mL/min,流动相为用PBS(0.1 mol/L,pH6.7)和乙腈按83∶17的比例混合的混合液。
参考文献[18]进行PMP衍生,取10种单糖标准品各5.0 mg,将其混合并溶解到1.0 mL去离子水中。取0、12.5、25、50、100 μL的单糖标准品混合液并补水至100 μL,分别加入100 μL NaOH溶液(0.6 mol/L)均匀混合,取100 μL混合液与100 μL PMP-甲醇溶液(0.5 mol/L)混合,接着在70 ℃的水浴锅中反应100 min。反应结束后冷却至常温,加入100 μL HCl(0.3 mol/L)将其中和,并在50 ℃的旋转蒸发器中蒸干,蒸干后依次加入1.0 mL的去离子水和氯仿,充分混匀以除去PMP,保留水相。水相经0.45 μm滤膜过滤后,上样于HPLC进样检测。
参考文献[18]进行多糖的酸水解,将纯化多糖配制成5.0 mg/mL,取100 μL糖液加入100 μL TFA(4.0 mol/L),在120 ℃反应2 h,冷却后用甲醇蒸干,并用100 μL去离水复溶并按上述步骤进行PMP衍生和上样。
1.2.6 红外光谱 参考文献[20],将1.0 mg的多糖和100.0 mg溴化钾研磨充分并压成薄片,用红外光谱仪进行检测。
1.2.7 刚果红实验 参考文献[18],将铜绿菇多糖配制成2.0 mg/mL,加入2.0 mL刚果红试剂(80 μmol/L),将糖液中氢氧化钠浓度从低到高等梯度增加(0.05~0.50 mol/L),并记录200~800 nm内的最大吸收波长。以刚果红做空白对照。
1.2.8 扫描电镜(SEM)和原子力显微镜(AFM)形貌观察实验 参考文献[21],铜绿菇多糖配制成4.0 μg/mL,滴在云母片上并晾干,用于SEM(测前需喷金)和AFM观察。
1.2.9 抗氧化活性实验
1.2.9.1 DPPH自由基清除活性的测定 参考文献[22],取0~4.0 mg/mL 间相同浓度梯度的Crude RLP、RLP-1-1、RLP-2-1和VC(阳性对照)各50 μL于96孔板,依次加入25 μL DPPH乙醇溶液(0.4 mmol/L)和100 μL超纯水,混匀,室温避光反应20 min,在517 nm测OD值为A1,以超纯水代替样品为空白组,其OD值记为A0;无水乙醇代替DPPH为干扰组,其OD值记为A2;清除率计算公式:
DPPH自由基清除率(%)=[1-(A1-A2)/A0]
1.2.9.2 金属离子螯合能力的测定 参考文献[23],取0~4.0 mg/mL 间相同浓度梯度的Crude RLP、RLP-1-1、RLP-2-1和EDTA-2Na(阳性对照)各50 μL于96孔板,依次加入2.5 μL FeCl2(2.0 mmol/L)、10 μL菲咯嗪溶液(5.0 mmol/L)和137 μL蒸馏水,混匀,室温反应10 min于562 nm测OD值为A1;以蒸馏水代替样品为对照组,其OD值记为A0;以蒸馏水代替FeCl2溶液为干扰组,其OD值为A2;螯合率计算公式:
金属离子螯合率(%)=[1-(A1-A2)/A0]×100
1.3 数据处理
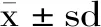
2 结果与分析
2.1 单因素实验
提取温度对多糖得率的影响如图1a,多糖得率随提取温度的升高而升高后趋于平缓。提取温度为80和90 ℃的得率无显著性差异(P>0.05),但50、60和70 ℃的存在显著性差异(P<0.05),从能耗考虑[24],选取80 ℃为较适提取温度。
提取时间对多糖得率的影响如图1b,随着提取时间的增加,铜绿菇多糖得率呈现先增加后减小,提取时间对得率影响显著(P<0.05)。其中提取时间为2 h时,多糖的得率高达3.85%,而2.0 h后得率反而下降。随着提取时间的延长,多糖扩散到溶剂中并溶解的量虽有所增加,然而多糖降解导致的损失更明显,表现为得率的下降[25]。因此选取2.0 h为较适提取时间。
料液比对多糖得率的影响,由图1c可知,随着料液比的增加,多糖得率呈现先增加后减小,而后趋于稳定的趋势。水料比为1∶10和1∶20 g/mL时,两者的得率存在显著性差异(P<0.05),而1∶20~1∶50 g/mL时得率无显著性差异(P>0.05)。原料与水的比例增加,可使细胞中的多糖释放增加,但也会造成多糖因吸热的不均匀致使其溶解性下降[26],因此选取1∶20 g/mL为较适提取料液比。

图1 不同提取因素对铜绿菇多糖得率的影响Fig.1 Effects of different extraction factors on the yield of polysaccharides from Russula aeruginea Lindb.:Fr
2.2 响应面实验结果与分析
响应面实验的结果如表2所示,所得铜绿菇多糖得率的回归方程:
Y=3.98+0.21A+0.20B+0.016C+0.047AB-0.090AC+0.017BC-0.18A2-0.28B2-0.19C2

表2 响应面实验设计与结果Table 2 The experiment design and results of Box-Behnken

表3 方差分析Table 3 Analysis of variance
铜绿菇多糖最佳提取工艺条件是83.78 ℃,2.62 h,1∶22.67 g/mL,得率为4.04%。为提高实验的操作性,选取温度、时间和液料比分别为84 ℃、2.6 h和1∶23 g/mL进行验证实验,得率为4.30%与理论值仅相差0.26%,进一步验证了该模型的可预测性。
2.3 铜绿菇多糖的分离纯化
由图2可知,铜绿菇粗多糖经DEAE-纤维素-52纯化获得两个独立的洗脱峰,收集组分分别命名为RLP-1和RLP-2,进一步经Sephadex G-150层析柱纯化后(图3所示),分别收集得到峰形更加对称的RLP-1-1、RLP-2-1组分,表明两组分的纯度较高。
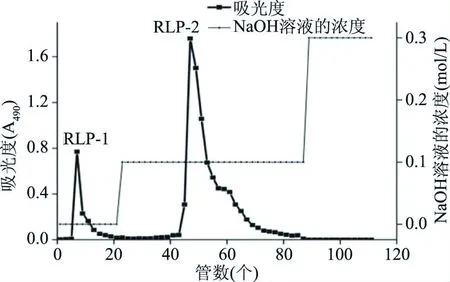
图2 铜绿菇多糖DEAE-纤维素-52梯度洗脱曲线Fig.2 DEAE-cellulose-52 gradient elution curve of polysaccharides from Russula aeruginea Lindb.:Fr
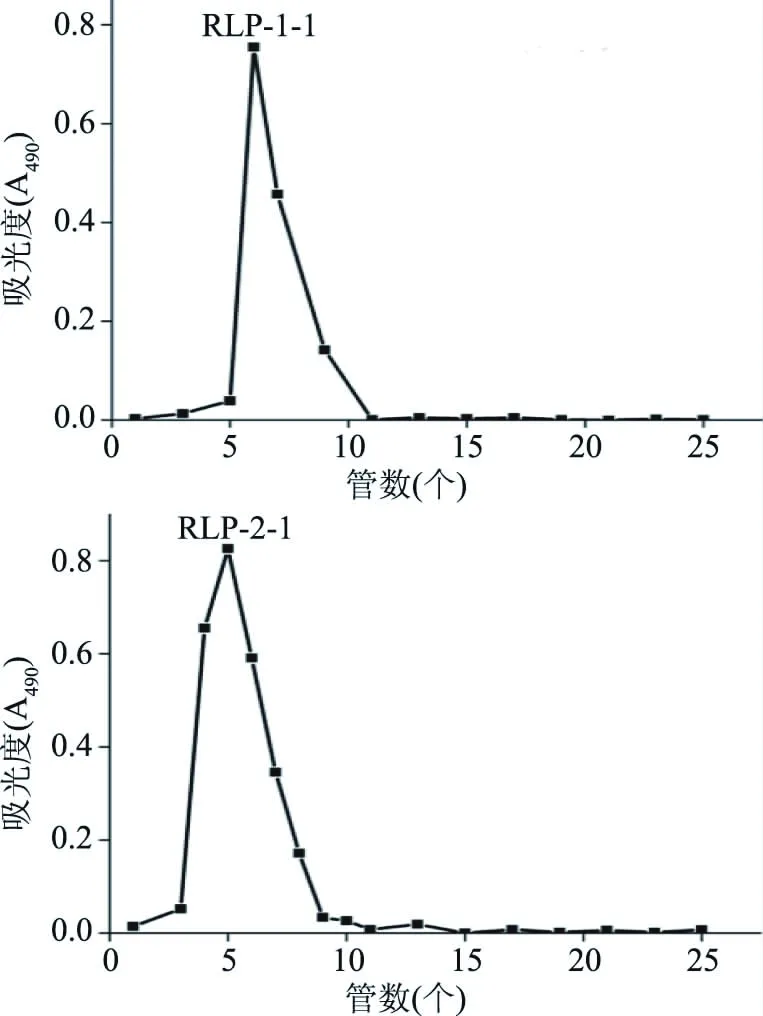
图3 铜绿菇多糖的Sephadex G-150的洗脱曲线Fig.3 Sephadex G-150 elution curve of polysaccharides from Russula aeruginea Lindb.:Fr注:a:RLP-1-1的洗脱曲线,b:RLP-2-1的洗脱曲线。
2.4 铜绿菇多糖的结构性质
上述两种铜绿菇多糖的相对分子量测定结果(如图4所示),RLP-1-1和RLP-2-1均呈现单一对称峰,进而验证其纯度较高。RLP-1-1和RLP-2-1保留时间分别为17.85和9.95 min,计算可得两种纯化多糖的分子量分别18.05、2398.83 kDa。

图4 高效液相色谱图Fig.4 High performance liquid chromatography注:a:RLP-1-1的高效液相色谱图, b:RLP-2-1的高效液相色谱图。
上述两种铜绿菇多糖的单糖组成测定结果(如图5所示),图a、b和c分别表示单糖标准品、纯化多糖RLP-1-1和RLP-2-1的HPLC图。a图中峰1~10依次为甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖和岩藻糖。图b为纯化多糖RLP-1-1的HPLC图,由图可知该多糖由三种多糖组成,即葡萄糖、半乳糖和岩藻糖组成,各单糖物质的量百分比分别为:为5.35%,67.02%和27.63%。图c为纯化多糖RLP-2-1的HPLC图,由图可知RLP-2-1只由葡萄糖组成。
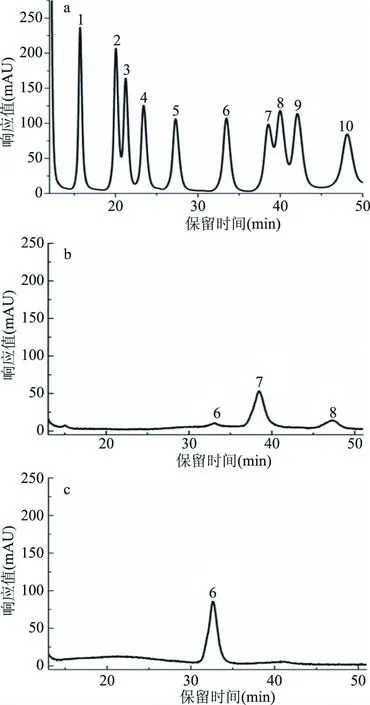
图5 高效液相色谱图Fig.5 High performance liquid chromatography注:a:单糖标准品,b:RLP-1-1,c:RLP-2-1。
铜绿菇多糖的红外光谱图如图6所示,RLP-1-1和RLP-2-1具有3400和2926 cm-1多糖特征吸收峰[27];此外二者在1643 cm-1处具有C=O非对称性伸缩振动所引起的特征峰,表明它们均含有酰胺键[28];1355和1250 cm-1处的吸收峰代表两者含有硫酸基基团[29];1150和1080 cm-1的特征峰表明它们具有C-OH和C-O-C的结构;RLP-1-1在932 cm-1有吸收峰表明其具有3,6-内醚半乳糖,而RLP-2-1不具有[30]。
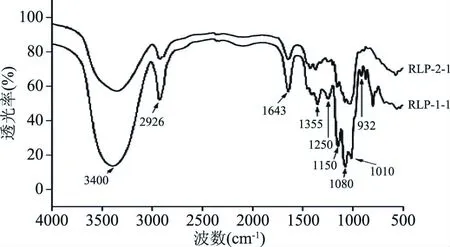
图6 RLP-1-1和RLP-2-1红外谱图Fig.6 FT-IR spectra of RLP-1-1 and RLP-2-1
刚果红实验结果如图7所示,刚果红可与具有三股螺旋的多糖络合,表现为其最大吸收波长(λmax)的增大,λmax与多糖-刚果红溶液的NaOH浓度呈负相关,原理是高浓度NaOH可解开刚果红与三股螺旋多糖的络合并降低λmax。RLP-2-1的λmax先增加后减小,说明其可能含有三股螺旋。RLP-1-1的λmax一直呈减小趋势,说明其不含三股螺旋结构[31]。研究表明三股螺旋结构与其生物活性有关,如三股螺旋结构的香菇多糖同时具有较高的抗肿瘤活性,而破坏其三股螺旋结构后,抗肿瘤活性明显降低[32]。茯苓多糖通常不具有抗肿瘤活性,采用化学手段使其形成三股螺旋后可获得抗肿瘤活性[33]。由此可推测具有三股螺旋的RLP-2-1可能具有较高的抗肿瘤活性,今后应对其进行抗肿瘤活性的研究,为铜绿菇多糖的在抗肿瘤药物的开发提供科学支持。

图7 NaOH浓度对多糖波长的影响Fig.7 Effect of NaOH concentration on polysaccharide wavelength
RLP-1-1的SEM如图8(a和b),10 μm的结果(图8a)表明多糖呈紧密的微观颗粒状,表面光滑且相对平整,边缘凹凸不平,颗粒的大小厚度各异,杂乱的附着堆积。20 μm的结果(图8b)多糖分子呈分散的小颗粒,这说明多糖分子主要呈现的是相互斥力,而吸引力较小[29]。RLP-2-1的SEM如图8(c和d),10 μm的结果(图8c)和50 μm的结果(图8d)的结果类似,多糖均呈厚度不一薄片堆积的形貌,表面伴有许多裂纹,糖分子形成的羽状结构表明排斥力较弱,存在较强相互作用力,多糖分子可能存在螺旋结构[34]。

图8 铜绿菇多糖的电镜扫描图Fig.8 The SEM picture of Russula aeruginea Lindb.:Fr注:a,b:RLP-1-1的SEM,c,d:RLP-2-1的SEM。
RLP-1-1的AFM的平面图如图9a所示,400 nm呈大小均匀的纤维网络结构,表明多糖的纯度很高,链长约为1.1~1.2 nm。RLP-2-1的AFM的平面图如图9b所示,多糖呈现较为明显的纤维状结构,链长约为1.9~2.1 nm。而通常多糖分子链一般为0.1~1 nm,RLP-1-1和RLP-2-1链长均大于1 nm,这表明多糖都呈现多个糖分子的聚合状态[35]。结合刚果红和扫描电镜的结果分析,RLP-2-1存在三股螺旋结构。
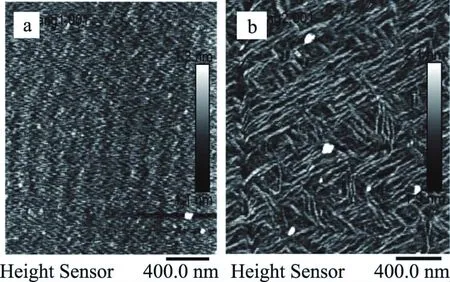
图9 铜绿菇多糖的原子力显微镜Fig.9 The AFM picture of Russula aeruginea Lindb.:Fr注:a:RLP-1-1的AFM,b:RLP-2-1的AFM。
2.5 铜绿菇多糖的抗氧化活性
铜绿菇多糖的DPPH自由基清除率和金属离子螯合率的结果如图10所示。

图10 铜绿菇多糖抗氧化活性Fig.10 Antioxidant activity of polysaccharides from Russula aeruginea Lindb.:Fr注:a:DPPH自由基清除率,b:金属离子螯合率。
DPPH自由基清除率的实验的结果如图10a,由图可知RLP-1-1和RLP-2-1对DPPH自由基的清除能力相差不大,且两者清除该自由基的清除率要弱于粗提物。在0~4.0 mg/mL多糖范围内,随着各组分多糖浓度的增加,而各组分清除能力有所增加。在浓度为4.0 mg/mL时,Crude RLP、RLP-1-1和RLP-2-1的DPPH自由基清除率分别为41.19%、38.97%和39.27%。由于RLP-2-1分子量过大且空间结构复杂,在体外DPPH抗氧化模型中表现不佳,在未来的研究中可采用化学方法对其进行修饰得到活性更高的多糖衍生物。阿魏菇两种水溶性多糖的清除率分别为62.0%和49.8%[36],而羊肚菌多糖的清除率32.42%[37],铜绿菇多糖的清除能力介于阿魏菇多糖和羊肚菌多糖之间,铜绿菇多糖可作为抗氧化剂良好来源。
金属离子螯合率实验的结果如图10b,由图可知,RLP-2-1的金属离子螯合率高于RLP-1-1和粗提物。在0~4.0 mg/mL多糖范围内,随着各组分多糖浓度的增加,而各组分的金属离子螯合率有所增加。在浓度为4.0 mg/mL时,Crude RLP、RLP-1-1和RLP-2-1的金属离子螯合率分别为29.83%、27.81%和51.96%。羊肚菌多糖金属离子螯合率为27.83%[37],紫丁香蘑多糖的金属离子螯合率为70.09%[38],可见铜绿菇多糖的金属离子螯合能力介于羊肚菌多糖和紫丁香蘑多糖之间,铜绿菇多糖可作为抗氧化剂良好来源用于食品药品中。
3 结果与讨论
本研究采用单因素实验结合响应面实验建立了铜绿菇多糖的水提醇沉工艺,当提取温度为84 ℃,提取时间为2.6 h,料液比为1∶23 g/mL时,多糖的提取率为4.30%。并利用DEAE-纤维素-52和Sephadex G-150分离纯化得到两种分子量分别为18.05 kDa和2398.83 kDa水溶性多糖。RLP-1-1的葡萄糖、半乳糖和岩藻糖等三种单糖的摩尔百分含量分别为5.35%、67.02%和27.63%,而RLP-2-1仅由葡萄糖组成,它们均具有多糖的典型官能团,其中一种多糖具有三股螺旋,两种水溶性多糖均表现出一定的抗氧化活性。在未来研究中,我们拟进一步研究其体外细胞抗氧化活性、体外细胞和动物体内的免疫活性和抗肿瘤活性等,从而为推广铜绿菇食用菌资源的利用和其多糖的开发提供科学依据。
权威·高效·核心·领先·精湛·实用

