分级醇沉发酵麸皮多糖的成分分析与抗氧化活性研究
,*
(1.内蒙古农业大学动物科学学院,内蒙古呼和浩特 010018;2.内蒙古自治区草食家畜饲料工程技术研究中心,内蒙古呼和浩特 010018)
小麦是我国主要的粮食作物之一,而小麦麸皮是小麦制粉的主要副产物,麦麸中富含纤维素和半纤维素及各种营养物质,且价格低廉,是已知的自然界中最好的膳食纤维来源[1]。同时小麦麸皮含有纤维素多糖以及由木聚糖、葡甘露聚糖、半乳聚糖、木聚糖等组成的非纤维素多糖[2],具有良好的生物活性,包括免疫调节活性[3-4]、抗氧化活性[5-6]和益生作用[7]等,它还具有降血脂、降血糖、润肠通便等功效,此类多糖称为麸皮活性多糖,简称麸皮多糖[8]。麸皮多糖作为一种植物多糖,结构复杂,是由超过20个单糖单位组成的多聚物[9],且易与小分子物质(多酚、维生素、矿物质等)、蛋白质等结合,不易分离纯化,因此会与多酚和蛋白发生相互作用,形成共价复合物,比单独化合物的活性更强[10]。
发酵麸皮多糖分离纯化常采用纤维素柱层析[11]和透析[12]、水提醇沉等方法,前两种方法限于成本和得率,难以用于大规模生产。水提醇沉是天然多糖类最为常用的提取纯化方法[13],是通过将原料热水浸提后逐步提高乙醇的体积浓度以达到初步纯化多糖的目的,相比其它的纯化方法,它的优势在于成本低、耗时短,同时又能维持较高得率,且针对不同乙醇浓度沉淀下来的多糖有不同的生物活性及应用价值。因此,本研究采用乙醇分级沉淀法分离出不同的发酵麸皮多糖,测定了其得率、纯度、多酚、蛋白含量等,分析了其单糖组成,比较了各醇沉组分间的组成差异,并初步探讨了各组分之间体外抗氧化活性不同的原因,为发酵麸皮多糖的开发利用提供可靠的参考依据。
1 材料与方法
1.1 材料与仪器
小麦麸皮、豆粕粉、玉米粉 内蒙古大公面粉厂;枯草芽孢杆菌CGMCC 1.892(BacillussubtilisCGMCC 1.892)、酿酒酵母CGMCC 2.119(SaccharomycescerevisiaeCGMCC 2.119) 均购买于中国微生物菌种保藏中心;无水乙醇、浓硫酸、苯酚、福林酚、三氯甲烷等 天津市汇杭化工科技有限公司;硫酸亚铁、水杨酸乙醇、六氰合铁酸钾、无水碳酸钠、三氯化铁等 分析纯,天津风船化学试剂科技有限公司;中性蛋白酶、BCA蛋白浓度测定试剂盒 北京索莱宝科技有限公司;DPPH(二苯基-2-三硝基苯肼)、D-无水葡萄糖、丁基羟基茴香醚(BHA) 美国Sigma。
LGJ-18型真空冷冻干燥机 上海豫康仪器有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂;TG16-WS型台式高速离心机 湖南湘仪仪器开发有限公司;Epoch2型微孔板分光光度计 美国伯腾仪器有限公司;HWS24型电热恒温水浴锅 上海医疗器械有限公司;UV-2450紫外分光光度计 日本Shimadzu。
1.2 实验方法
1.2.1 发酵麸皮多糖分级醇沉样品制备 参照史俊祥[14]的方法制备发酵麸皮多糖。以小麦麸皮为原料,以豆粕粉、玉米粉为辅料,添加比例为80.46∶9.32∶10.22,料水比1∶1.16;使用枯草芽孢杆菌和酿酒酵母菌混菌发酵,比例为6.7∶3.3;接种量为10.4%,添加0.1%尿素,35.4 ℃下发酵52.7 h,发酵结束后,将发酵底物在45 ℃烘48 h,粉碎。与蒸馏水1∶16混合后90 ℃水浴提取30 min,离心(5000 r/min,15 min),后收集上清液,烘干得发酵麸皮多糖。
酶法结合Sevage法脱蛋白[15]。配制一定浓度的发酵麸皮多糖溶液,加入0.2%中性蛋白酶,40 ℃下酶解1.5 h,沸水浴10 min灭酶,冷却后离心(5000 r/min,15 min),取上清液与Sevage试剂(三氯甲烷∶正丁醇=4∶1)3∶1混合,使用磁力搅拌器充分振荡30 min,离心(5000 r/min,15 min),再取上清液再按3∶1与Sevage试剂混合,离心,此去蛋白步骤重复两次。取最终上清液旋转蒸发浓缩,冻干机冻干,得脱蛋白后麸皮多糖。
分级醇沉样品制备:将脱蛋白后麸皮多糖配制成质量分数为10%的多糖溶液,加入无水乙醇,使乙醇占总体积分数的50%,于4 ℃下静置12 h,5000 r/min下离心15 min,收集沉淀,冷冻干燥得到多糖样品WPBS-50。上清液按照体积继续加入无水乙醇,使乙醇体积分数达到60%,于4 ℃下静置12 h,5000 r/min下离心15 min,收集沉淀,冷冻干燥得到多糖样品WPBS-60。同样的方法得到70%、80%乙醇沉淀的多糖样品WPBS-70、WPBS-80。
1.2.2 多糖含量测定及纯度计算 测定采用苯酚-硫酸法[16]。精确称取葡萄糖标准品20 mg,用蒸馏水定容至500 mL配制标准液。分别吸取标准液0、0.2、0.4、0.6、0.8、1.0和1.2 mL于试管中,补水至2 mL,加入1 mL 5%苯酚和5 mL浓硫酸,室温下反应20 min,并于490 nm处测吸光度,根据标准曲线计算多糖含量,标准曲线回归方程为y=0.3099x-0.0091,y代表糖的浓度(mg/mL),x代表吸光度值,决定系数R2=0.9989。取1 g各样品定容至16 mL配制成样品溶液,稀释80倍,取1.0 mL稀释液补水至总体积为2 mL,按上述步骤操作加入苯酚和浓硫酸,490 nm处测吸光度,并进行纯度计算。
多糖纯度计算公式如下:
多糖纯度(%)=(稀释液浓度(mg/mL)×样品体积(mL)×稀释倍数)/多糖样品质量(mg)×100
1.2.3 多酚含量测定 采用福林酚法[17]。各称取1 g多糖样品,加16 mL蒸馏水摇匀,90 ℃水浴1 h,取出后稀释10倍,吸取1 mL稀释液,加入5 mL 10%福林酚,反应3~8 min,后加入4 mL 7.5%碳酸钠,摇匀后室温放置1 h,765 nm下测其吸光值。
1.2.4 蛋白含量的测定 采用BCA蛋白浓度测定试剂盒测定醇沉样品中残留的蛋白含量。
1.2.5 单糖组成分析 取4种多糖样品2 mg,加入1 mL的2 mol/L三氟乙酸水解90 min,旋转蒸发仪蒸干,加入2 mL甲醇,蒸干,反复2次。残基加入2 mL双蒸水,60 mg硼氢化钠还原8 h,加入冰醋酸中和,旋蒸,加入甲醇3 mL,反复3次,旋蒸至粉末,于110 ℃烘箱烘干,然后加入1 mL乙酸酐乙酰化100 ℃反应1 h,冷却,然后加入3 mL甲苯,减压浓缩蒸干,重复4~5次,以除去多余的醋酐。将乙酰化后的产物用3 mL氯仿溶解后转移至分液漏斗,加入少量蒸馏水充分振荡后,除去上层水溶液,如此重复4次。氯仿层以适量的无水硫酸钠干燥,定容至10 mL待GC-MS分析[13]。通过与标准品保留时间的比较确定色谱峰所属的化合物种类,通过峰面积计算各种化合物含量,结果用mg/kg表示。
GC-MS条件:Rxi-5sil MS(RESTEK)色谱柱(30 m×0.25 mm×25 μm);程序升温条件:起始温度120 ℃,以3 ℃/min升温至250 ℃/min;保持5 min;进样口温度为250 ℃,检测器温度为250 ℃/min;载气为He,流速为1 mL/min。

表1 发酵麸皮多糖各醇沉组分组成含量及得率分析Table 1 Content and yield analysis of alcohol precipitation components of fermented bran polysaccharides
注:同列字母不同表示差异显著(P<0.05)。
1.2.6 紫外可见光谱分析(UV) 将4种多糖样品各配成质量浓度0.1 mg·mL-1的多糖溶液,采用紫外可见分光光度计在200~400 nm处进行光谱扫描分析[20]。
1.2.7 体外抗氧化活性评价
1.2.7.1 DPPH自由基清除能力 参照Zhang等[18-19]的方法并略做修改,将4种多糖样品分别配制浓度为0、0.5、1、2、4 mg/mL的样液,取2 mL不同浓度的样液和2 mL DPPH溶液(0.2 mmol/L,95%乙醇溶液)混匀,室温避光反应30 min,517 nm测定吸光度A0。取2 mL样液,加2 mL95%的乙醇混匀室温避光反应30 min,517 nm测定吸光度A1,取2 mL DPPH溶液,加2 mL蒸馏水,混匀室温避光反应30 min,517 nm测定吸光度A2。以BHA标准品作为对照。计算公式为:
1.2.7.2 还原力能力测定 参照黄忠有等[20]的方法并略做修改。以BHA标准品作为对照,加入0.75 mL样品液,0.75 mL 0.2 mol/L磷酸缓冲液,0.75 mL 1%六氰合铁酸钾50 ℃反应20 min。加入0.75 mL 10%三氯乙酸终止反应,3000 r/min离心10 min。取1.5 mL上清液加入1.5 mL水加400 μL 0.1% FeCl3室温反应10 min,700 nm处测吸光度,吸光度越高,还原力越强。
1.3 数据统计
采用Origin 8.5、SPSS 21.0和SAS 9.2数据处理软件进行数据统计分析。
2 结果与分析
2.1 化学组成分析
乙醇可以通过降低多糖水溶液的介电常数,减少多糖与水的作用,从而使多糖聚合沉淀,不同浓度的乙醇可沉淀出不同的多糖[21]。4种醇沉组分的化学组成及得率见表1。由表1可知,4种醇沉组分的得率由高到低的顺序为WPBS-50>WPBS-70>WPBS-80>WPBS-60,且多糖纯度均能达到70%以上。在乙醇浓度80%时,WPBS-80的纯度最低,这是由于多糖在高浓度乙醇中几乎都会沉淀出来,和其他小分子物质等分离开,而单糖在高浓度的乙醇中有一定的溶解性,所以随着乙醇浓度增加,多糖纯度降低[22]。4种醇沉组分中均含有蛋白和多酚成分,蛋白质残留量和多酚含量的顺序是WPBS-80>WPBS-70>WPBS-60>WPBS-50,且WPBS-80组分中蛋白含量高达18.43%,多酚含量达2.18%。文献表明,多糖中轭合一定的蛋白质和多酚[23],为探究多糖中是何成分影响其生物活性,Wang等[24]对茶叶粗多糖提取物中的茶多酚进行了研究。Liu等[25]研究了蘑菇多糖提取物中的蛋白质。
2.2 单糖组成分析
由表2可知:各醇沉组分均含有甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖。WPBS-50葡萄糖和木糖含量较高,核糖含量最低;相比于其他醇沉组分,核糖、葡萄糖醛酸、半乳糖醛酸、半乳糖、岩藻糖在WPBS-60中含量最高,单糖的摩尔百分比为10.88%、12.39%、8.67%、10.77%、8.99%;葡萄糖在70%醇沉部位中大量分布,摩尔百分比达到51.34%,推断葡萄糖是麦麸多糖中小分子量多糖和寡糖的重要组成成分;WPBS-80相对于其他组分,鼠李糖、阿拉伯糖、木糖含量最高。

表2 发酵麸皮多糖各醇沉组分的单糖组成(%)Table 2 The monosaccharide composition of alcohol precipitation components of fermented bran polysaccharides(%)
2.3 紫外可见光谱分析
图1是4种麦麸多糖醇沉组分在200~400 nm的紫外扫描图谱。由图1可知,紫外扫描图谱相似,均在280 nm处有蛋白质的特征吸收峰[13,26],且吸收峰的强弱顺序为WPBS-80>WPBS-70>WPBS-60>WPBS-50,表明这4种多糖均含有一定量的蛋白质,蛋白质含量测定结果与2.1节中结果一致。在325 nm处较强的吸收峰为酚酸分子中苯环的特征吸收[27]。酚酸含量测定结果与2.1节中多酚结果一致。

图1 4种发酵麸皮多糖醇沉组分的紫外扫描图谱Fig.1 UV scanning spectra of alcohol precipitation components of 4 kinds of fermented bran polysaccharides
2.4 抗氧化能力分析
2.4.1 清除DPPH自由基的能力 各多糖醇沉组分清除DPPH自由基能力如图2所示,4种多糖组分均具有一定的清除DPPH自由基的能力,且随着乙醇体积分数的升高,清除DPPH自由基的能力逐渐增大后趋于稳定,各组分清除DPPH自由基能力强弱顺序为:WPBS-80>WPBS-70>WPBS-60>WPBS-50。WPBS-50,WPBS-60,WPBS-70,WPBS-80的IC50值分别为(4.187±0.073)、(1.345±0.091)、(1.241±0.090)、(0.259±0.227) mg/mL。4种多糖组分中WPBS-80多糖纯度最低,但多酚和蛋白含量最高,且其清除DPPH自由基的能力最强。许海棠等[28]在山豆根多糖组分的研究中发现,SGP90的多糖纯度是几个分级醇沉组分中最低的,但此组分的抗氧化能力最强,其原因是各级组分的抗氧化活性不仅仅与多糖纯度有关,还可能与其他活性成分如多酚、蛋白等有关。与本试验研究结果一致。
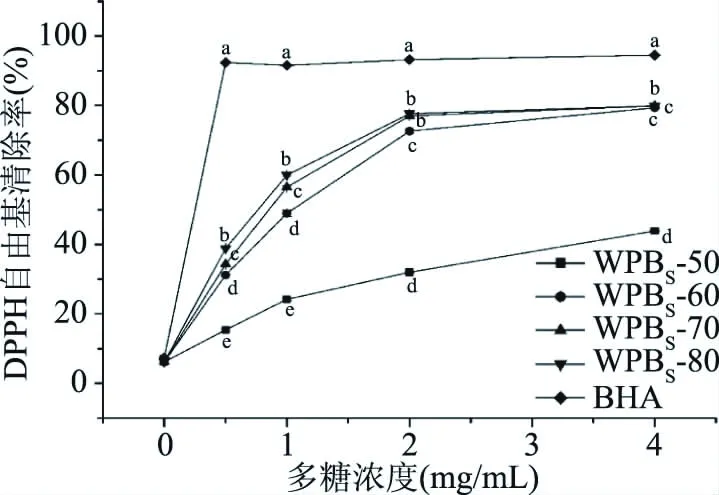
图2 4种发酵麸皮多糖醇沉组分清除DPPH自由基能力Fig.2 DPPH free radical scavenging ability of ethanol precipitation components of 4 kinds of fermented bran polysaccharides注:不同小写字母表示差异显著(P<0.05),图3同。
2.4.2 还原力 生物体内存在游离金属离子,如铁离子,通过 Fe3+被抗氧化剂还原成 Fe2+来测定抗氧化剂的还原力,还原能力愈强,其抗氧化活性愈好[29]。本实验对各个醇沉组分进行了总还原力的测定,如图3,与清除 DPPH自由基相似,随所测样品浓度的增加,还原能力增强。WPBS-70的还原力略高于WPBS-80,与WPBS-60多糖组分相差不大,WPBS-50的还原力明显低于其他组分。当多糖样品浓度为4 mg/mL时WPBS-50、WPBS-60、WPBS-70、WPBS-80还原力的吸光值分别为0.24、0.58、0.67、0.61。有文献显示,单糖的糖苷键链接也影响着抗氧化活性,特别是侧链的甘露糖与还原力呈显著性相关[23]。本实验中WPBS-70组分的还原力最高,可能是源于单糖组成中甘露糖相对于其他组分含量较高。

图3 4种发酵麸皮多糖醇沉组分的还原力Fig.3 Reducing power of alcohol precipitation components of four fermented bran polysaccharides
2.5 发酵麸皮多糖醇沉组分多酚和蛋白含量与抗氧化性的线性关系
考察麸皮多糖有效成分对抗氧化性的影响,可通过SPSS软件计算 Pearson相关系数进行说明,Pearson相关系数越接近1,说明该成分与对应的抗氧化活性相关性越高[30]。本研究中多酚和蛋白含量均随乙醇体积增大而升高。从表3可以看出,多酚及蛋白含量与DPPH自由基清除活性表现出极显著正相关(P<0.01),与还原力表现出显著正相关(P<0.05)。Siu等[31]采用乙醇沉淀法从蘑菇中提取水溶性多糖,结果表明,各组分的抗氧化活性均与多酚和蛋白质含量显著相关,多糖中主要是其多酚和蛋白在起抗氧化性作用。

表3 麸皮多糖醇沉组分多酚和蛋白含量与DPPH自由基清除率及还原力的Pearson相关系数Table 3 Pearson correlation coefficient of DPPH free radical scavenging rate and reducing power for the content of polyphenols and proteins in bran polysaccharide precipitated components
注:**在0.01水平(双侧)上显著相关,*在0.05水平(双侧)上显著。
3 结论
本试验采用水提醇沉法对发酵麸皮多糖进行分级醇沉,设置50%、60%、70%和80%四个乙醇体积分数梯度,分级沉淀得到4种醇沉组分,分别为WPBS-50、WPBS-60、WPBS-70、WPBS-80。WPBS-50组分的多糖纯度最高,达到79.95%;通过分析单糖组成发现,4种组分均含有葡萄糖、葡萄糖醛酸、木糖和阿拉伯糖等十种单糖。随着乙醇体积分数增加,沉淀中的蛋白和多酚含量均随之增加,WPBS-80最高,且表现出最强的DPPH自由基清除活性及较强的还原力。相关性结果表明,麸皮多酚及蛋白含量与其DPPH自由基清除活性及还原力活性之间呈正相关性,这从某种意义上说明了发酵小麦麸皮多糖分级醇沉中的多酚和蛋白的存在增强了抗氧化活性。不同醇沉产物的活性研究具有不同的意义,为今后麸皮多糖开发利用奠定了基础。

