南昆山毛叶茶三种多酚的分离纯化及抗氧化研究
,*
(1.华南农业大学食品学院,广东广州 510642;2.广东省微生物研究所,广东广州 510070)
南昆山毛叶茶(CamelliaptilophyllaChang)属山茶科、山茶属、茶亚属、茶组、茶系植物,为张宏达教授于20世纪80年代在中国广东省龙门县南昆山发现的一种特殊茶树资源[1]。其与传统茶叶(Camelliasinensis(L.)O.Kuntze)中生物碱和儿茶素组成不同,生物碱以可可碱为主,儿茶素以没食子儿茶素没食子酸酯(GCG)为主[2-3];而且,Kurihara等在南昆山毛叶茶中发现了传统茶叶中迄今尚未发现的2种特殊多酚物质1,2,4,6-四没食子酰葡萄糖(1,2,4,6-GA-glc)和儿茶素-3,5-二没食子酸酯(GC-3,5-diGA)[4]。目前,南昆山毛叶茶的研究主要集中在茶叶化学成分分析[5]和溶剂提取物的抗氧化[6-7]、抗过敏[8]、抗炎[9]、抗癌[10]、降血脂[11]等功能活性评价,采用的材料多为其提取混合物,而对南昆山毛叶茶中特殊多酚单体物质的分离纯化及功能评价的研究相对较少,Li等从南昆山毛叶茶中分离出GCG和一种新型花青素-GC-(4→8)-GCG,其分别具有降脂减肥和抗血管疾病的功效[12-13],而对1,2,4,6-GA-glc和GC-3,5-diGA的分离纯化及抗氧化活性等研究鲜见报道。
本研究以南昆山毛叶绿茶为材料,采用Sephadex LH-20柱层析和制备型高效液相色谱联用法从南昆山毛叶绿茶中分离提取得到高纯度的GCG和2种特殊的多酚物质1,2,4,6-GA-glc和GC-3,5-diGA,通过DPPH、ABTS、FRAP和ORAC四种化学方法及L-O2肝细胞氧化应激模型,综合评价3种多酚物质的抗氧化活性,以期为南昆山毛叶茶功能特性研究和开发利用提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
南昆山毛叶茶春梢1芽2~3叶 采自广东省惠州市龙门县南昆山,鲜叶采用锅式杀青(260 ℃,8 min),经摊凉、揉捻(30 min)、初烘(120 ℃,10 min)、摊凉、复烘(90 ℃,15 min),制成绿茶;表没食子儿茶素没食子酸酯(EGCG),纯度≥97% 由湖南农业大学茶学重点实验室提供;羟丙基葡聚糖凝胶(Sephadex LH-20)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,4,6-三(2-吡啶基)三嗪(TPTZ)、2,2′-联氮基-双-(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS) 美国Sigma公司;荧光素钠(FL),纯度≥98.5% 上海源叶生物科技有限公司;双乙酸钠 广州化学试剂厂;无水乙醇、乙酸乙酯、甲醇(分析纯) 天津大茂化学试剂厂;甲酸(色谱纯) 上海麦克林生化科技有限公司;甲醇(色谱纯) 上海安谱实验科技股份有限公司;人肝细胞L-O2中国科学院细胞库。
BT25S电子天平 瑞士Mettle Toledo公司;Milli-Q Integral 3纯水机 德国Merk-Millipore公司;HSC-12B氮吹仪 天津市恒奥发展有限公司;R-3旋转蒸发仪 瑞士Buchi公司;Alpha 1-2 Ldplus冷冻干燥机 德国Martin Chris公司;BT300M/YZ1515x蠕动泵 保定申辰泵业有限公司;Agilent1 200高效液相色谱仪、Agilent 6540飞行时间质谱仪 美国Agilent公司;LC3000制备型高效液相色谱仪 北京创新通恒科技有限公司;VersaMax酶标仪 美国Molecular Devices公司;Bruker Avance 600 Hz核磁共振仪、Vertex 70傅里叶变换红外光谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 30%乙醇/乙酸乙酯提取物的制备 称取10.0 g过20~30目筛的茶叶于锥形瓶中,加入100 mL 30%乙醇水溶液,70 ℃水浴浸提25 min后过滤,滤渣重复浸提1次;合并滤液,70 ℃恒温搅拌30 min以除去乙醇;加入等体积的乙酸乙酯充分振荡萃取,避光静置0.5 h,重复萃取1次,合并上层乙酸乙酯相,旋转蒸发仪浓缩,氮吹仪吹干,-20 ℃贮藏备用。
1.2.2 高效液相色谱条件 色谱柱:Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:A:水(0.2%甲酸),B:甲醇。梯度洗脱程序:0 min(A:81.5%,B:18.5%)→5 min(A:79%,B:21%)→20 min(A:64.5%,B:35.5%)→25 min(A:61.5%,B:38.5%),后运行4 min;检测波长:280 nm;流速:1 mL/min;柱温:35 ℃;进样量:10 μL。
1.2.3 Sephadex LH-20柱层析对30%乙醇/乙酸乙酯提取物的分离纯化 Sephadex LH-20的活化:采用无水乙醇将凝胶浸泡1~2 h;装柱:将活化脱气的Sephadex LH-20填入层析柱内,柱体积(BV)400 mL;平衡:依次缓慢加入1BV 95%乙醇、75%乙醇、55%乙醇,确保柱内充满55%乙醇。上样浓度1 g/mL,上样体积10 mL;洗脱方式:1 BV 55%乙醇→1 BV 75%乙醇→1 BV 95%乙醇,流速:1.0 mL/min;收集:10 mL/管。取1 mL馏分,0.45 μm针式过滤器过滤,HPLC检测,方法参照1.2.2,合并保留时间相同的馏分,浓缩冻干得粉末状样品,-20 ℃贮藏备用。
1.2.4 制备型高效液相色谱进一步纯化 色谱柱:COSMOSIL 5C18-MS-II(20 mm I.D×250 mm);流动相:A:水,B:甲醇;洗脱程序:0 min(A:81.5%,B:18.5%)→8 min(A:79%,B:21%)→40 min(A:60%,B:40%)→45 min(A:81.5%,B:18.5%),流速12 mL/min;上样浓度20 mg/mL,上样体积100 μL;检测波长210 nm。溶解1.2.3得到的冻干粉,按照上述方法分离,HPLC检测馏分,方法参照1.2.2,合并保留时间相同的馏分,浓缩冻干得粉末状样品,-20 ℃贮藏备用。
1.3 结构鉴定
鉴定1.2.4得到的化合物结构,质谱分析采用负离子扫描模式,扫描范围m/z 105~1200,干燥气温度300 ℃,雾化器压力50 psi,流速9 L/min,检测电压为3 kV;核磁共振分析采用Bruker Avance 600核磁共振仪扫描得到1H和13C图谱;红外光谱分析采用傅里叶变换红外光谱仪扫描(400~4000 cm-1)。
1.4 多酚单体物质的化学抗氧化能力测定
1.4.1 DPPH自由基清除能力测定 参考Chen等方法[14],吸取200 μL浓度为0.1 mmol/L DPPH的甲醇溶液,与10 μL适当稀释的样品/水混合于96孔板中。25 ℃下避光反应30 min。采用酶标仪测定样品在517 nm处的吸光值A样品,水在517 nm处的吸光值A对照。
1.4.2 ABTS自由基清除能力测定 参考Re等方法[15],将7 mmol/L ABTS与2.45 mmol/L过硫酸钾溶液混合,避光室温放置16 h,配制成ABTS溶液,用PBS将ABTS溶液稀释至734 nm下吸光值为0.70(±0.02)。取10 μL适当稀释的样品/水与200 μL ABTS溶液混合,30 ℃下避光反应6 min。采用酶标仪测定样品在734 nm处的吸光值A样品,水在734 nm处的吸光值A对照。
1.4.3 FRAP测定 参考Benzie等方法[16],稍作改动。FRAP工作液配制:双乙酸钠溶液(300 mmol/L):TPTZ溶液(10 mmol/L,用40 mmol/L HCl溶液配制):FeCl3水溶液(20 mmol/L)按10∶1∶1比例混合。吸取15 μL水和5 μL适当稀释的样品溶液加入到96孔板中,加入150 μL FRAP工作液,混匀,37 ℃下避光静置4 min,采用酶标仪测定样品在593 nm的吸光值。
1.4.4 ORAC测定 参考续洁琨等方法并加以修改[17]。首先依次加入20 μL磷酸缓冲液(pH7.4)、样品溶液、Trolox标准液到96孔黑板中,然后使用多孔道移液枪向各孔加入120 μL FL工作液(0.117 μmol/L),将96孔黑板放入已预热30 min的酶标仪中,振荡15 s,37 ℃孵育15 min,孔中迅速加入60 μL偶氮二异丁脒盐酸盐(AAPH)(40 mmol/L)。以激发波长(485±20) nm、发射波长(530±20) nm连续测定荧光强度,每2 min测定一次,测定时间2 h,整个体系保持37 ℃。各微孔不同时间点的绝对荧光强度数据与初始时间的荧光强度相比(初始荧光强度值设置为1),计算相对荧光强度f,采用近似积分法计算荧光衰退曲线下面积(AUC)。
1.5 多酚单体物质的细胞抗氧化活性评价
1.5.1 细胞培养 人正常肝细胞L-O2经解冻复苏后,培养于37 ℃、5% CO2的细胞培养箱中,培养液为89%DMEM培养基(含酚红)、10%胎牛血清、1%青霉素(100 U/mL)和链霉素(100 μg/mL),每2 d继代一次。
1.5.2 建立L-O2细胞氧化应激模型 参考尹学哲等[18]和Jeon等[19]方法。取L-O2细胞以1×105个/mL浓度接种于96孔板,每孔100 μL,置于37 ℃、含5%的CO2培养箱中培养,24 h后分别加入浓度为0.2、0.4、0.6、0.8、1.0、1.2 mmol/L的H2O2溶液,作用4 h。吸净培养液,加入100 μL 0.25 mg/L MTT溶液,37 ℃孵育2 h,再加入200 μL DMSO,37 ℃振荡15 min后,酶标仪测定550 nm波长处吸光值。
1.5.3 多酚物质对L-O2细胞增殖的影响 取L-O2细胞以1×105个/mL的细胞浓度接种于96孔培养板中,置于37 ℃、5%的CO2培养箱中培养,24 h后加入不同浓度的多酚物质溶液(0、12.5、25、50、100 μg/mL),作用24 h。吸净培养液加入100 μL 0.25 mg/L MTT溶液,37 ℃孵育2 h,再加入200 μL DMSO,37 ℃振荡15 min后,酶标仪测定550 nm波长处吸光值。
1.5.4 多酚物质对L-O2细胞氧化应激的保护作用 取L-O2细胞以1×105个/mL的细胞浓度接种于96孔培养板中,24 h后用于实验。实验分为5组:对照组、模型组及样品高、中、低剂量组。对照组加入培养基培养,模型组加入一定浓度H2O2溶液,样品组在加入H2O2溶液前先加入不同浓度的多酚物质预孵2 h。H2O2作用4 h后,吸净培养液,加入100 μL 0.25 mg/L MTT溶液,37 ℃孵育2 h,再加入200 μL DMSO,37 ℃振荡15 min后,酶标仪测定550 nm波长处吸光值。
1.6 数据统计及图像处理方法
数据以平均值±标准偏差表示,采用SPSS 16.0和OriginPro 9.0进行统计分析和绘图,每个实验重复3次。
2 结果与分析
2.1 HPLC分析
本研究以南昆山毛叶绿茶为实验材料,经30%乙醇浸提、乙酸乙酯萃取,获得其提取物,采用HPLC和LC-MS分析,结果如图1和图2所示。
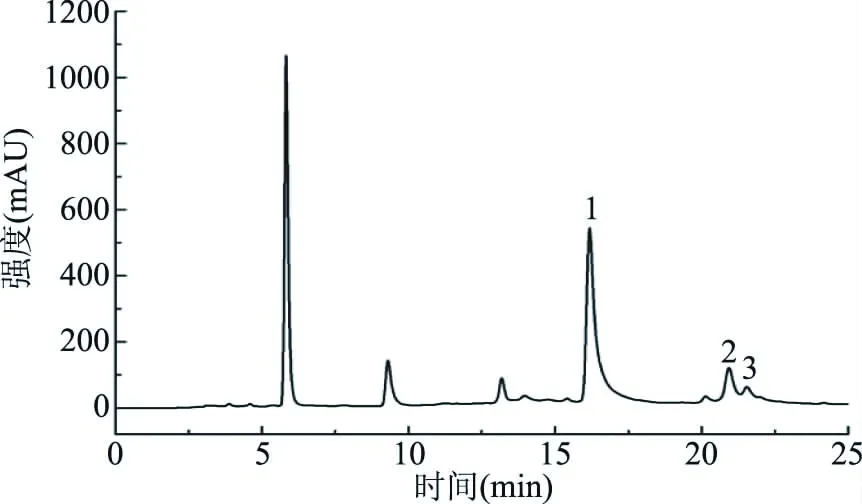
图1 30%乙醇/乙酸乙酯提取物的HPLC图谱Fig.1 HPLC diagram of 30% ethanol/ethyl acetate extracts
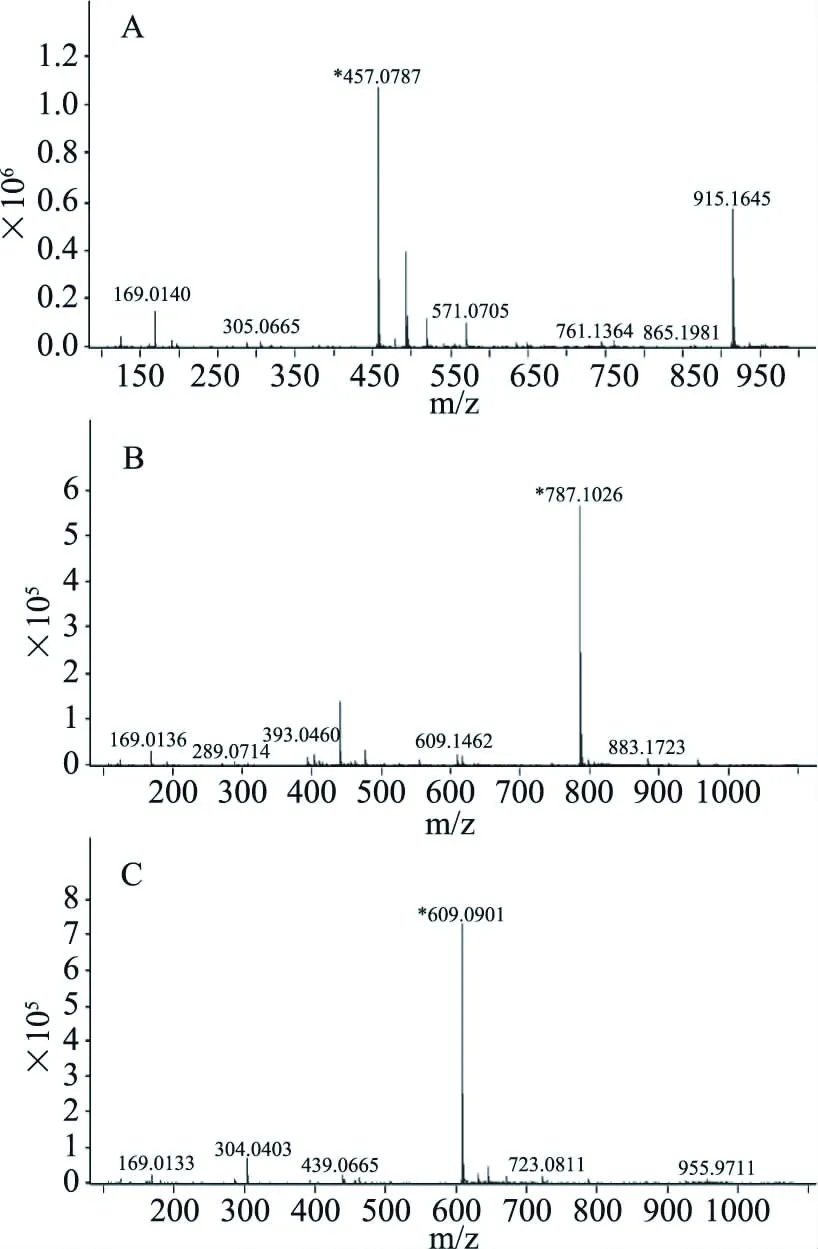
图2 30%乙醇/乙酸乙酯提取物的LC-MS图谱Fig.2 LC-MS diagram of 30% ethanol/ethyl acetate extract 注:A:峰1的分子离子扫描图;B:峰2的分子离子扫描图;C:峰3的分子离子扫描图。
从图1中可以看出,提取物中杂峰较多,分析其与提取物中含有较多的可可碱、儿茶素和色素等物质有关。采用LC-MS扫描,结果见图2,峰1的主要分子离子为457 m/z[M-H]+,峰2的主要分子离子为787 m/z[M-H]+,峰3的主要分子离子为609 m/z[M-H]+,为此,使用Sephadex LH-20层析柱分离提取物,分别收集以物质1、2、3为主的馏分,浓缩冻干成粉。称100 μg冻干粉,1 mL甲醇溶解过膜,HPLC检测后根据面积归一化方法计算得出物质1、2和3的纯度分别为72%、48%和40%。为了进一步提高目标物的纯度,采用制备型液相色谱再次分离纯化上述冻干粉,收集目标馏分,浓缩冻干成粉,HPLC检测结果如图3所示,计算得出物质1、2和3的纯度为98%、96%和97%,得率分别为2.45%、0.55%、0.31%。

图3 制备液相分离纯化后3种物质的HPLC图谱Fig.3 HPLC diagram of three kinds of substances prepared by liquid phase separation and purification注:A:物质1;B:物质2;C:物质3。
2.2 结构鉴定
采用高效液相色谱-串联质谱、核磁共振和红外光谱技术对纯度为98%、96%和97%的物质1、2和3进行结构鉴定,得到结果如下。
通过分子特征提取技术,借助MFE软件和谱库获得3种物质结构组成信息,母离子和主要碎片离子,推测结构如图4所示。
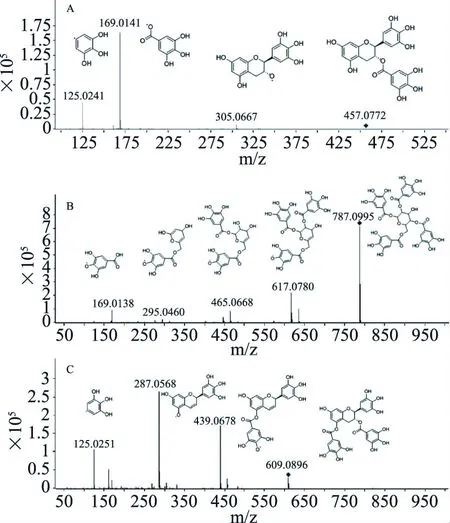
图4 3种物质的LC-MS/MS图谱Fig.4 LC-MS/MS diagram of three kinds of substances注:A:物质1;B:物质2;C:物质3。
3种物质的1H核磁共振、13C核磁共振图谱如图5所示。
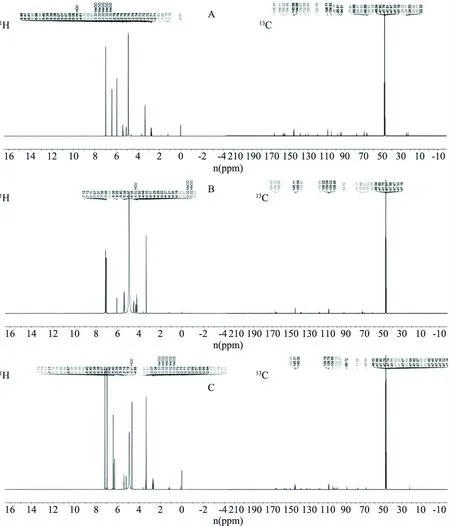
图5 3种物质的氢谱(1H)和碳谱(13C)图谱Fig.5 Hydrogen spectrum(1H)and carbon spectrum(13C)spectrum of three substances 注:A:物质1;B:物质2;C:物质3。
进一步对3种物质进行红外光谱分析,结果如图6所示。3280~3340 cm-1是酚羟基的OH伸缩振动峰,1688~1700 cm-1是芳香酮的C=O伸缩振动峰,1027~1235 cm-1显示为芳香醚的C-O-C伸缩振动峰[20],1449~1627 cm-1显示苯环骨架特征振动峰[21],红外图谱结果显示3种物质均具有苯环结构、酚羟基基团、芳香酮基团和芳香醚基团。
综合上述结果,根据质谱分析、氢原子和碳原子的化学位移值和红外光谱分析,结合相关文献报道[22-24],鉴定物质1为没食子儿茶素没食子酸酯(GCG,C22H18O11),物质2为1,2,4,6-四没食子酰葡萄糖(1,2,4,6-GA-glc,C34H28O22),物质3为儿茶素-3,5-二没食子酸酯(GC-3,5-diGA,C29H22O15)。3种多酚单体物质的结构式如图7所示。
2.3 抗氧化活性评价
本研究以EGCG为对照,采用DPPH、ABTS、FRAP和ORAC四种化学方法及L-O2肝细胞氧化应激模型,综合分析GCG、1,2,4,6-GA-glc和GC-3,5-diGA这3种多酚单体物质的抗氧化活性。
2.3.1 DPPH自由基清除能力 4种多酚物质对DPPH自由基的清除作用如图8所示。在30~80 μg/mL浓度范围内,EGCG、GCG、1,2,4,6-GA-glc和GC-3,5-diGA的DPPH自由基清除率随着浓度的增大而提高,呈现出剂量依赖关系。当浓度30~60 μg/mL时,GCG的DPPH自由基清除率高于EGCG,GC-3,5-diGA与EGCG接近,1,2,4,6-GA-glc比EGCG低;当浓度在60~80 μg/mL时,GCG对DPPH自由基清除率与EGCG相当,GC-3,5-diGA比EGCG低,高于1,2,4,6-GA-glc。经计算,EGCG、GCG、1,2,4,6-GA-glc和GC-3,5-diGA清除DPPH自由基的IC50值分别是46.21±1.43、44.15±0.57、57.67±1.11和49.43±0.25 μg/mL。
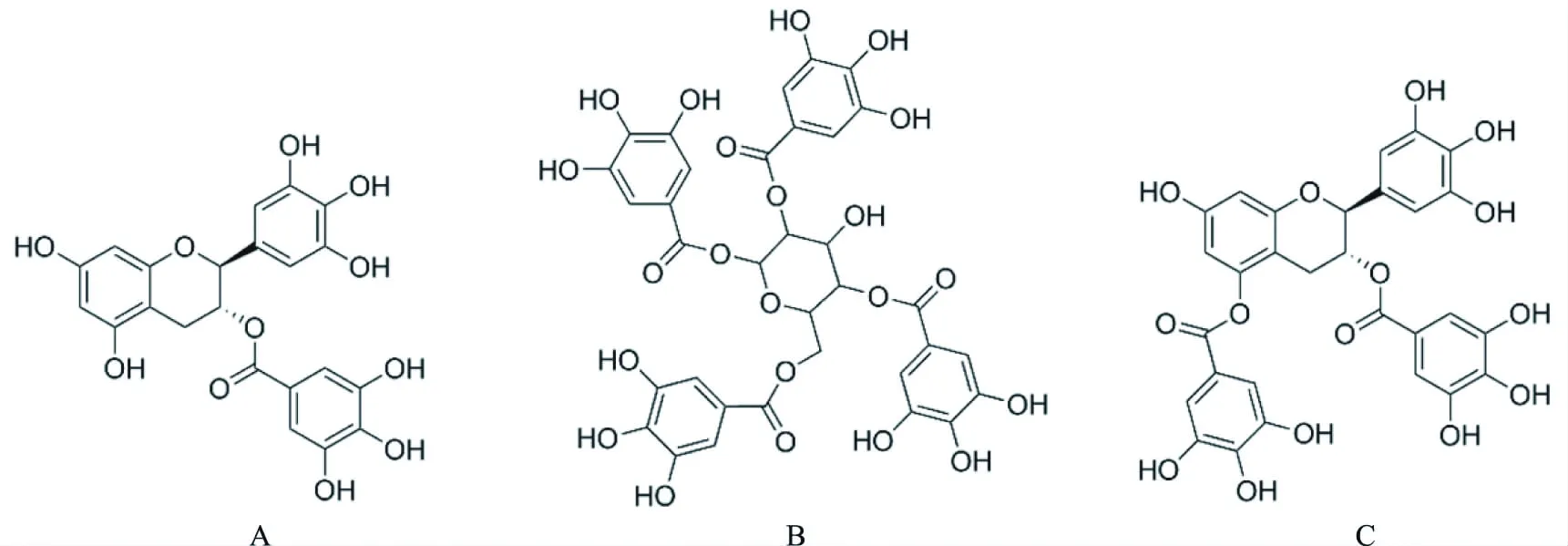
图7 3种多酚单体物质的化学结构Fig.7 Chemical structure of three kinds of polyphenolic monomers注:A:GCG;B:1,2,4,6-GA-glc;C:GC-3,5-diGA。
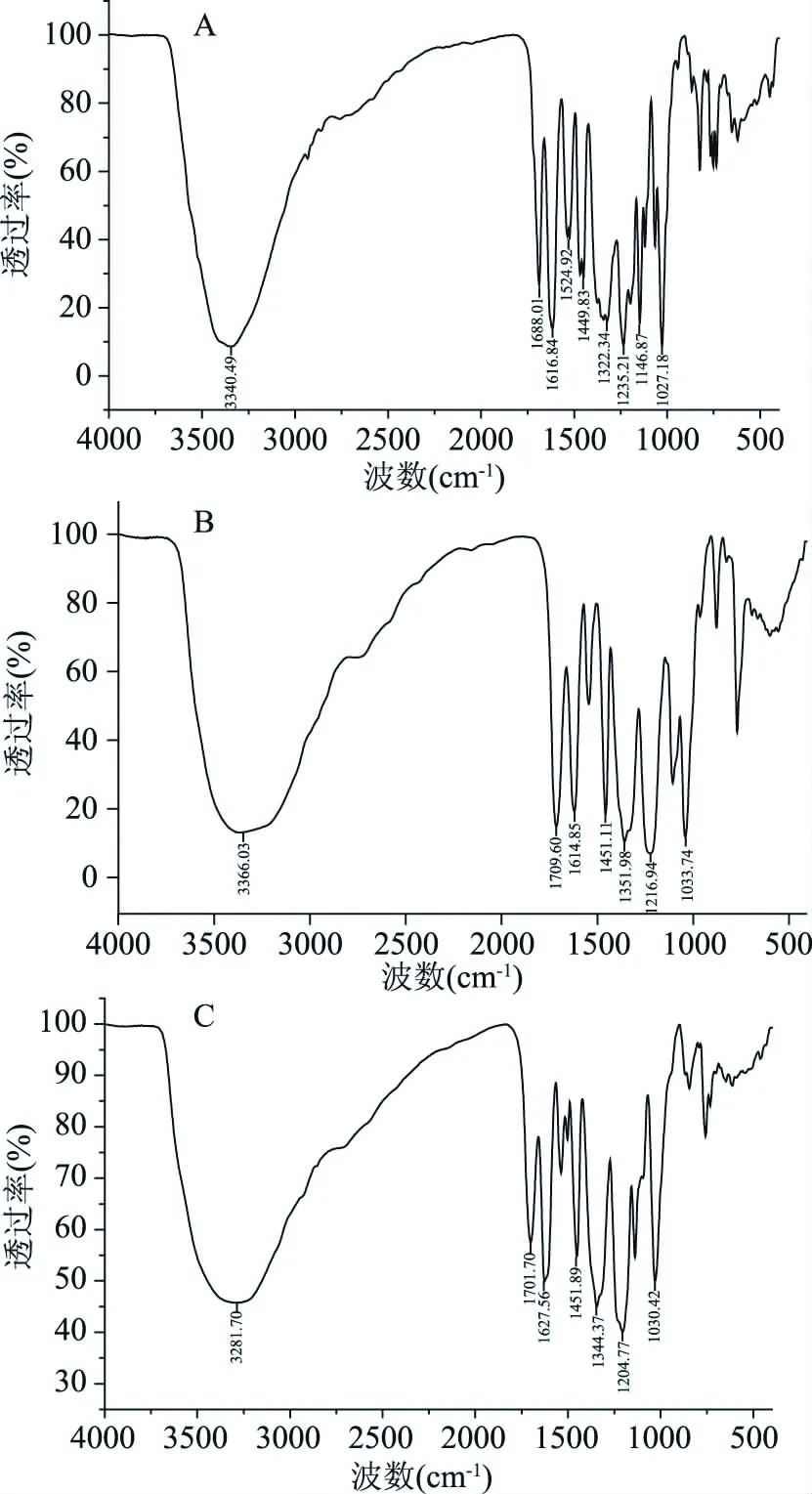
图6 3种物质的红外光谱图Fig.6 FT-IR spectrum of three substances 注:A:物质1;B:物质2;C:物质3。

图8 4种多酚物质对DPPH自由基的清除作用Fig.8 DPPH free radical scavenging activity of four kinds of polyphenols
2.3.2 ABTS自由基清除能力 4种多酚物质对ABTS自由基的清除作用如图9所示。在10~60 μg/mL浓度范围内,EGCG、GCG、1,2,4,6-GA-glc和GC-3,5-diGA随着浓度增大而ABTS自由基清除能力增强,呈现出良好的剂量依赖关系。当浓度为60 μg/mL时,EGCG、GCG、1,2,4,6-GA-glc和GC-3,5-diGA对ABTS自由基的清除率为78.65%±0.56%、84.21%±0.56%、71.55%±0.76%和77.25%±1.16%,表现出较强的ABTS自由基清除能力,经计算,EGCG、GCG、1,2,4,6-GA-glc和GC-3,5-diGA清除ABTS自由基的IC50值分别是32.98±0.59、31.93±1.00、37.87±0.25和35.06±0.27 μg/mL。

图9 4种多酚物质对ABTS自由基的清除作用Fig.9 ABTS free radical scavenging activity of four kinds of polyphenols
2.3.3 FRAP测定 4种多酚物质的FRAP结果如图10所示。在50~90 μg/mL浓度范围内,随着样品浓度的增大,其Fe3+还原能力随之增强,当浓度为90 μg/mL时,EGCG、GCG、1,2,4,6-GA-glc和GC-3,5-diGA的吸光值为0.36±0.01、0.44±0.01、0.32±0.01和0.31±0.01,样品的Fe3+还原能力强弱顺序为:GCG>EGCG>1,2,4,6-GA-glc、GC-3,5-diGA。

图10 4种多酚物质的Fe3+还原能力Fig.10 FRAP of four kinds of polyphenols
2.3.4 ORAC测定 4种多酚物质的ORAC值如图11所示,计算得到GCG、EGCG、1,2,4,6-GA-glc和GC-3,5-diGA的ORAC值分别为4.33±0.25、4.92±0.41、6.55±0.09和4.99±0.55 mmol TE/g,由此1,2,4,6-GA-glc的氧自由基吸收能力最佳,EGCG、GCG和GC-3,5-diGA作用相当,没有显著性差异(P>0.05)。

图11 4种多酚物质的ORAC值Fig.11 ORAC value of four kinds of polyphenols注:字母不同表示显著性差异(P<0.05)。图12同。
DPPH、ABTS、FRAP三种化学方法测定得到的TEAC值(以Trolox为标准品制作标准曲线,结果表示为每克样品的Trolox毫摩尔当量(mmol TE/g),即TEAC值)见表1。从表1可看到,三种化学方法的抗氧化能力趋势大体一致:GCG>EGCG>GC-3,5-diGA>1,2,4,6-GA-glc,综合可得,本研究分离得到的3种多酚物质均具有强化学抗氧化能力,其中GCG最佳,GC-3,5-diGA次之,1,2,4,6-GA-glc较弱。

表1 4种多酚物质的TEAC值Table 1 Chemical antioxidant activity of four kinds of polyphenols
注:同列肩标字母不同表示显著性差异(P<0.05);TEAC值越大,表示抗氧化能力越强。
2.3.5 L-O2细胞氧化应激模型的建立 在采用4种化学抗氧化方法分析3种多酚物质的抗氧化能力的基础上,本研究建立L-O2细胞氧化应激模型,进一步评价3种多酚物质的细胞抗氧化活性,以EGCG为对照。首先将不同浓度的H2O2作用于L-O2细胞4 h,根据细胞存活率确定H2O2的作用浓度,结果如图12所示。
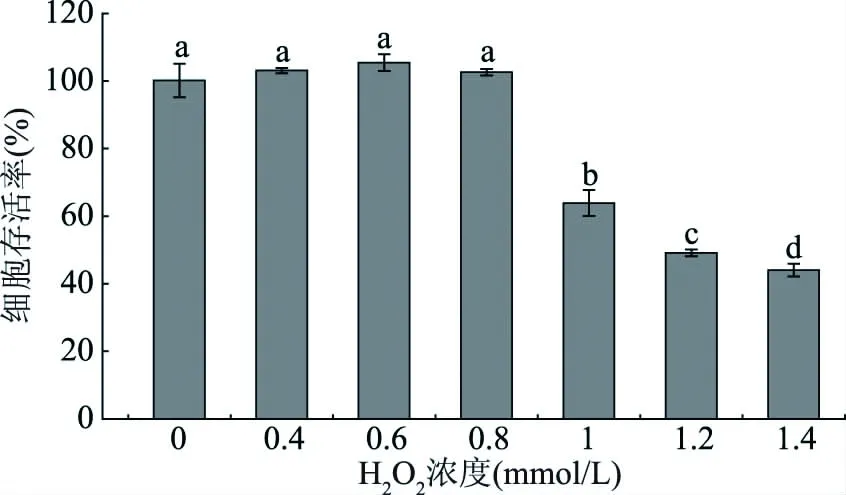
图12 H2O2浓度对L-O2细胞存活率的影响Fig.12 Influence of H2O2 concentration on cell viability of L-O2 cells
由图12可知,与对照组相比,当H2O2浓度在0.4~0.8 mmol/L范围时,H2O2处理对细胞存活率无显著影响(P>0.05),说明此浓度范围的H2O2对细胞无毒害作用;当H2O2浓度为1.0~1.4 mmol/L时,经H2O2处理后细胞存活率显著降低(P<0.05),并且随着浓度增大,细胞存活率显著下降(P<0.05),表明该浓度范围的H2O2对细胞有毒性作用。当H2O2浓度为1.2 mmol/L时,细胞存活率下降到49.17%±1.02%,由于细胞存活率为50%左右时H2O2浓度适合建立细胞氧化应激模型[25],所以选取1.2 mmol/L H2O2为作用浓度。
2.3.6 多酚物质对L-O2细胞增殖的影响 本研究在探究样品对氧化应激的保护作用之前,先进行毒性实验,摸索一个无毒副作用的浓度范围,结果如图13所示。

图13 4种多酚物质对L-O2细胞增殖的影响Fig.13 Effects of four kinds of polyphenols on proliferation of L-O2 cells注:“#”表示样品组与对照组存在显著性差异(P<0.05,n=3)。
从图13可得,在12.5~100 μg/mL范围内,EGCG、GCG和GC-3,5-diGA作用24 h后细胞的存活率均高于90%,表明这3种多酚物质对细胞的正常增殖没有明显影响,而在此浓度范围内,1,2,4,6-GA-glc的存活率与正常培养基相比,均具有显著性差异(P<0.05),但是浓度为12.5和25 μg/mL时,1,2,4,6-GA-glc的存活率分别为88.45%±1.41%和89.27%±1.69%,存活率接近90%。为了研究物质的抗氧化活性,本研究后续实验选择的EGCG、GCG和GC-3,5-diGA浓度范围≤100 μg/mL,1,2,4,6-GA-glc的浓度为≤25 μg/mL。
2.3.7 多酚物质对L-O2细胞氧化应激的保护作用 4种多酚物质对氧化损伤的L-O2细胞的保护作用如图14所示。
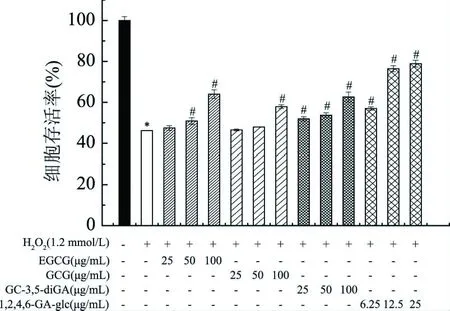
图14 4种多酚物质对对氧化损伤的L-O2细胞的保护作用Fig.14 Protective effects of four kinds of polyphenols on oxidative damage of L-O2 cells注:“*”表示模型组与对照组存在显著性差异(P<0.05,n=3);“#”表示样品组与模型组存在显著性差异(P<0.05,n=3)。
由图14可知,与对照组相比,模型组的细胞存活率显著降低(P<0.05)。与模型组相比,在实验浓度内,除低剂量(25 μg/mL)的EGCG和(25和50 μmol/L)GCG对细胞存活率无显著影响外(P>0.05),4种多酚物质处理均可显著提高细胞存活率(P<0.05),呈现出良好的剂量依赖关系。在浓度为100 μg/mL时,EGCG、GCG和GC-3,5-diGA处理后使细胞存活率分别提高了38.66%±4.59%、26.98%±1.96%、35.58%±5.37%;浓度为25 μg/mL时,1,2,4,6-GA-glc使细胞存活率提高了70.87%±3.61%。分析上述结果可得,低剂量的GCG和EGCG对细胞存活率无显著影响(P>0.05),高剂量的EGCG、GCG、1,2,4,6-GA-glc和GC-3,5-diGA预处理均能显著提高细胞存活率(P<0.05),以降低H2O2对L-O2细胞的氧化损伤;GC-3,5-diGA细胞氧化损伤保护作用强于GCG,与EGCG相当;1,2,4,6-GA-glc虽然具细胞低毒性,但低浓度就具有较强的细胞氧化损伤保护作用。
综合上述抗氧化结果,证实南昆山毛叶茶中GCG和2种特殊多酚物质1,2,4,6-GA-glc、GC-3,5-diGA都具有良好的抗氧化活性。DPPH、ABTS和FRAP三种化学方法测得的抗氧化结果基本一致:GCG>EGCG>GC-3,5-diGA>1,2,4,6-GA-glc。EGCG作为GCG的同分异构体,在30~60 μg/mL浓度范围内,GCG清除DPPH自由基的能力强于EGCG,这结果与已报道低浓度GCG在清除大分子自由基能力强于EGCG[26]的结论一致;Kumamoto等[27]研究发现,溶液中的金属离子Fe2+会弱化EGCG的抗氧化活性,由此推测GCG铁离子还原能力强可能由于其空间结构受pH和Fe2+的弱化影响较小;GC-3,5-diGA在结构上是由GCG结构上A环的5-OH的氢原子被没食子酰基取代而成,由此可得,A环上的5-OH可以增强多酚单体物质的抗氧化能力;由于黄酮类物质具有较强的抗氧化活性[28],具有类黄酮母核结构的GCG和GC-3,5-diGA的抗氧化活性强于1,2,4,6-GA-glc。ORAC法的结果与上述三种化学方法的结果相反,而与细胞抗氧化结果相似,这与ORAC法具有生物相关性有关[29],本研究L-O2细胞氧化应激保护结果显示,3种多酚物质可显著提高细胞存活率,减少氧化损伤,但是其抗氧化分子机理还需进一步深入研究。Peng等[30]研究发现南昆山毛叶茶的抗氧化活性强于传统茶,推测这可能与茶中的多酚物质相关。GCG是南昆山毛叶茶中含量最多的儿茶素,1,2,4,6-GA-glc和GC-3,5-diGA为南昆山毛叶茶中的特殊物质,本研究表明这3种物质均具有强抗氧化活性,但是其在南昆山毛叶茶抗氧化活性中的贡献程度还有待进一步探究。
3 结论
本研究以南昆山毛叶绿茶为研究原料,采用Sephadex LH-20柱层析和制备型高效液相色谱联用的方法得到3种物质,并通过高效液相色谱-串联质谱、核磁共振方法和红外色谱方法鉴定其为GCG、1,2,4,6-GA-glc、GC-3,5-diGA,纯度分别为98%、96%、97%,得率分别为2.45%、0.55%、0.31%。
为研究南昆山毛叶茶中3种多酚物质的抗氧化活性,以EGCG为对照,分别采用DPPH、ABTS、FRAP和ORAC四种化学方法及L-O2肝细胞氧化应激模型法对其进行综合评价。结果显示,前三种化学方法测得的抗氧化结果基本一致:GCG>EGCG>GC-3,5-diGA>1,2,4,6-GA-glc,ORAC法的结果与此结果相反,1,2,4,6-GA-glc效果最佳。L-O2细胞氧化应激保护结果显示,高剂量的EGCG、GCG、GC-3,5-diGA和1,2,4,6-GA-glc可明显提高细胞存活率,减少氧化损伤,抗氧化能力强弱顺序:1,2,4,6-GA-glc>GC-3,5-diGA、EGCG>GCG。综合比较抗氧化结果,南昆山毛叶茶中GCG具有较强的化学抗氧化能力,2种特殊多酚物质1,2,4,6-GA-glc和GC-3,5-diGA具有强细胞抗氧化能力。

