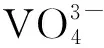化学溶液法制备BiVO4纳米晶及其结构、形貌及光谱性质研究
王捷琳, 廖 蕊, 李园利, 潘小琴, 黄鹤燕, 郭宝刚, 刘海峰, 谢瑞士
(西南科技大学 材料科学与工程学院 分析测试中心, 绵阳 621010)
1 引 言
钒酸铋(BiVO4)是一种安全无毒、着色力强的无机材料. 因其具有铁弹性[1]和离子导电性[2]等特性,在离子导体、固态燃料电池正极材料[3]等领域有着广泛的应用前景[4].
近年来,随着对环境污染问题的研究,光催化在水处理,污染物去除等方面受到了广泛的关注. BiVO4以其特有的光学特性活跃于光催化领域,在光降解有机污染物方面起着重要作用. 过去被使用的TiO2因其禁带宽度大,只有一小部分能吸收利用太阳能. 而BiVO4带隙窄,在可见光范围内均可吸收太阳能,对能源的利用率大大提高,能更好地将污染物进行催化降解. BiVO4的光催化性能与其晶型密切相关,包括三种晶型:单斜晶系白钨矿型、四方晶系白钨矿型和四方晶系锆石型[5]. 已有文献报道BiVO4的制备及性能研究[6-7],但是深入细致地探索不同结构、形貌和尺寸的纳米晶的形成机制及光谱性质变化规律的研究极少.
目前已有多种BiVO4的合成方法,常见的有溶胶-凝胶法[8]、共沉淀法[9]、水热合成法[10]、火焰喷雾合成法[11]、超声喷雾热解法[12-13]、微波合成法[13]、有机金属分解法[14-15]等. 通过控制干燥温度[9]以及加入溶剂的量等方法能制备出BiVO4材料. 然而,许多制备方法需要复杂的设备或者额外的能量(如,电场、微波),不适宜纳米晶的宏量制备.
本文采用安全、绿色、节能的化学溶液法合成了BiVO4纳米晶. 通过改变反应体系的pH值,来调控纳米晶生长的动力学因素. 探索了不同结构、形貌和尺寸的纳米晶的形成机制及光谱性质的变化规律.
2 实 验
2.1 试 剂
硝酸铋(Bi(NO3)3·5H2O,99%),钒酸铵(NH4VO3,99%),硝酸(HNO3,99%),氢氧化钠(NaOH,96.0%),无水乙醇(C2H6O,99.7%). 以上试剂均为分析纯.
2.2 BiVO4的制备
在250 mL三颈瓶中加入100 mL去离子水,加热至30 ℃后恒温备用. 将5 mmol Bi(NO3)3·5H2O溶解于5 mL、4 mol/L HNO3溶液中,室温下搅拌至溶解;同时将5 mmol NH4VO3溶解于80 ℃去离子水中,在恒温磁力搅拌下溶解为淡黄色透明溶液. 将两种溶液加入三颈瓶中,用4 mol/L NaOH溶液调节pH. 通过控制NaOH用量使得混合溶液的pH分别为1、3、5、7、9. 再将体系反应温度调节至100 ℃,恒温反应1 h. 反应结束后,将样品于室温下静置24 h,倒掉上清液,用无水乙醇和去离子水清洗下层沉淀物. 最后将产物干燥后碾磨得粉末样品.
2.3 样品的表征
用X射线衍射仪(X’Pert PRO型,荷兰帕纳科公司)测试样品的XRD图谱;用紫外可见漫反射分光光度计(Solid Spec-3700型,日本岛津公司)测试样品的吸收光谱;用傅里叶红外光谱(Spectrum One型,美国PE仪器公司)和拉曼(InVia型,英国雷尼绍公司)测试样品的结构;用场发射扫描电子显微镜(Ultra 55型,德国卡尔·蔡司公司)测试样品的形貌;用荧光分光光度计(F-4600,日本日立公司)测试样品的发光性质.
3 结果与讨论
3.1 结构与形貌分析
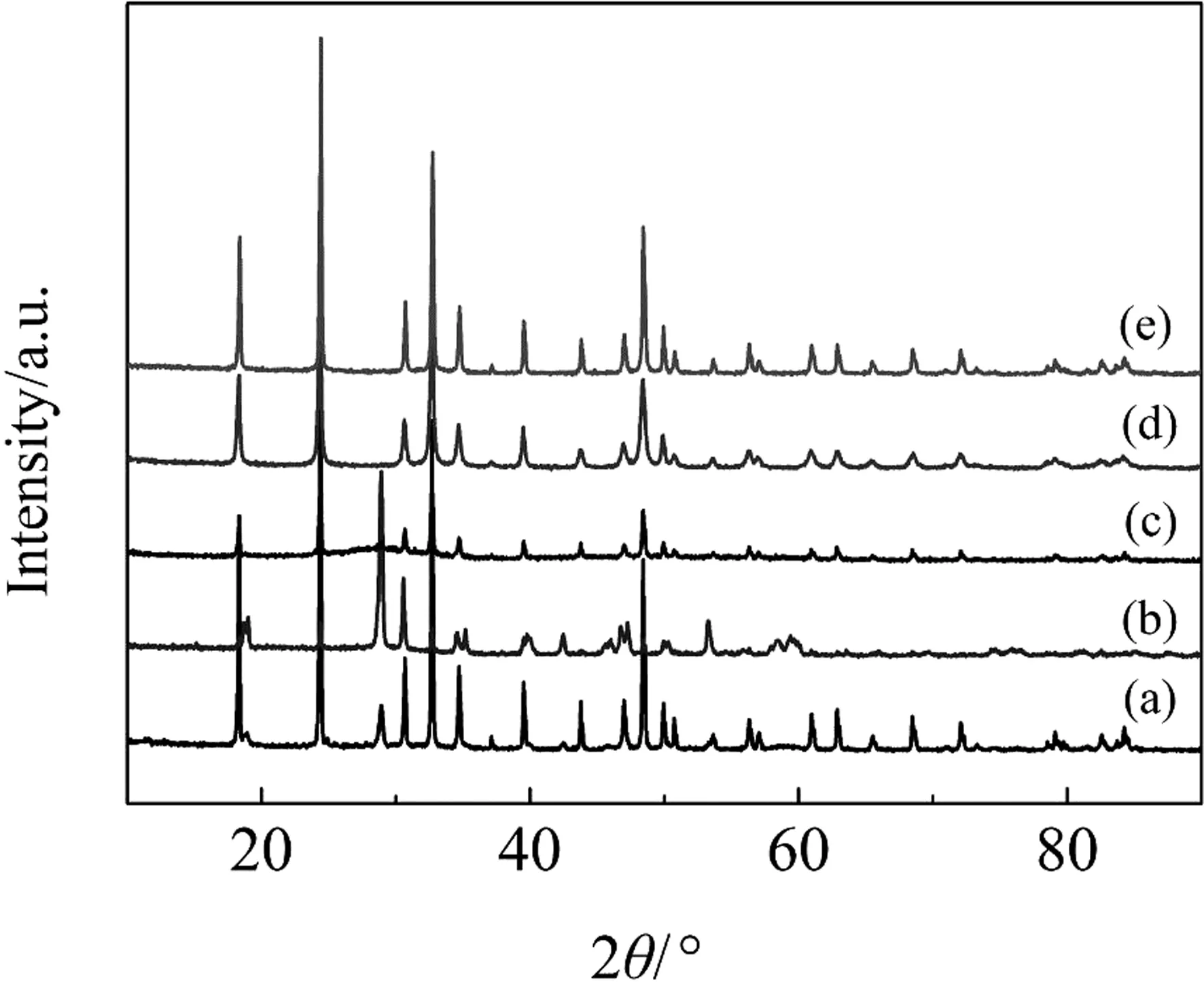
图1 不同pH值下合成的BiVO4纳米晶的XRD图谱: (a) pH=1; (b) pH=3; (c) pH=5; (d) pH=7; (e) pH=9Fig.1 XRD patterns of BiVO4 nanocrystals synthesized at different pH values: (a) pH=1; (b) pH=3; (c) pH=5; (d) pH=7; (e) pH=9
从图1可以看出,在强酸体系中(pH=1)合成的BiVO4粉体,在衍射角2θ=24.376°出现最强峰,对应四方相BiVO4的(200)晶面;两个较强峰的衍射角2θ=32.69°和18.33°分别对应四方相BiVO4的(112)晶面和(101)晶面,这一结果与标准卡片PDF#14-0133吻合. 在弱酸体系中(pH=3、5)合成的BiVO4粉体,在衍射角2θ=28.92°出现的弱峰对应单斜相BiVO4的(121)晶面,表明在弱酸性体系中合成的BiVO4为四方锆石型与单斜白钨矿型的BiVO4混和相. 当反应体系处于碱性时(pH=7、9),三强峰的衍射角2θ=28.92°、18.96°、30.53°分别对应四方相BiVO4的(-121)、(011)、(040)晶面,与标准卡片PDF#14-0688一致,说明合成的样品为四方相白钨矿结构的BiVO4.
推断可能反应方程如下:
Bi3++H2O↔Bi(OH)2++H+↔
Bi(OH)2++2H+
在酸性条件,四方相BiVO4为热稳定相. 但在弱碱条件,由于热动力学,反应趋向于形成单斜相BiVO4. 在强碱条件,单斜相BiVO4的特征衍射峰强度降低. 非常明显的是,在强碱条件下具有良好结晶性和大晶粒的单斜相BiVO4不利于生长. 可能是由于过量的氨源引起溶液中形成大量的氢氧根离子. 一方面,溶液中存在高浓度的氢氧根离子时,钒酸铵与氢离子存在反应,会生成微溶的钒酸胶体. 因此,钒在溶液中以钒酸根的形式存在. 随后,在反应后,钒源以钒酸根的形式被消耗掉. 另一方面,溶液中存在高浓度的氢氧根离子时,铋离子与氢氧根离子存在反应,会生成氢氧化铋沉淀. 然而,氢氧化铋很容易形成聚阴离子型铋氧化合物沉淀. 因而,这种状况下,溶液化学反应很难成功地生成BiVO4晶体. 由于上述两个方面,大量的铋源和钒源被消耗掉.
因此,pH值对于产物的形成是一个非常重要的因素,它会影响合成的BiVO4的结晶相. 酸性条件,利于形成四方相BiVO4. 具有良好结晶性的单斜相BiVO4易于在近中性的条件下形成. 而在强碱条件下,单斜相BiVO4的结晶性明显降低,甚至可能形成氢氧化铋化合物.
根据谢乐公式算出产物的晶粒尺寸大约在10.80~23.20 nm之间,表明合成的样品处于纳米级尺度. 随着pH的升高,合成的BiVO4纳米晶的晶粒尺寸分别为23.20、13.19、11.35、13.18和10.90 nm.
图2显示了不同pH值条件下合成的BiVO4纳米晶的SEM图像. 由于形貌演变机理以及pH值在形貌控制过程中的影响十分复杂,因此,目前仍然很难揭示其具体的影响过程. 此处根据SEM结果,并结合Ostwald熟化机制,对不同pH值条件下BiVO4样品的形貌形成机制进行了初步的分析和探讨,如图2所示. 在化学合成过程中,体系的pH值对样品形貌的形成起着十分关键的作用. 由于Bi3+离子的水解作用,其可以在不同的pH值条件下以不同的形式存在,导致在合成BiVO4过程中具有不同的合成路径,进而使得在不同pH值条件下合成的BiVO4样品具有不同的形貌结构.

(a)

(b)

(c)

(d)

(e)
Fig.2 SEM images of BiVO4nanocrystals synthesized at different pH values: (a) pH=1; (b) pH=3; (c) pH=5;(d) pH=7; (e) pH=9
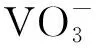
3.2 EDX分析
图3为合成的BiVO4纳米晶样品的典型的EDX光谱. 可以发现,图中出现了明显的Bi、V、O元素特征峰,说明成功合成了BiVO4.
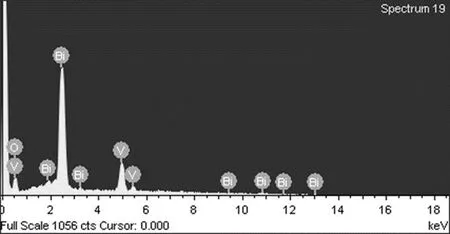
图3 BiVO4纳米晶的EDX光谱Fig.3 EDX spectrum of BiVO4 nanocrystal
3.3 FT-IR分析
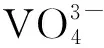
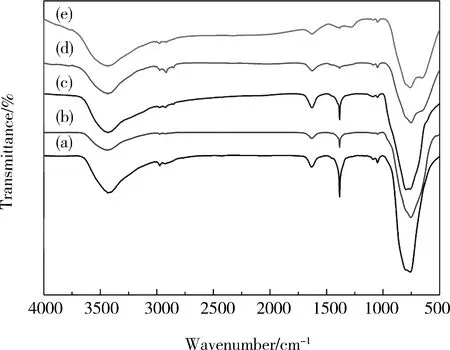
图4 不同pH值下合成的BiVO4纳米晶的FT-IR图谱: (a) pH=1; (b) pH=3; (c) pH=5; (d) pH=7; (e) pH=9Fig.4 FT-IR spectra of BiVO4 nanocrystals synthesized at different pH values: (a) pH=1; (b) pH=3; (c) pH=5; (d) pH=7; (e) pH=9
3.4 Raman分析
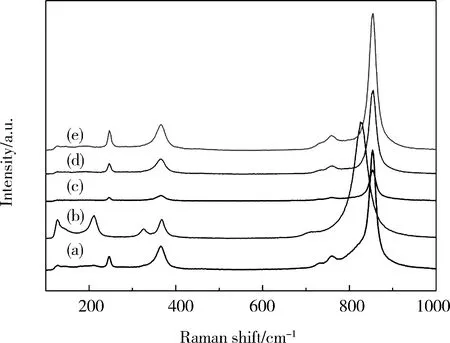
图5 不同pH值下合成的BiVO4纳米晶的Raman图谱: (a) pH=1; (b) pH=3; (c) pH=5; (d) pH=7; (e) pH=9Fig.5 Raman spectra of BiVO4 nanocrystals synthesized at different pH values: (a) pH=1; (b) pH=3; (c) pH=5; (d) pH=7; (e) pH=9
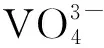
3.5 UV-vis DRS分析
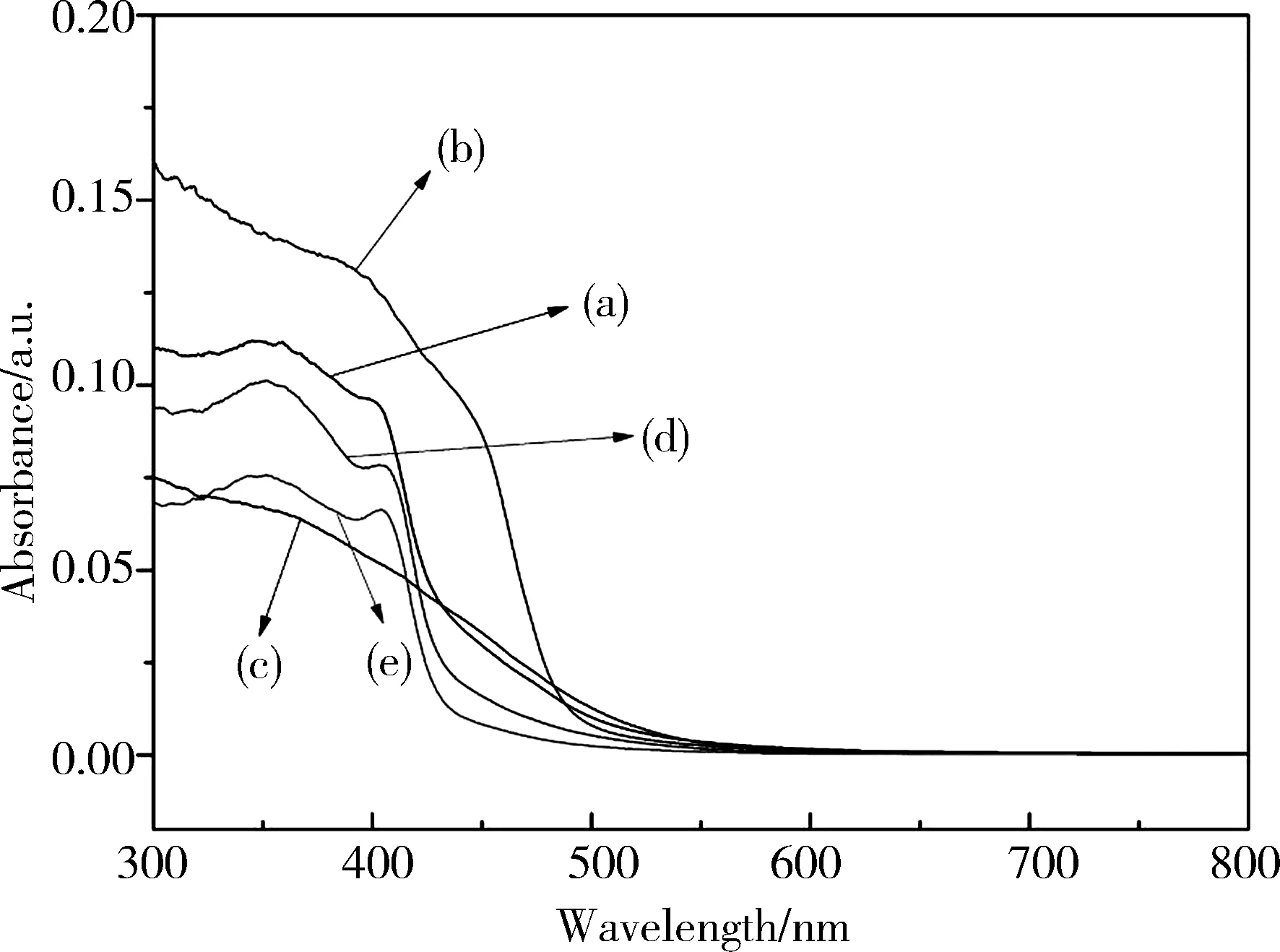
图6 不同pH值下合成的BiVO4纳米晶的UV-vis DRS光谱: (a) pH=1; (b) pH=3; (c) pH=5; (d) pH=7; (e) pH=9Fig.6 UV-vis DRS absorption spectra of BiVO4 nanocrystals synthesized at different pH values: (a) pH=1; (b) pH=3; (c) pH=5; (d) pH=7; (e) pH=9
图6是不同pH值下合成的BiVO4纳米晶样品的UV-vis DRS光谱. 根据图谱可知,不同BiVO4纳米晶在紫外和可见光区均有明显吸收,而其吸收边界的急剧下降推断是由于半导体的带间跃迁造成的. 不同晶相BiVO4纳米晶的吸收带边有明显的不同,随着样品晶相由混合相向四方相的转变,吸收不断蓝移,禁带宽度也有所改变. 这表明随着晶相的改变,样品内部电子结构发生了变化. 利用Tauc公式计算了不同BiVO4纳米晶的禁带宽度(Eg),分别为2.90、2.91、2.82、2.89、2.92 eV. 显然,通过改变反应参数,如pH值,可以调控产物的禁带宽度.
3.6 PL分析
光致发光是研究半导体材料光学特性和电子结构的有效方法,能够揭示半导体纳米材料的光生载流子(电子-空穴对)的分离与复合,以及表面氧空位和表面缺陷等结构特性. 对于光催化材料而言,光照射时催化剂的电子空穴分离效率是光催化活性的重要指标之一. 不同pH值条件下合成的BiVO4纳米晶的PL光谱如图7所示. 从图7中可以看出,BiVO4纳米晶在470或520 nm附近有明显的发光峰,说明在此处光生电子空穴较易复合. 在pH=3时合成的BiVO4纳米晶的发光峰强度最低,表明该复合催化剂的电子空穴复合效率最低,暗示其具有较高的光催化活性;在pH=9时合成的BiVO4纳米晶的发光峰强度最高,表明该复合催化剂的电子空穴复合效率最高.
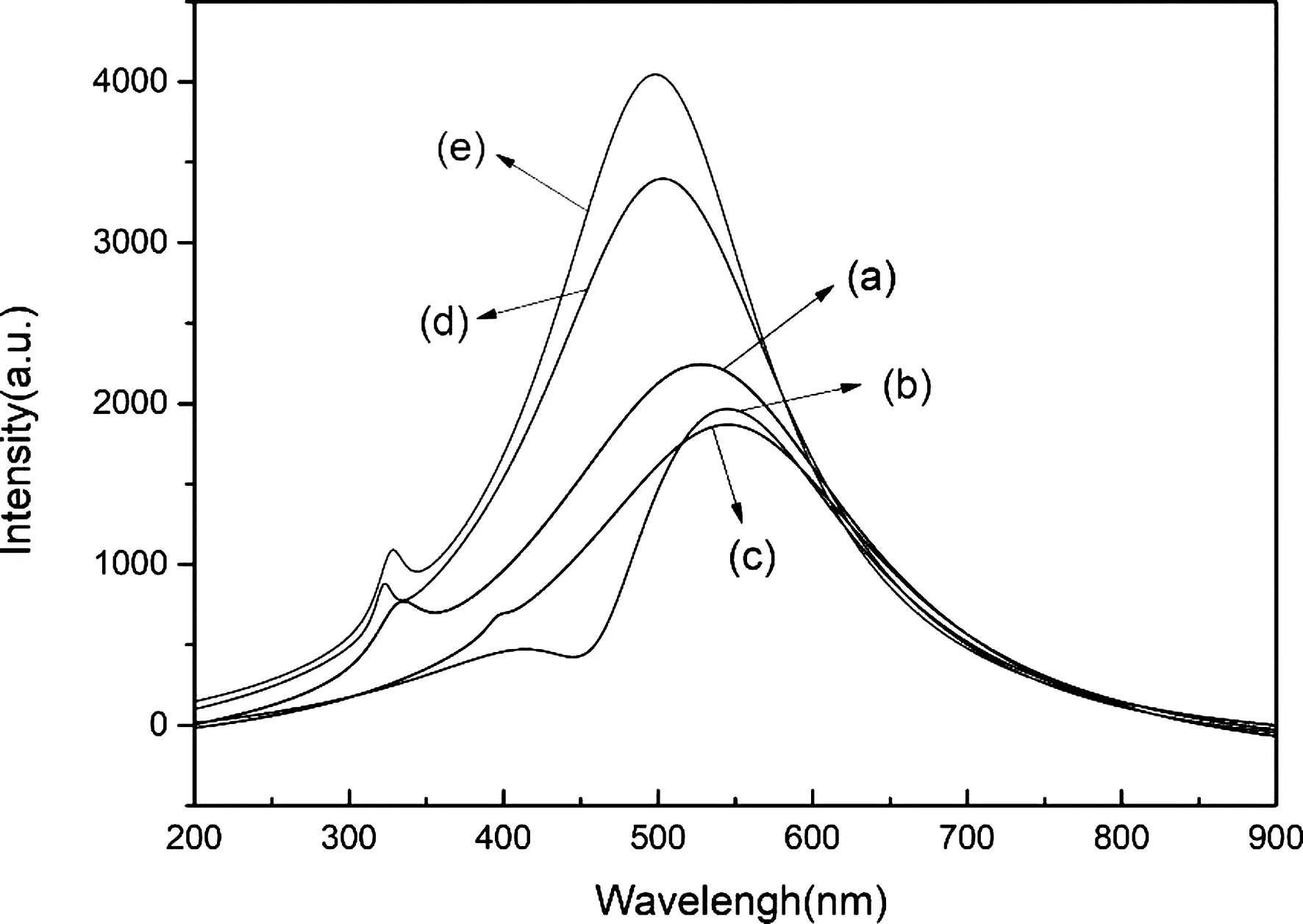
图7 不同pH值下合成的BiVO4纳米晶在201nm被激发的PL发射光谱: (a) pH=1; (b) pH=3; (c) pH=5; (d) pH=7; (e) pH=9Fig.7 PL emission spectra of BiVO4 nanocrystals synthesized at different pH values: (a) pH=1; (b) pH=3; (c) pH=5; (d) pH=7; (e) pH=9
4 结 论