MMP14通过调节Wnt/β-catenin信号通路影响胃癌的发生、发展机制研究
李 刚 刘江豪 罗璟璐 张新峰
胃癌是全球范围内最常见的恶性肿瘤之一,其发生率随着年龄的增加也随之上升,目前治疗胃癌的方法主要包括局部肿瘤切除、化疗及胃切除术等[1,2]。临床上,肿瘤侵袭转移是胃癌治疗失败的重要原因之一,其是一个多因素参与的过程,寻找胃癌细胞侵袭、转移的相关分子将其作为靶点,给予相应的治疗药物和方案,有利于提高患者的治疗率和生存率[3,4]。
基质金属蛋白酶(MMP)是一种能够降解细胞外基质的重要酶类,其能够降解破坏组织屏障,在肿瘤侵袭转移过程中发挥至关重要的作用[5,6]。MMP14作为MMP家族的重要成员,其能够通过促进癌细胞的上皮-间质转化调节癌细胞的浸润和转移[7]。有研究表明胃癌组织中通常具有高表达的MMP14,但是MMP14对胃癌的发生、发展机制依然是不太清晰[8]。本研究假设MMP14在体内外均能够影响胃癌的发生、发展,并进一步探索了相关的机制,为探讨MMP14在早期胃癌的诊断和治疗过程中提供新的线索。
材料与方法
1.实验材料:RPMI1640培养基、胎牛血清(FBS)(美国Gibco公司);青霉素、链霉素(加拿大威士特公司);四氮唑蓝(MTT)(美国Sigma公司);Transwell小室(美国康宁公司);VEGF、E-cadherin、Vimentin、c-Myc、cyclinD1、AXIN2、β-catenin、β-actin抗体(英国Abcam公司);蛋白裂解液(中国碧云天公司)。
2.细胞培养:胃黏膜上皮细胞GSE-1细胞株、SGC-7901、BGC-823和MKN45胃癌细胞株均购自ATCC(美国菌种保载中心),培养于含有10% FBS和100U/ml青霉素、100g/ml链霉素的RPMI1640培养基,置于37℃、5%CO2细胞培养箱常规培养,贴壁生长,长至80%~90%,用0.25%胰酶消化,传代或点板进行后续试验。
3.RT-PCR检测:将细胞(1×105个/毫升)接种于24孔细胞培养板,根据实验转染后,加入0.5ml TRIzol(中国诺唯赞公司)提取总RNA,根据试剂盒的说明,使用NanoDrop 2000 Spectrophotometer(美国赛默飞公司)检测总RNA的纯度和浓度,使用PrimeScriptTMRT试剂盒和gDNA Eraser(日本宝日医生物技术有限公司)将RNA(1μg)反转录为cDNA,RT-PCR使用FastStart Universal Probe Master(ROX)(中国诺唯赞公司)定量且根据制造商的要求使用CFX ConnectTMReal-Time系统(美国BioRad Laboratories公司)分析。采用两步法扩增检测MMP14及GAPDH的基因水平,RT-PCR引物序列详见表1。
4.质粒转染与细胞转染:根据MMP14基因序列及Blast同源搜索,设计引物序列,具体序列详见表1。使用AgeⅠ(ACCGGT)和EcoRⅠ(GAATTC)限制性酶切位点将50ng MMP14-shRNA导入pLKO.1-puro载体(美国Sigma公司),使用互补配对引物序列作为阴性对照(NC-shRNA)。使用Lipofectamine 2000(美国赛默飞公司)通过腺病毒将重组质粒(MMP14-shRNA和NC-shRNA)转入细胞,转染成功的细胞用于后续试验。

表1 引物序列表
5.细胞活力检测:采用MTT试验,取对数期生长的SGC-7901细胞,用0.25%胰酶消化制成单细胞悬浮液,稀释细胞数至1×104个/毫升,接种于96孔板,100微升/孔,分为NC-shRNA组、MMP14-shRNA组,每组5个时间点,共计10个组,待细胞贴壁稳定后,按上述质粒转染方法转染细胞,加入MTT液,使用酶标仪检测吸光度。
6.细胞凋亡检测:采用流式细胞分析检测,取对数期生长的SGC-7901细胞,用0.25%胰酶消化制成单细胞悬浮液,稀释细胞数至1×104个/微升,接种于96孔板,100微升/孔,待细胞贴壁稳定后,按上述质粒转染方法转染细胞,按时间点收集悬浮细胞,加Amiexin-Ⅴ-FITC/PI标记后上流式细胞仪检测细胞凋亡率。
7.细胞黏附检测:收集不同组处理的单细胞悬浮液,稀释细胞浓度至1×105个/毫升,接种至matrigel预处理的96孔板,100微升/孔,培养适当的时间后,吸掉未黏附的细胞,PBS洗涤2~3次,按剩余的贴壁细胞为黏附细胞计数,求平均值,计算细胞黏附率,细胞黏附率(%)=黏附细胞数/总细胞数×100%。
8.细胞侵袭检测:8μm的聚碳酸多孔滤膜将Transwell小室分为上下两室,在上室铺满Matrigel,于37℃风干,将收集到的不同组处理的单细胞悬浮液稀释至1×106个/毫升,下室中加入完全细胞培养基600μl,上室中加入100μl细胞悬浮液,常规培养,用结晶紫染色下室的细胞,显微观察,以平均数计算细胞的侵袭能力。
9.细胞迁移检测:方法同细胞侵袭试验,差异在于迁移试验的Transwell的多孔滤膜未铺Matrigel,其余步骤和上述侵袭试验相同,显微观察,计算细胞的迁移能力。
10.蛋白印迹(Western blot)法:使用蛋白印迹检测VEGF、E-cadherin、Vimentin、c-Myc、cyclinD1、AXIN2、β-catenin的蛋白表达。根据制造商说明操作提取细胞和组织蛋白,采用BCA法(中国碧云天公司)对蛋白进行定量,接着加入上样缓冲液,在100℃煮沸15min,然后利用10%的SDS-PAGE电泳,电泳程序:80V 30min;120V 60min。随后采用100V 90min将聚丙烯酰胺中的蛋白质转移至聚偏佛乙烯(PVDF)膜(美国Millipore公司),用5%的BSA封闭60min,TBST洗涤5分钟/次,5次,用适当浓度的一抗(VEGF、E-cadherin、Vimentin、c-Myc、cyclinD1、AXIN2、β-catenin,按1∶1000稀释)4℃孵育过夜,接着TBST洗涤5分钟/次,5次,二抗(HRP标记山羊抗兔IG,按1∶10000稀释)孵育,TBST洗涤5分钟/次,5次,加化学发光底物进行显影检测。
11.荷瘤裸鼠模型:所有动物实验均通过医学伦理学委员会的批准,裸鼠右侧背部皮下注射NC-shRNA或MMP14-shRNA转染的SGC-7901细胞,每只裸鼠皮下注射5 × 105个细胞。待背部皮下出现颗粒大小的硬结节,即认为造模成功。从第7天开始,每3天测量一次肿瘤体积(TV)。用游标卡尺测量肿瘤的最大直径(A)和最小直径(B),按公式TV=0.5×A×B2计算。于末次给药后24h,脱颈椎处死,分离肿瘤并称重。

结 果
1.胃癌细胞中MMP14的表达及其敲低对胃癌细胞活力和凋亡的影响:采用RT-PCR检测胃癌细胞和正常细胞MMP14基因表达,与GSE-1细胞比较,胃癌细胞SGC-7901、BGC-823、MKN45细胞的MMP14表达显著升高(图1A),以SGC-7901细胞尤为显著,因此接下来使用SGC-7901细胞进行后续研究。采用质粒转染试验下调MMP14的基因表达,与NC-shRNA比较,MMP14-shRNA转染能够显著下调MMP14的基因表达(图1B)。与NC-shRNA比较,MMP14-shRNA转染显著降低细胞的活力(图1C),同时促进胃癌细胞的凋亡(图1D)。
2.MMP14敲低对胃癌细胞黏附、侵袭、迁移的影响:用NC-shRNA和MMP14-shRNA转染细胞不同的时间,与NC-shRNA比较,MMP14-shRNA转染显著降低SGC-7901细胞的黏附率(图2A),抑制细胞的侵袭和迁移能力(图2B、C)。
3.MMP14敲低对VEGF、E-cadherin、Vimentin蛋白表达的影响:用NC-shRNA和MMP14-shRNA转染细胞,蛋白印迹检测相关蛋白的表达水平,与NC-shRNA比较,MMP14-shRNA转染显著上调E-cadherin的蛋白表达,下调Vimentin和VEGF的蛋白表达,详见图3。

图1 胃癌细胞中MMP14的表达及其敲低对胃癌细胞活力和凋亡的影响A.MMP14的表达;B.MMP14敲低;C.细胞活力;D.细胞凋亡
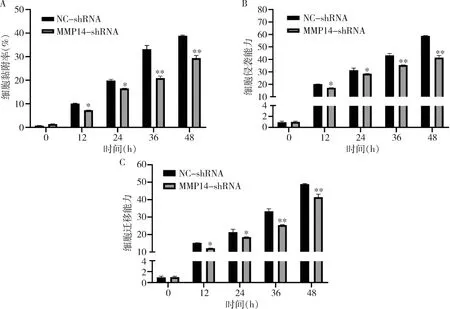
图2 MMP14敲低对胃癌细胞黏附、侵袭和迁移的影响A.黏附能力;B.侵袭能力;C.迁移能力;与NC-shRNA比较,*P<0.05,**P<0.01
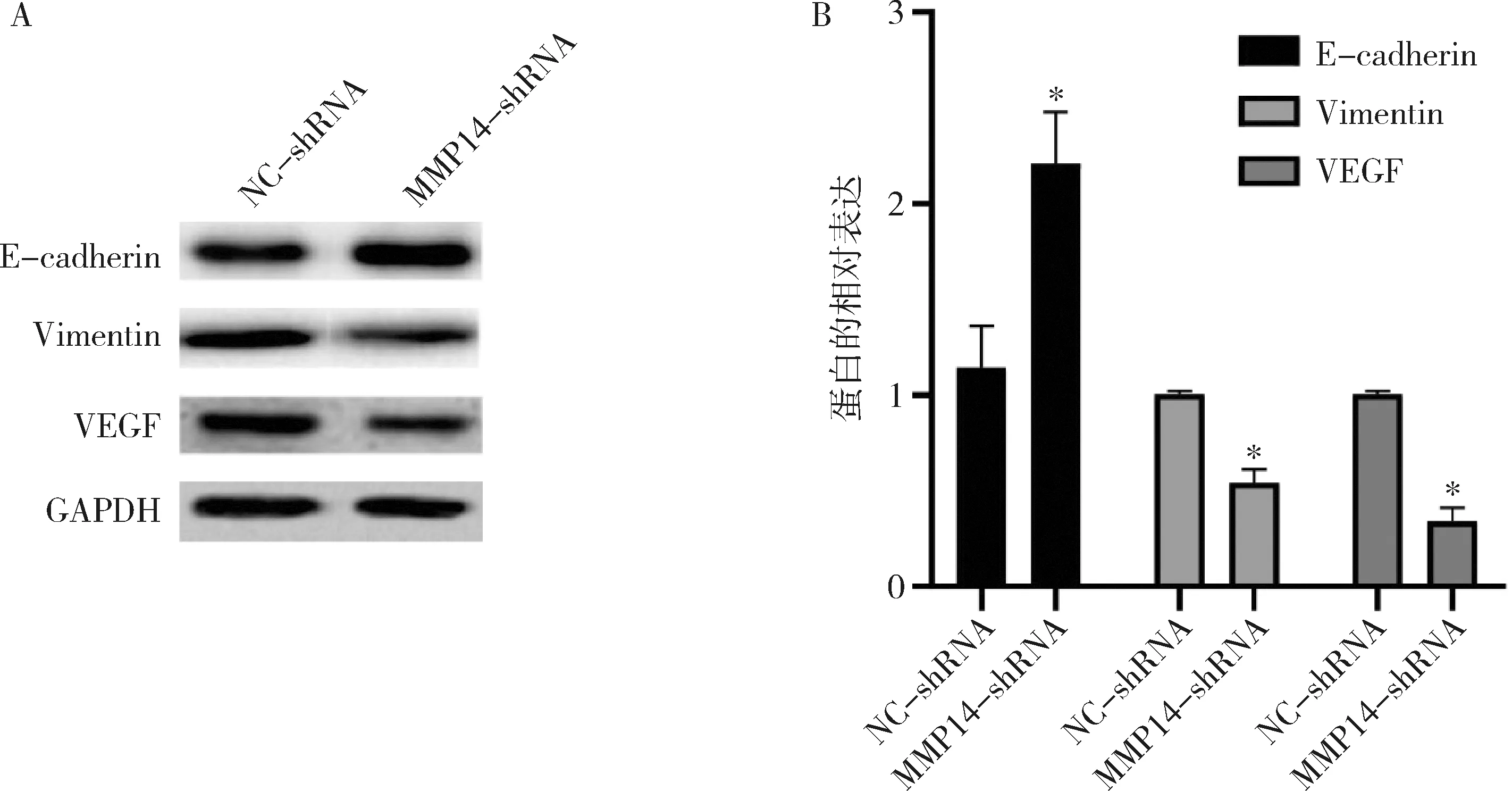
图3 MMP14敲低对VEGF、E-cadherin、Vimentin蛋白表达的影响与NC-shRNA比较,*P<0.01
4.MMP14敲低对Wnt/β-catenin信号蛋白的影响:用NC-shRNA和MMP14-shRNA转染细胞,蛋白印迹检测Wnt/β-catenin信号相关蛋白的表达,与NC-shRNA比较,MMP14-shRNA转染能够显著下调c-Myc、cyclinD1、AXIN2、β-catenin的蛋白表达(P<0.01),详见图4。

图4 MMP14敲低对Wnt/β-catenin信号蛋白的影响与NC-shRNA比较,*P<0.01
5.体内MMP14敲低对胃癌发生、发展的影响:将NC-shRNA和MMP14-shRNA转染后的胃癌细胞接种于裸鼠体内建立荷瘤裸鼠模型,结果表明MMP14-shRNA组肿瘤的体积和重量均显著下调,同时c-Myc、cyclinD1、AXIN2、β-catenin和VEGF的蛋白表达显著下调,详见图5。

图5 MMP14敲低对体内肿瘤发生、发展作用的影响A.肿瘤体积;B.肿瘤重量;C、D.信号蛋白表达;与NC-shRNA比较,*P<0.05
讨 论
胃癌起源于胃黏膜上皮的恶性肿瘤,是最常见的恶性肿瘤之一。在胃癌患者中影响生存和预后的重要因素是肿瘤的侵袭和转移。基质金属蛋白酶(MMPs)是一种能够降解细胞外基质的重要酶类,其几乎能够降解细胞外基质的所有成分,通过破坏基质的降解平衡促进肿瘤细胞突破基膜和细胞外基质构成的屏障,从而使肿瘤细胞易于发生侵袭和转移。
基质金属蛋白酶-14(MMP14),又称MT1-MMP,属于基质金属蛋白酶(MMP)家族,主要与肿瘤细胞的转移和侵袭有关[7,8]。研究表明MMP14表达于多种肿瘤组织,包括结肠癌和乳腺癌等,同时MMP14也高表达于胃癌组织[9~11]。但是MMP14在胃癌中的研究较少,因此本研究首先采用体外细胞实验表明MMP14高表达于胃癌细胞。接下来采用质粒转染下调MMP14的基因表达探索其对于胃癌发生、发展的体内外作用及相关分子机制。
MMP14在肿瘤细胞的增殖、迁移和侵袭过程中具有重要的影响,研究表明MMP14能够促进乳腺癌细胞的增殖和血管生成,除此之外,MMP14过表达能够增加食管鳞状细胞癌的迁移能力[12]。本研究体外细胞实验表明MMP14敲低能够直接抑制胃癌SGC-7901细胞增殖,并且诱导细胞凋亡。除此之外,细胞黏附、侵袭和迁移能力也是肿瘤细胞的重要生物学特征,本研究表明MMP14敲低能够显著抑制胃癌细胞的黏附、侵袭和迁移能力,上述表明MMP14对胃癌细胞的生物学活性具有重要的调节作用,因此接下来探索了MMP14调节胃癌细胞生物学特征的相关分子机制。
上皮-间质转化(EMT)与不同类型的癌症相关,包括胃癌、食管癌和肝癌等,EMT在肿瘤细胞的增殖、迁移和侵袭等过程中具有重要的调节作用[13,14]。EMT相关的蛋白分子主要包括VEGF、E-cadherin、Vimentin等相关分子, MMP14能够通过调节EMT相关的蛋白分子参与黑色素瘤和非小细胞肺癌的EMT过程[9,15,16]。本研究表明MMP14敲低能够影响EMT相关蛋白分子包括E-cadherin、Vimentin和VEGF的蛋白表达。上述表明MMP14可能通过调节肿瘤发展的EMT过程影响胃癌细胞的增殖、迁移和侵袭等生物学活性。
Wnt/β-catenin信号通路与肿瘤发展的EMT过程密切相关,并且Wnt/β-catenin在胃癌的病理发展过程中具有重要的影响[17,18]。β-catenin是Wnt/β-catenin信号通路的关键蛋白,c-Myc、cyclinD1和AXIN2是Wnt/β-catenin信号通路的下游靶点[19,20]。因此,接下来本研究主要集中于Wnt/β-catenin信号通路探讨MMP14影响胃癌发生、发展的相关分子机制。本研究表明MMP14敲低能够下调β-catenin蛋白的活化,并且抑制下游蛋白的表达。接下来,进一步评价了MMP14在体内对于胃癌发生、发展的影响。将转染后的SGC-7901胃癌细胞接种于裸鼠建立了体内荷瘤裸鼠模型,结果表明MMP14敲低在体内也能够显著抑制肿瘤细胞的生长,下调Wnt/β-catenin信号通路的活化及影响EMT相关蛋白的表达。上述体内外结果表明,MMP14敲低可能通过调节Wnt/β-catenin信号通路影响胃癌细胞的EMT过程,进而影响胃癌的发生和发展。
综上所述,本研究表明MMP14可能通过调节Wnt/β-catenin信号通路活化影响胃癌的发生、发展,其是一种潜在的胃癌治疗靶点,为胃癌药物的开发提供一定的线索。然而,需要更多的实验数据提供更多的证据,以进一步探索MMP14在胃癌发生、发展中的相关分子机制。

