结构域B在鼠冠状病毒S蛋白的抗原性及膜融合中的作用
徐娅佳,王玉燕,叶荣
复旦大学上海医学院基础医学院病原生物学系,教育部、卫健委、医科院医学分子病毒学重点实验室,上海 200032
冠状病毒(coronaviruses,CoV)是一类有包膜的正链RNA病毒,主要导致动物消化道和呼吸道疾病。曾经只有2种冠状病毒可引起人类普通呼吸道感染[1],然而,近20年来,新现冠状病毒已2次引起严重呼吸道综合征的世界性流行[2]。2019年12月,一种导致武汉传染性肺炎暴发的新型冠状病毒(2019 novel coronavirus,2019-nCoV),与2003年在我国首先暴发流行的严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)呈现不同的传播与致病性[3-4]。冠状病毒主要起源于野生动物,一些动物尤其是蝙蝠,成为冠状病毒的主要宿主和传播媒介[5]。冠状病毒表面的棘突(spike, S)蛋白与病毒宿主变异密切相关,该跨膜糖蛋白为病毒进入宿主细胞所必需,具有结合受体和诱导膜融合的重要作用;同时也参与冠状病毒的致病作用,且为病毒诱导中和抗体的主要抗原[6]。
鼠肝炎病毒(mouse hepatitis virus, MHV)感染以小鼠为主的啮齿动物,主要引起消化系统和中枢神经系统疾病,也是最为广泛使用的乙型冠状病毒分子生物学和致病性研究的模式病毒。鼠冠状病毒(murine coronavirus)有多个分离株,不同毒株之间致病性存在差异,如MHV-3主要引起急性肝炎,MHV-JHM导致严重的中枢神经系统病变,而MHV-A59依赖不同感染途径可引起温和的肝损害或中枢神经系统病变[7]。致病性的差异与病毒蛋白及其引发小鼠产生的免疫应答有关,同时这些分离株的S蛋白在适应宿主细胞过程中发生变异[8]。与鼠冠状病毒的原型株MHV-4相比,MHV-3 S蛋白的氨基酸残基不同,而MHV-JHM和MHV-A59除了残基有变化外,在S1亚单位高变区(high variable region, HVR)还有多个残基的缺失[8]。
近年来,随着结构生物学的进步,对多种冠状病毒S蛋白的膜融合机制、受体结合及抗体中和作用有了更深入的了解[9-11]。鼠冠状病毒S蛋白属于Ⅰ型膜融合蛋白,受体结合结构域(receptor binding domain,RBD)位于S1亚单位,膜融合核心元件位于S2亚单位[12-13]。大部分冠状病毒的RBD位于S1的C端结构域(C-terminal domain, CTD),即结构域B,而鼠冠状病毒的RBD位于S1的N端结构域(N-terminal domain, NTD),即结构域A[14-15]。
本研究以pCAGGS为载体,构建了不同缺失的S基因突变体,并在鼠神经母细胞瘤细胞系Neuro-2a成功表达;以不同方法处理的病毒颗粒作为抗原免疫小鼠,获得了多种多克隆抗体,由此分析结构域B对病毒感染及S蛋白导致的膜融合产生的影响。结果显示,结构域B的部分缺失与S2缺失同样严重损害S蛋白的细胞-细胞间膜融合,且结构域B是S蛋白的主要抗原决定簇,诱导的抗体具有明显的中和病毒感染及抑制S蛋白诱导膜融合的作用。
1 材料与方法
1.1 细胞和病毒
小鼠脑神经母细胞瘤细胞系Neuro-2a购于中国科学院上海生命科学研究院细胞资源中心。小鼠肺上皮样细胞系L2和鼠冠状病毒MHV-A59由美国纽约州立卫生署Masters教授惠赠。
1.2 细胞培养与病毒感染
2种细胞用含10%胎牛血清( fetal calf serum, FBS)(Gibco)的DMEM培养基(HyClone)放置37 ℃、5% CO2培养箱(MITRE 4000,CONTHEM公司)中培养。细胞传代用稀释的0.25%胰酶消化,按1∶3~5面积比分瓶(T25或T75)或铺碟(D60),间隔48~72 h。病毒感染细胞培养36~48 h至聚合度为60%~80%,吸去培养基,加入调整至1×105pfu/mL病毒悬液1.0 mL (D60或T25),细胞培养箱中孵育1~2 h后吸去病毒液,加新鲜完全培养基于37 ℃、5% CO2培养箱中继续培养。
1.3 质粒构建与细胞转染
含MHV-A59的野生型S基因质粒(pCAGGs-SA59)由美国宾州大学医学院Weiss教授惠赠。缺失突变体(图1和图3),按常规分子生物学方法,用限制性内切酶消化和聚合酶链反应(polymerase chain reaction, PCR)回补构建,连接产物转化感受态TOP10F′(天根生物),目的克隆用PCR筛选并测序鉴定。引物合成和测序由上海生工生物工程有限公司完成,PCR试剂盒购自ThermoFisher公司。
用于转染细胞的质粒通过中抽获得(Qiagen)。Neuro-2a细胞铺6孔板,37 ℃、5% CO2培养箱中培养36~48 h至细胞聚合度70%左右,吸去培养液,加入1.8 ml Opti-MEM(Gibco)继续培养2 h。取2.5~3 μg质粒至100 μL Opti-MEM,另取5~10 μL脂质体lipofectamin 2000(Invitrogen)至100 μL Opti-MEM,轻轻将两者混合并室温静置5 min,滴加至6孔板中。细胞板置37 ℃ 、5% CO2培养箱培养6h,更换为DMEM完全培养基,继续培养24~72 h,并定时观察、拍照和收集样品。
1.4 病毒颗粒纯化与灭活
鼠冠状病毒颗粒纯化采用2次PEG沉淀[16],操作均在4 ℃无菌条件下进行。取高滴度病毒贮存液(1×107~5×107pfu/mL)1 mL,感染T25 培养的Neuro-2a细胞1 h,加完全培养基4 mL后继续培养48 h至细胞病变(cytopathic effect,CPE)≥80%,收集5 mL培养上清液,离心除去细胞碎片,立即感染T75 培养的Neuro-2a细胞1 h,加无血清培养基20 mL,培养48 h后收集上清液。 合并的含病毒培养上清液通过 3 500 rpm离心15 min(Beckman Allegra X-12R,下同),除去细胞碎片,收集上清液至无菌玻璃瓶,放置磁力搅拌器上,缓慢滴加1/3体积的0.85% NaCl配制的30% PEG8000(生工),继续搅拌2 h。8 000 rpm离心20 min,沉淀物用1/20体积的0.85% NaCl溶解,再次用PEG沉淀,溶于1/10体积的磷酸盐缓冲液(phosphate buffer saline,PBS)中,分装每管100 μL,保存于 -80 ℃冰箱备用。使用前取出至冰上融化,分别进行灭活处理﹝紫外线照射10 min(CX-2000型UVP紫外交联仪:距离25 cm、强度 7 500 uw/cm2)[17];56 ℃水浴25 min;加入1/20体积的10%SDS(生工),置37 ℃水浴15 min﹞,见图2。
1.5 小鼠抗体制备
灭活和未灭活的病毒样品用4倍体积的PBS稀释,加等体积弗氏佐剂(Sigma)并用注射器反复抽吸使之乳化,然后腹腔注射免疫BALB/c SPF级小鼠(上海斯莱克公司)。第14天和第21天以相同的剂量病毒和途径加强免疫,并于第18天和第24天每组选择1只小鼠,眼眶后眦静脉采血并分离血清,以热灭活病毒样品为抗原,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)测定抗体效价。效价达标后,次日静脉注射1/4剂量的无佐剂病毒样品进行一次冲击免疫。3d后眼球放血,分离血清,分装后加等量80%甘油,保存于 -80 ℃冰箱备用。
1.6 蛋白印迹试验
Bio-rad Mini蛋白电泳装置按说明书组装,取30%(29.2∶0.8)丙烯酰胺储存液(生工),分别配制10%~12%分离胶和5%浓缩胶,内槽加Tris-Gly缓冲液。转染或感染后的细胞(T25或D60)用5~8 mL冰冷PBS洗涤2次,加500 μL IPP缓冲液(Bio-rad)裂解5 min,离心收集上清液,加等量2×SDS-PAGE样品缓冲液,95 ℃ 5 min变性处理,冷却后离心取上清液,上样8~16 μL/孔。外槽加Tris-Gly缓冲液,80 V恒压电泳,待样品进入分离胶后再行120 V恒压电泳,直至溴酚蓝到达分离胶底部。取出凝胶,用去离子水洗2次,浸泡于转移缓冲液中,与聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜制备转膜夹心,低温500 mA恒流转移2 h。转印膜用5%脱脂奶粉PBS室温封闭30 min,再与5%脱脂奶粉PBS加Tween-20稀释的抗体于4 ℃孵育过夜,然后加辣根过氧化物酶标记二抗,置室温孵育2 h,充分洗涤后再用发光底物显影并拍照(Tenon 4600)。
1.7 病毒中和实验
抗体及对照血清用完全培养基梯度稀释后置96孔细胞板中,每孔50 μL,重复3~5孔。病毒用完全培养基稀释至2×105pfu/mL,取50 μL加至稀释好的抗体孔中,37 ℃中孵育30 min。然后转移至聚合度达80%的单层小鼠L2细胞(提前24~36 h铺在96孔细胞板)上,5% CO2、37 ℃中培养1 h后吸去混合液,加入200 μL 完全培养基,继续培养8 h。观察CPE并收集上清液和细胞裂解液用于病毒噬斑实验和蛋白印迹试验。抗体抑制转染细胞膜融合试验如下:转染小鼠Neuro-2a细胞6h后直接将梯度稀释的抗体加至其培养基中,置37 ℃、5% CO2中继续培养24~72 h,并定时观察CPE和拍照,收集样品。
1.8 病毒噬斑实验
小鼠L2细胞铺至D60中,培养36~48 h,使其达80%~90%聚合度后备用。将病毒上清液用含2%血清的DMEM按10倍系列稀释,取1 mL合适稀释度病毒加至已吸去培养基的L2细胞。置37 ℃中感染1 h后吸去病毒液,加入7 mL 55 ℃温育的琼脂细胞培养液(0.95%琼脂/5% FBS/DMEM),室温凝固后转移至37 ℃、 5%CO2中继续培养40 h,取出覆盖3 mL 55 ℃温育的含0.05%中性红的琼脂细胞培养液,继续在37 ℃、5%CO2中培养6~8 h,计数噬斑数量并剔去琼脂后拍照,然后测定病毒滴度。
2 结果
2.1 结构域B缺失使鼠冠状病毒S蛋白不能诱导细胞-细胞间膜融合
鼠冠状病毒MHV-A59 S蛋白包含 1 324 个氨基酸残基,是典型的Ⅰ型膜蛋白,包括N端信号肽、C端跨膜区(TM)和胞内区(图1B)。其中间R717被蛋白酶切割为2个亚单位S1和S2,S1亚基分为结构域A(S1-NTD)、结构域 B(S1-CTD)、结构域C和结构域 D;S2膜外区包括多种α-螺旋结构,如上游螺旋(UH)、融合肽(FP)、七联子重复1(HR1)和2(HR2)及中央螺旋(CH)[9](图1B)。另外,根据SARS-CoV S蛋白推测,在S2′位点切割,除去UH使FP暴露,这对MHV-A59 S蛋白完成膜融合作用也非常重要[18]。
MHV-A59野生型S蛋白插入真核表达载体pCAGGS(图1A)转染小鼠Neuro-2a细胞能导致膜融合产生明显的CPE(图1C)。与预期的一样,当S2亚单位N端(727~1 052 位氨基酸)部分缺失﹝包括UH、FP、HR1和CH(ΔS2)﹞时(图1B),转染的细胞不发生膜融合,与空载体(pC)转染的细胞一样,无CPE产生(图1C)。令人意外的是S1结构域B中间207个氨基酸残基(376~583位氨基酸)缺失(ΔB)时(图1B),转染细胞也失去膜融合功能(图1C)。鼠冠状病毒S蛋白结构域B与S1-CTD重合,包含HVR、MHV-A59 S蛋白,此区域比MHV-4(JHM-SD)缺失了52个氨基酸[8],可能与鼠冠状病毒的组织特异性致病作用及同次要的多糖受体结合相关。

A:The main components of eukaryotic expression vector pCAGGS. B:The domains and the deleted region of murine coronavirus S gene constructed in plasmid pCAGGS. C:Cytopathic effects (CPE) of mouse Neuro-2a cells transfected with empty vector pCAGGS (pC), S2 N-terminal region-deleted mutant (ΔS2), domain B central region-deleted mutant (ΔB) and wild-type (S) S protein. CPE was observed and microphotographed at 24h post transfection with 250x magnification.
图1 结构域B缺失对鼠冠状病毒S蛋白导致的细胞-细胞间膜融合的影响
Fig.1 Domain B deletion impaired the cell-cell membrane fusion induced by murine coronavirus S protein
2.2 不同灭活处理的鼠冠状病毒均诱导产生识别S蛋白结构域B的抗体
为了研究鼠冠状病毒S蛋白的抗原性,我们用紫外线照射(Uv)、加热(Ht)和去污剂(Dt)杀毒3种方法处理MHV-A59病毒颗粒,并以室温放置不作处理(No)的病毒颗粒作为对照。与弗氏佐剂混合后免疫BALB/c小鼠,制备相应的多克隆抗体(图2A)。ELISA显示,3种方法处理的病毒均能有效诱导小鼠产生抗体,平均效价≥2×105;未灭活处理的病毒颗粒腹腔注射后导致绝大部分小鼠感染而死亡,唯一存活小鼠的抗体效价为1×105(图2A)。
用4种抗体分别与鼠冠状病毒感染的细胞裂解液进行蛋白印迹试验,发现未处理的病毒颗粒诱导的抗体(No-Ab)针对完整S蛋白有较强的反应;SDS处理的病毒颗粒诱导的抗体(Dt-Ab)针对完整S蛋白和裂解的S1/S2亚单位均有较强的反应(图2B);紫外线照射处理的病毒颗粒诱导的抗体(Uv-Ab)针对完整S蛋白和裂解的S1/S2亚单位均有较弱的反应;而加热处理的病毒颗粒诱导的抗体(Ht-Ab)针对完整S蛋白和裂解的S1/S2亚单位均有反应(图2B)。但是,4种抗体对质粒转染表达S蛋白及其缺失突变体的细胞裂解液蛋白印迹试验反应与对病毒感染细胞裂解液的反应不一致,对野生型S蛋白反应No-Ab和Uv-Ab较弱,Ht-Ab和Dt-Ab较强;对S2 N端缺失突变体(ΔS2)Ht-Ab反应最强,而Uv-Ab、Dt-Ab依次减弱,No-Ab最弱;对结构域B缺失突变体(ΔB)几乎都没有反应(图2B)。这些反应的差异性可能与病毒表达的S蛋白和质粒表达的蛋白在翻译后修饰(如糖基化)存在差异有关,同时说明大部分抗体是针对S1亚单位,S2则呈现较弱的抗原性。

A:Four treatments to murine coronavirus as antigens for the production of murine antisera to S protein. B:Reactivity of four murine antisera to S protein in lysates of Neuro-2a cells infected with wild type murine coronavirus MHV-A59. C:Reactivity of four murine antisera to partial deleted and wild type S proteins in lysates of Neuro-2a cells transfected with vector pCAGGS (pC), S2 N-terminal region-deleted mutant (ΔS2), domain B central region-deleted mutant (ΔB) and wild-type (S) S protein respectively.
图2 结构域B是鼠冠状病毒S蛋白的稳定抗原决定簇
Fig.2 Domain B is a stable antigenic determinant of murine coronavirus S protein
2.3 结构域B为鼠冠状病毒S蛋白的优势抗原决定簇
为进一步确认结构域B与抗体的反应性,我们进一步构建了3个新的S蛋白突变体(图3A)。突变体RBD仅含MHV-A59 S蛋白N端,包括信号肽在内的1~326位氨基酸(即完整的S1-NTD),其余序列均缺失;突变体ΔA1和ΔA2缺失了结构域A,即S1-NTD的C端部分及S2 N端的大部分序列,两者的区别在于ΔA2除有完整的结构域B外,还保留了与结构域B的连接序列、完整序列的结构域C和D及S1/S2切割位点(图3A)。选择与S2 N端缺失突变体(ΔS2)反应最为强烈的Ht-Ab进行蛋白印迹试验,结果显示,Ht-Ab抗体不与RBD反应,但与缺失突变体ΔA1和ΔA2反应,与ΔB和ΔS2反应与图2C基本一致(图3A)。加热处理的病毒颗粒诱导的抗体(Ht-Ab)能与全长S蛋白及其含结构域B的突变体产生特异性反应,提示S1-CTD是S蛋白稳定的优势抗原决定簇。
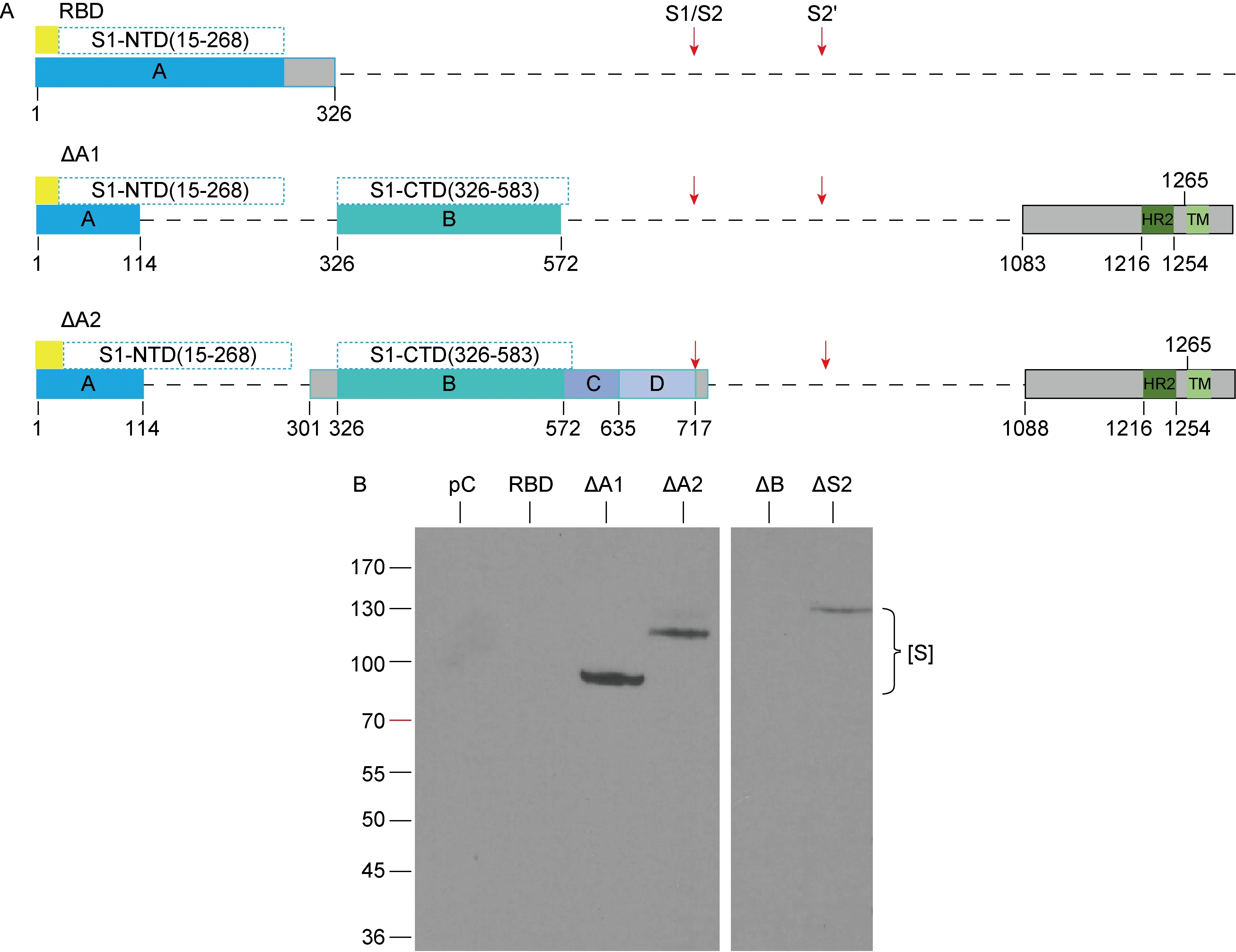
A:Three deleted mutants of murine coronavirus S gene constructed in eukaryotic expression vector pCAGGS: receptor binding domain mutant (RBD), domain A C D plus S2 N-terminal region-deleted mutant (ΔA1) and domain A plus S2 N-terminal region-deleted mutant (ΔA2). B:Reactivity of Ht antisera to most partially deleted S proteins in lysates of Neuro-2a cells transfected with three heavy deletion mutants (RBD, ΔA1 and ΔA2) and two control deletion mutants (ΔB and ΔS2, Fig 1B).
图3 鼠冠状病毒诱导的抗体特异性识别S蛋白B结构域
Fig.3 Antibodies induced by heat-inactivated murine coronavirus (Ht) recognizes S domain B specifically
2.4 抗体对鼠冠状病毒复制的抑制和S蛋白诱导的细胞-细胞间膜融合
前面结果显示,鼠冠状病毒颗粒诱导的S蛋白抗体主要是针对结构域B而不是受体结合域(图2、3)。为了分析这些抗体的中和作用,将不同稀释度的Ht-Ab与2×105MHV-A59在37 ℃孵育30 min,然后感染小鼠L2细胞,同时用小鼠正常血清作为对照。对感染8 h后收集细胞培养上清液进行噬斑试验以检测病毒复制水平。收集细胞裂解液,检测病毒核衣壳蛋白(nucleocapsid protein,N蛋白)的表达水平。结果显示,当抗体稀释度为1∶100和1∶500时能完全抑制病毒感染L2细胞(1.0 MOI),而相同稀释倍数的正常小鼠血清(对照样本)不能抑制病毒感染;当抗体稀释度为1∶2 000 时仍能抑制大部分病毒的复制(图4A、B)。
同样,Ht-Ab对S蛋白介导小鼠细胞膜融合也有明显的抑制作用。按脂质体常规方法,将质粒转染鼠Neuro-2细胞6 h后用含Ht-Ab的完全培养基(1∶500)替换,同时加等量正常小鼠血清作为对照,继续培养24 h,观察CPE。结果显示,未加抗体的转染细胞发生明显的细胞融合,形成多核巨细胞(syncytia)病变,而加抗体培养的细胞与未转染的细胞一样,无CPE发生(图4C)。这些结果说明,针对结构域B的抗体不但能抑制鼠冠状病毒感染同源细胞,也能特异性抑制S蛋白诱导的细胞-细胞间膜融合。

A:N protein expression in lysates of Neuro-2a cells infected by murine coronavirus which is incubated with normal mouse serum or antiseum (Ht-Ab). B:Plaque assay of supernants of Neuro-2a cells infected by murine coronavirus which is incubated with normal mouse serum or antiseum (Ht-Ab). C:Cytopathic effects (CPE) of Neuro-2a cells transfected wild-type S gene and cultured in media containing normal mouse serum or antiseum (Ht-Ab). CPE was observed and microphotographed at 24 h with 250x magnification.
图4 鼠冠状病毒S蛋白B结构域的抗体能抑制病毒复制和细胞-细胞间膜融合
Fig.4 Antibody to murine coronavirus S protein domain B inhibits viral replication and the cell-cell membrane fusion
3 讨论
Ⅰ型膜融合蛋白前体通常被蛋白酶切割为2个亚单位,并形成十分紧凑的三聚体,3个N端亚单位形成冠状结构,将3个C端亚单位包埋于内部。病毒进入细胞时,N端亚单位首先与细胞表面的受体特异性结合,使病毒与细胞靠近,变构后暴露的C端亚单位融合肽插入细胞膜,然后HR1和HR2形成双螺旋折叠,使脂质膜完全融合[19]。鼠冠状病毒的S蛋白最早被证明属于Ⅰ型膜融合蛋白,其S2融合核心结构很快得到解析[12-13]。鼠冠状病毒S蛋白也能导致非受体依赖的细胞-细胞间膜融合,但需要包括RBD在内的S1亚单位特定氨基酸残基参与[20-21]。鼠冠状病毒S1亚单位含结构域A、B、C和D,其中结构域A和B与受体结合相关的功能域S1-NTD和S1-CTD重叠[9](图1)。冷冻电子显微镜显示,MHV-A59 S蛋白胞外区三聚体与S1亚基呈“V”形结构,结构域B比结构域A呈现更突出的位置[9]。不管是S2融合核心区域缺失,还是结构域B缺失,S蛋白导致的细胞-细胞间膜融合都会受损(图1),同时这2种缺失突变也导致S蛋白不能被切割成独立的亚单位(图2、3)。说明S1和S2的完整结构对其膜融合功能均很重要,也提示S蛋白切割可能发生在膜结合空间结构形成甚至膜融合发生过程中。
大部分冠状病毒S1-NTD结合糖类受体,S1-CTD结合蛋白类受体,但鼠冠状病毒则通过S1-NTD识别蛋白质受体mCEACAM1a[22]。甲型冠状病毒1群S蛋白可结合同源宿主动物受体蛋白APN,其RBD位于S1-CTD,而S1-NTD则与唾液酸结合[23];乙型牛冠状病毒S蛋白的RBD还含有类lectin结构域[24]。人冠状病毒HCoV-N63和SARS-CoV的RBD位于S1-CTD 结合受体ACE2[25-26]。最近出现的2019-nCoV也能结合ACE2,但位点略有不同,而且识别SARS-CoV S蛋白的抗体也能中和两者的结合[27-28]。因此,S蛋白结合主要蛋白受体时,结合细胞表面多糖是冠状病毒感染的重要因素[14]。早期对鼠冠状病毒不同型别致病性的研究发现,位于结构域B高变区的氨基酸突变和缺失是其对肝组织和神经系统致病性产生差异的重要原因[7-8]。因此,这一区域的人工缺失导致S蛋白与多糖或蛋白辅助受体结合的潜在能力受损,可能是导致细胞-细胞间膜融合能力丢失原因(图1)。
实验中把2次PEG沉淀纯化的鼠冠状病毒颗粒直接腹腔注射小鼠,出现75%以上的致死率;而用紫外线照射、加热灭活及去污剂处理的样品注射则不发生死亡。PEG沉淀对病毒感染性影响较小,说明病毒颗粒仍保持较完整的结构,3种处理方式对病毒结构的破坏程度依次增加(图2A)。用这些病毒样品诱导小鼠产生抗体的反应性有明显的差异(图2B、C):①完整病毒诱导的抗体(No-Ab)主要针对病毒表达的S蛋白前体,而对质粒转染表达的S蛋白反应较弱;②用SDS处理的病毒样品诱导的抗体(Dt-Ab)对病毒表达S蛋白、质粒转染表达S蛋白前体及裂解S1/S2的反应均较强,而且也能很好地诱导针对N蛋白的抗体[16];③加热处理比紫外线照射诱导的抗体反应更强;④所有的抗体对S2缺失突变体(ΔS2)均有反应,而对结构域B缺失突变体(ΔB)均无反应或反应较弱(图2C,图3)。根据这些结果推测,一是天然病毒感染表达的S蛋白与用质粒转染细胞表达的S蛋白可能在翻译后的修饰上存在差异(如糖基化);二是结构域B具有明显的抗原优势,而S2的抗原性明显较弱,可能与S1-CTD的N糖基化位点有关[29]。
冠状病毒的中和抗体主要由S蛋白诱导,大部分集中在S1亚单位[30]。为了验证结构域B在病毒感染中的作用,选用能特异性识别结构域B的热灭活病毒颗粒诱导产生的抗体(图3)进行中和实验。结果发现,该抗体不但能抑制鼠冠状病毒感染鼠L2细胞,而且能抑制S基因转染的鼠Neuro-2a细胞发生细胞-细胞间膜融合,抗体效价在1×103以上(图4)。这一结果说明结构域B可能在病毒入胞、致CPE、颗粒装配及释放等步骤发挥重要作用。因此,在乙型冠状病毒包括最新出现的2019-nCoV中,非受体结合的结构域A是否具有类似的功能有待进一步的实验阐明。
综上所述,根据冷冻电子显微镜解析的MHV-A59 S蛋白三聚体膜外区结构信息,结构域B占据位于中间位置且突出(图5)。推测结构域B的位置和糖基化优势使其易于激活抗原呈递细胞而成为优势抗原决定簇。另外,结构域B发生缺失或者与抗体结合将导致S1亚单位的结构域A空间位置变化,从而影响其RBD与受体的结合;这种空间位置变化还可通过结构域C和D传递给两个切割位点(S1/S2和S2′)使切割效率下降或丧失(图5)。

A spatial hindrance is induced by deletion or antibody binding of domain B:Conformation change of S1 subunit would interfere the binding of domain A (RBD) to receptor mCEACAM1a, or/and S1 subunit production or fusion peptide exposure by covering S1/S2 or S2′ cleavage site. Domain B shields domain A to maintain the receptor binding function:In a stable S trimer structure of murine coronavirus domain B is protruded over other domains and make it possess a spatial priority being recognized by immune cells.
图5 结构域B影响鼠冠状病毒S蛋白作用的假说
Fig.5 A hypothesis for effects of S1 subunit domain B on the function of murine coronavirus S protein
- 微生物与感染的其它文章
- 新型冠状病毒基因组结构与蛋白功能

