子宫内膜癌合并输卵管癌原发性双癌病例分析
张晓欲,左金玲,李桂荣
(1.河北省唐山市妇幼保健院妇一科,河北 唐山 063000;2.河北省唐山市妇幼保健院产二科,河北 唐山 063000;3.河北省唐山市妇幼保健院妇科门诊,河北 唐山 063000)
子宫内膜癌作为三大妇科恶性肿瘤之一,较为常见。在西方国家,子宫内膜癌的年发病率为15/10万~20/10万,约占妇科恶性肿瘤的7%;在中国,子宫内膜癌每年新发病例15 900例,约占妇科恶性肿瘤的3%[1]。原发性输卵管癌是一种少见的妇科恶性肿瘤,其发病率仅占妇科恶性肿瘤的0.1%~1.8%[2]。子宫内膜癌合并输卵管癌原发性双癌较罕见,且术前诊断难度较大。本研究系统性回顾分析1例子宫内膜癌合并输卵管癌原发性双癌患者的病例资料,总结其术前诊断及治疗方法。
1 临 床 资 料
患者,女性,61岁,主因绝经14年,阴道不规则出血半月于2019年3月8日入院。患者14年前自然绝经,半个月前开始出现阴道少量出血,浅红色,呈点滴状,伴阴道排液,无异味,无腹痛等不适,未诊治。7 d前于我院就诊,行盆腔彩色超声提示:宫腔内低回声区,考虑子宫内膜病变,宫体左上方实性病变,肌瘤?宫内节育环。门诊行诊刮术,病理回报:低分化癌(宫内物)。患者既往13年前因乳腺癌行左乳切除术,术后口服药物(具体药名不详)预防复发治疗5年。生育史:孕3产1。家族史:父母均去世,其三兄长分别患“肺癌、胃癌、膀胱癌”去世。
入院查体:阴道检查示已婚经产型外阴,阴道畅,宫颈光滑,萎缩变小,子宫水平位,正常大小,质中,活动可,无压痛,左侧附件区增厚,无压痛,右侧附件区无压痛,未触及明显包块。完善相关化验检查:盆腔增强核磁提示①子宫腔内占位,考虑恶性;②左侧附件区囊实性占位,考虑卵巢癌;③盆腔两侧髂血管旁淋巴结,考虑转移;④子宫肌瘤;⑤盆腔少量积液。胸部及上腹部CT提示:①左乳缺如;②右肺上叶尖段混合磨玻璃密度影,性质待定,建议随诊明确诊断;③左肺上叶钙化灶;④左肺上叶尖后段局限性慢性炎症;⑤上腹部CT平扫+增强未见明显异常。肿瘤系列提示:CA125为54.4 kU/L,高于正常,其余均正常范围。
患者入院诊断子宫内膜癌,盆腔MRI提示左侧附件区囊实性占位,考虑卵巢癌可能,与患者及家属沟通后,同意行腹腔镜子宫内膜癌分期术,术中切除左侧附件送术中冰冻病理。术中见:子宫萎缩,外观饱满,左侧输卵管明显增粗增大(图1),可见实性肿物,大小约7 cm×6 cm×5 cm,包膜完整,左侧卵巢萎缩,外观正常。右侧附件外观正常。术中剖视子宫见:宫腔近宫底后壁异常增生病灶,大小约3 cm×3 cm,>1/2肌层。左侧附件快速病理提示:浆液性癌(左侧附件),输卵管原发,卵巢未见癌累及。腹腔冲洗液未查见癌细胞。术中行腹腔镜扩大子宫切除+双侧附件切除+盆腔淋巴结切除+大网膜活检术+腹膜多点活检术+粘连分解术,术后病理回报:①左侧附件浆液性癌(高级别),未累及左侧卵巢;②子宫内膜浆液性癌(高级别),浸润深度>子宫肌层的1/2,未累及宫颈管,见有脉管癌栓;③子宫多发性平滑肌瘤,子宫颈慢性炎症,宫颈管息肉;④右侧卵巢白体,输卵管慢性炎症,均未见癌转移;⑤大网膜、双侧结肠旁沟腹膜均未见癌转移;⑥盆腔左侧淋巴结1/4枚癌转移;盆腔右,淋巴结0/5枚癌转移。左侧附件免疫组织化学:雌激素受体(estrogen receptor,ER)(灶+),孕激素受体(progesterone receptor,PR)(-),P53(错义突变,80%+),P16(弥漫强+),WT1(+)。子宫内膜免疫组织化学:ER(+),PR(-),C-erbB-2(-),P53(错义突变,80%+),Ki67(70%+),WT1(+),P16(弥漫强+),胰岛素样生长因子ⅡmRNA结合蛋白3(IMP3)(弱+),肿瘤抑制基因(PTEN)(弱+)。
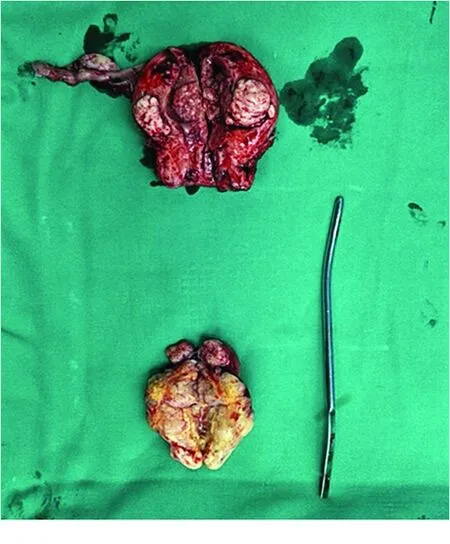
图1 子宫内膜癌及输卵巢管癌大体标本
2 讨 论
2.1子宫内膜癌 子宫内膜癌是一种较为常见的妇科恶性肿瘤,其发病率占女性生殖道恶性肿瘤的20%~30%。其常见于围绝经期或绝经后女性,平均发病年龄为60岁。其发病机制尚不明确,但将子宫内膜癌分为2型:Ⅰ型子宫内膜癌为雌激素依赖性疾病,Ⅱ型子宫内膜癌的发病机制尚不明确。大量研究表明,子宫内膜癌的高危因素[3]主要有肥胖、糖尿病史、高血压史(子宫内膜癌三联征)、口服避孕药、经产状况、不孕症、吸烟等。子宫内膜癌患者早期可无明显临床症状,有症状者主要的表现为异常子宫出血、绝经后阴道流血、阴道排液。<5%的子宫内膜癌患者没有明确的临床症状[4]。子宫内膜癌的病理类型包括内膜样癌(80%~90%),浆液性癌(1%~9%)、黏液性癌(5%)、透明细胞癌(<5%)、癌肉瘤(少见)。其诊断方法包括阴道超声、核磁共振成像和子宫内膜活检。根据最新版美国妇产科医师协会(American College of Obstetricians and Gynecologists,ACOG) 指南[5],绝经后出现异常子宫出血的患者,当内膜厚度≥4 mm时,则需行子宫内膜活检排除内膜病变。目前,子宫内膜活检已成为子宫内膜癌的首选诊断方法。而磁共振成像可术前评估子宫内膜癌分期,提高判断肿瘤扩散的准确率,最近研究表明弥散加权成像磁共振对子宫内膜癌深肌层浸润、宫颈间质侵犯、淋巴结转移诊断准确性分别为74%~98%、86%~88%、87%~94%[6-7]。子宫内膜癌的治疗以手术为主,手术的目的是病理分期,确定病变范围及预后相关因素,最大限度地切除肉眼可见病灶。标准术式为广泛子宫切除+双附件切除+盆腔淋巴结切除+腹主动脉旁淋巴结切除术。对于Ⅰ期、高中分化的子宫内膜样腺癌患者术式为全子宫切除术+双附件切除术。对于Ⅱ期患者术式为广泛性全子宫切除+双附件切除术+盆腔淋巴结切除术。术中均应留取腹腔冲洗液及子宫剖视。术后根据不同期别及病理分化程度,必要时辅以放疗、化疗及药物治疗。影响子宫内膜癌患者预后的高危因素有年龄>60岁、深肌层浸润、低分化、浆液性或者透明细胞癌、脉管浸润。中晚期子宫内膜癌(Ⅱ~Ⅳ期)患者,尤其是特殊病理类型(如浆液性腺癌、透明细胞癌) 的治疗效果及预后差,手术难度大,5年生存率仅为25%~30%。该病例患者术后病理提示病理类型为浆液性腺癌且有深肌层浸润,因此术后辅助化疗。
2.2原发性输卵管癌 原发性输卵管癌是一种少见的妇科恶性肿瘤[8],发病机制尚未明确,目前主要归于环境和基因[9]。有研究表明,长期激素替代[10]、慢性盆腔炎性疾病[11]、BRCA-1和 BRCA-2基因突变的携带者[12]均增加输卵管癌的发病风险。原发性输卵管癌的典型临床症状是不规则阴道流液、腹痛和腹部包块,但仅有15%的患者会出现三联征。由于其发病隐匿、缺乏典型的临床症状,输卵管癌的术前诊断比较困难。主要的影像学检查,包括超声及CT或MRI。超声常表现为附件区一侧或双侧探及腊肠状、梨形或长椭圆形肿物,内回声不均;CT主要表现为梭形、蛇形或腊肠形的附件区实质性或囊实性肿物,密度与软组织密度接近[13];在MRI上常表现为带有乳头状突起的囊实性复合物,在T1WI 上为低信号,在T2WI上则为均一的高信号。但是其影像需与输卵管积液、输卵管积脓及卵巢恶性肿瘤相鉴别。另外,CA125在80%以上的输卵管癌患者中呈高水平,且可评价输卵管癌的疾病发展及复发,但其特异性较差,不能用于早期诊断。输卵管癌的治疗主要为手术治疗,其主要治疗目的是最大程度地减灭肿瘤。手术范围包括子宫、双附件、大网膜、阑尾切除,腹腔冲洗脱落细胞检查,腹膜活检,盆腔及腹主动脉旁淋巴结的切除。术后辅助化疗在输卵管癌的治疗中也扮演了重要角色,以铂类为基础的联合化疗是在辅助治疗中最被推荐的[14]。
2.3原发双癌的诊断 原发性输卵管癌术前诊断较困难,易误诊为卵巢癌、卵巢肿瘤或输卵管妊娠,大多数为术中病理或术后病理发现。目前,原发性输卵管癌病理诊断标准为:①肿瘤来源于输卵管黏膜,镜下主要为输卵管黏膜受累并呈乳头状结构;②肿瘤组织学来源为输卵管黏膜上皮;③可见由良性至恶性的移行区;④卵巢和子宫内膜正常或类似于输卵管癌的病理学形态,但肿瘤体积必须小于输卵管肿瘤[15]。符合任意一条即可明确诊断。根据上述标准,该患者术中剖视子宫及输卵管,子宫内膜癌组织体积明显小于输卵管肿瘤体积,且术中冰冻病理诊断为:浆液性癌(左侧附件),输卵管原发。输卵管癌较少见,与子宫内膜癌同时出现时需鉴别双原发癌或者转移癌:①内膜癌转移输卵管,常见,一般内膜肿瘤大,输卵管肿瘤小,内膜及卵巢肿瘤具有相同的组织学分型及分级;②输卵管癌转移至内膜,少见,一般输卵管肿瘤大,内膜肿瘤小,良性内膜背景,两者具有相同或相似的组织学分型及分级;③内膜癌和输卵管癌均原发,也常见,一般内膜癌无或仅有表浅肌层浸润,输卵管癌为早期且不伴输卵管外广泛播散,两者组织学类型不同或相同均可[16]。该患者输卵管浆膜完整,虽然内膜癌组织类型与输卵管癌相同,但其病灶达深肌层(大于1/2肌层),且淋巴结转移为内膜癌常见的转移途径,输卵管包膜完整,故认为子宫内膜癌为原发,诊断:子宫内膜高级别浆液性癌ⅢC1期、原发性高级别浆液性输卵管癌ⅠA期。
2.4明确原发性双癌或转移癌的意义 子宫内膜输卵管原发性双癌与原发性子宫内膜癌伴输卵管转移或原发性输卵管癌伴子宫内膜转移,此三类患者在临床表现、病理特征及术前辅助检查上有很多相似之处,易被误诊。此例患者如为子宫内膜癌伴输卵管转移,诊断为子宫内膜癌ⅢC1期,如输卵管癌伴子宫内膜转移,诊断为输卵管癌ⅢA1期。虽手术治疗范围相同,但明确其诊断仍有其必要性。有研究表明,子宫内膜癌合并输卵管癌原发性双癌患者的预后优于子宫内膜癌伴输卵管转移及输卵管癌伴子宫内膜转移者。邓泽文等[17]研究显示,子宫内膜癌合并输卵管癌原发性双癌患者的5年生存率为81.56%,高于子宫内膜癌伴输卵管、卵巢转移患者。Bese等[18]报道原发性双癌的10年生存率明显高于转移性癌。大量研究表明,原发性双癌患者预后优于子宫内膜癌或卵巢癌伴转移者,5年生存率为65%~85%[19-20]。两个部位病理类型均为子宫内膜样腺癌患者,其预后好于不同病理类型的双癌[21]。目前研究显示,患者年龄、输卵管癌分期、子宫内膜癌分级和肌层浸润深度是影响子宫内膜癌合并输卵管癌原发性双癌预后的重要因素[22]。
目前研究表明,多种原发性恶性肿瘤与单个恶性肿瘤的治疗方案相似。子宫内膜癌和输卵管癌均以手术为主,手术方式为广泛子宫切除+双附件切除+盆腹腔淋巴结切除术,必要时切除大网膜及阑尾。根据肿瘤国际妇产科联盟(International Federation of Gynaecology and Obstetrics,FIGO)分期及其分化程度进一步决定术后辅助治疗方案。该患者术前诊断为子宫内膜癌,手术方式为腹腔镜子宫内膜癌分期术,术中左附件快速病理提示原发性输卵管癌,手术范围没变,但该患者仅进行大网膜活检,未行大网膜切除术。患者术后恢复好,术后第7天给予卡铂+多西他赛第1疗程静脉化疗,截稿时患者病情平稳,第6个疗程化疗结束。
总之,子宫内膜癌合并输卵管癌原发性双癌非常罕见,术前容易误诊或漏诊,明确诊断难度较大。术前充分进行病情评估、仔细分析辅助检查、术中附件及子宫剖视是十分重要的,必要时双附件行术中病理检查。由于研究资料显示原发性双癌患者的预后明显好于转移性癌患者,因此明确肿瘤来源、多部位肿瘤是否均原发或是转移肿瘤十分必要,对手术方式的选择及术后辅助治疗的选择有重要指导作用。在子宫内膜癌及输卵管癌原发性双癌的治疗中,应考虑子宫内膜癌的分期、分级、输卵管癌的分期、患者年龄等,合理选择治疗方式。目前,由于子宫内膜癌合并输卵管癌原发性双癌发病率低,样本量小,具体的治疗效果及预后还需要大样本量随访。

