妊娠期糖尿病患者血清Lp-PLA2、SDF-1α、FGF-21水平变化及与产后糖代谢异常的关系
王爱爱 刘彩琴* 张 力 杜 云
1.陕西省神木市医院(719399);2.陕西省友谊医院;3.西北妇女儿童医院
妊娠期间存在生理性胰岛素抵抗(IR)及胰岛素(INS)分泌升高,可引起血糖及血脂等指标升高,故妊娠又被认为是“一过性代谢综合征”,一旦妊娠期INS分泌不足以弥补IR,即可发展为妊娠期糖尿病(GDM)[1]。长期随访研究显示GDM妇女产后20~30年内发展成为T2DM者占50%以上[2]。因此,早期识别预测或识别GDM的产后糖代谢转归具有重要意义,目前已有诸多研究证实年龄、空腹血糖(FPG)、体质指数(BMI)、GDM诊断孕周等对产后糖代谢转归有一定影响,但仍缺乏客观检测指标[3]。本研究对GDM患者产后早期(6~12周)进行随访,评估脂蛋白相关磷脂酶 A2(Lp-PLA2)、基质细胞趋化因子-1α(SDF-1α)、成纤维细胞生长因子21(FGF-21)对产后早期糖代谢转归的影响,为GDM产后管理提供参考依据。
1 资料与方法
1.1 一般资料
选取2017年1月-2018年6月本院确诊为GDM并住院分娩、接受产后随访的孕妇95例(GDM组)。纳入标准:①符合GDM最新诊断标准[4];②单胎、头位妊娠;③年龄20~45岁。排除标准:①非自然妊娠;②合并妊娠期高血压、多囊卵巢综合征、血液系统疾病及甲状腺疾病;③产后服用影响血糖、血脂代谢药物。另选同期年龄相匹配(±2岁)单胎、自然妊娠孕妇50例为对照组,孕前及孕期糖代谢正常,除外其他妊娠期并发症及产后并发症。所有孕妇均知情并签署知情同意书,本研究经医院伦理学委员会审核批准。
1.2 资料收集及检测
入组后采集两组年龄、高血压(DM)家族史、产史、孕前体重等,测量现身高并计算BMI,统计孕期增重。均在孕24~28周接受口服糖尿量试验(OGTT)筛查,日立7060型全自动生化分析仪检测FPG、服糖后2h血糖(2hPG),测定空腹胰岛素(FINS)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)水平。以稳态模型法计算胰岛素抵抗指数(HOMA-IR)和胰岛β细胞功能指数(HOMA-β),HOMA-IR=FINS×FBG/22.5,HOMA-β=20×FINS/(FBG-3.5)。酶水解底物显色法检测血清Lp-PLA2水平,酶联免疫吸附法测定血清SDF-1α、FGF-21水平,试剂盒均由上海酶联生物科技有限公司提供。产后6~12周复测上述指标判定产后糖代谢转归:产后DM,FPG≥7.0mmol/L或OGTT 2hPG≥11.1mmol/L;糖耐量受损(IGT),FBG<7.0 mmol/L,OGTT 2hPG水平7.8~11.1mmol/L;糖耐量正常(NGT),FPG<7.0 mmol/L,OGTT 2hPG水平<7.8mmol/L。
1.3 统计学分析
2 结果
2.1 两组一般资料比较
GDM组中,DM组、糖耐量受损(IGT)组及糖耐量正常(NGT)组的DM家族史、孕前BMI高于NC组(P<0.05),且DM组和IGT组的孕前BMI高于NGT组(P<0.05),各组其余一般资料比较无差异(P>0.05)。见表1。

表1 各组一般临床资料比较
2.2 各组孕24~28周糖脂代谢及因子水平比较
GDM组各亚组的FBG、2hPG、FINS、HOMA-IR、TC、TG、LDL-C、Lp-PLA2、SDF-1α、FGF-21水平均高于对照组,HOMA-β、HDL-C均低于对照组(P<0.05);GDM组各亚组间除TC外其余各项指标比较也存在差异(P<0.05)。见表2。

表2 各组孕24~28周各检测指标水平比较
2.3 各组产后6~12周糖脂代谢及因子水平比较
产后6~12周,NGT组各项指标与对照组相当(P>0.05),而DM组、IGT组的FBG、2hPG、HOMA-IR、TG、LDL-C、Lp-PLA2、SDF-1α、FGF-21水平均高于对照组和NGT组,HOMA-β、HDL-C均低于对照组和NGT组,且DM组与IGT组有差异(P<0.05),但各组FINS、TC无差异(P>0.05)。见表3。

表3 各组产后6~12周各检测指标水平比较
2.4 GDM患者Lp-PLA2、SDF-1α、FGF-21与临床指标的相关性
Pearson相关分析显示,血清Lp-PLA2、SDF-1α、FGF-21水平与孕前BMI、FBG、2hPG、HOMA-IR、TG、LDL-C呈显著正相关性(P<0.05),与HOMA-β呈显著负相关性(P<0.05),但与TC、HDL-C关系不明显(P>0.05)。见表4。
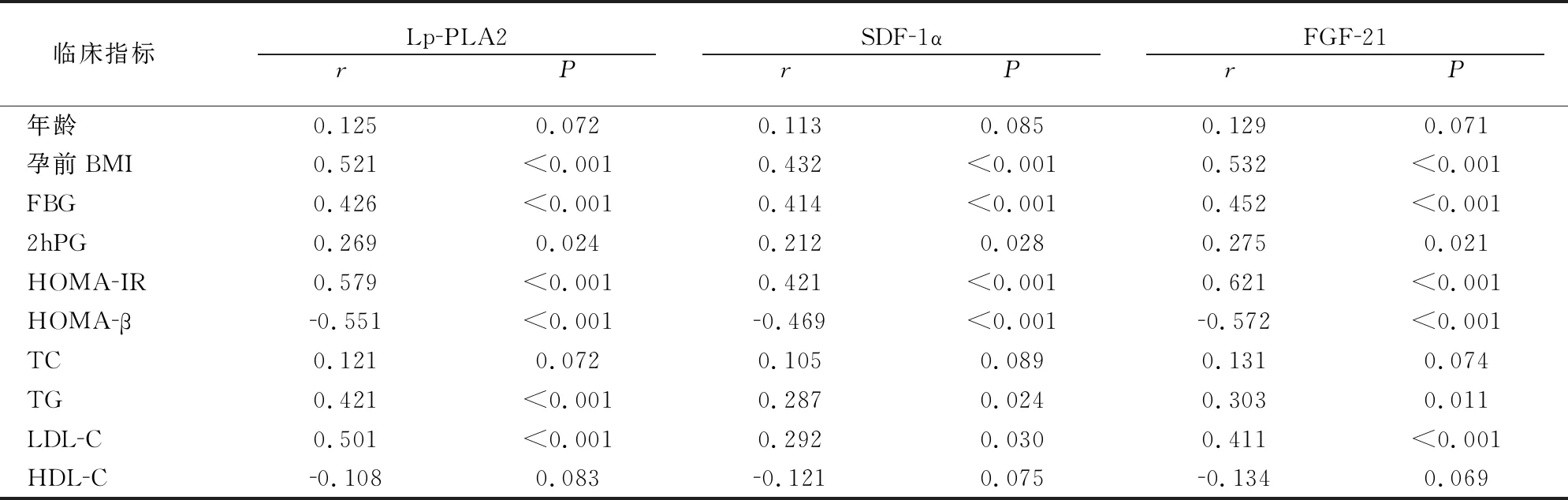
表4 GDM患者Lp-PLA2、SDF-1α、FGF-21与临床指标的相关性
2.5 GDM患者产后糖代谢异常的影响因素分析
以GDM产后早期发生糖代谢异常为因变量(Y),以组间比较有统计学意义的指标(孕前BMI、FPG、2hPG、脂代谢指标、Lp-PLA2、SDF-1α、FGF-21)为自变量(X),平衡混杂因素后行logistic回归分析。结果显示,Lp-PLA2、SDF-1α、FGF-21高表达是GDM产后发生糖代谢异常的独立危险因素(P<0.05)。见表5。
2.6 Lp-PLA2、SDF-1α、FGF-21与产后糖代谢异常的ROC曲线分析
ROC曲线分析显示,以Lp-PLA2水平26.94 nmol/min/ml为分界值,预测产后糖代谢异常时的灵敏度与特异度分别为82.3%、93.3%(AUC=0.929,95%CI0.781~0.990);以SDF-1α水平1.75μg/L为分界值,预测产后糖代谢异常时的灵敏度与特异度分别为82.4%、86.7%(AUC=0.761,95%CI 0.57~0.893);以FGF-21水平140.51ng/L为分界值,预测产后糖代谢异常时,灵敏度与特异度分别为64.7%、86.7%(AUC=0.514,95%CI 0.642~0.931)。见图1(插页)。
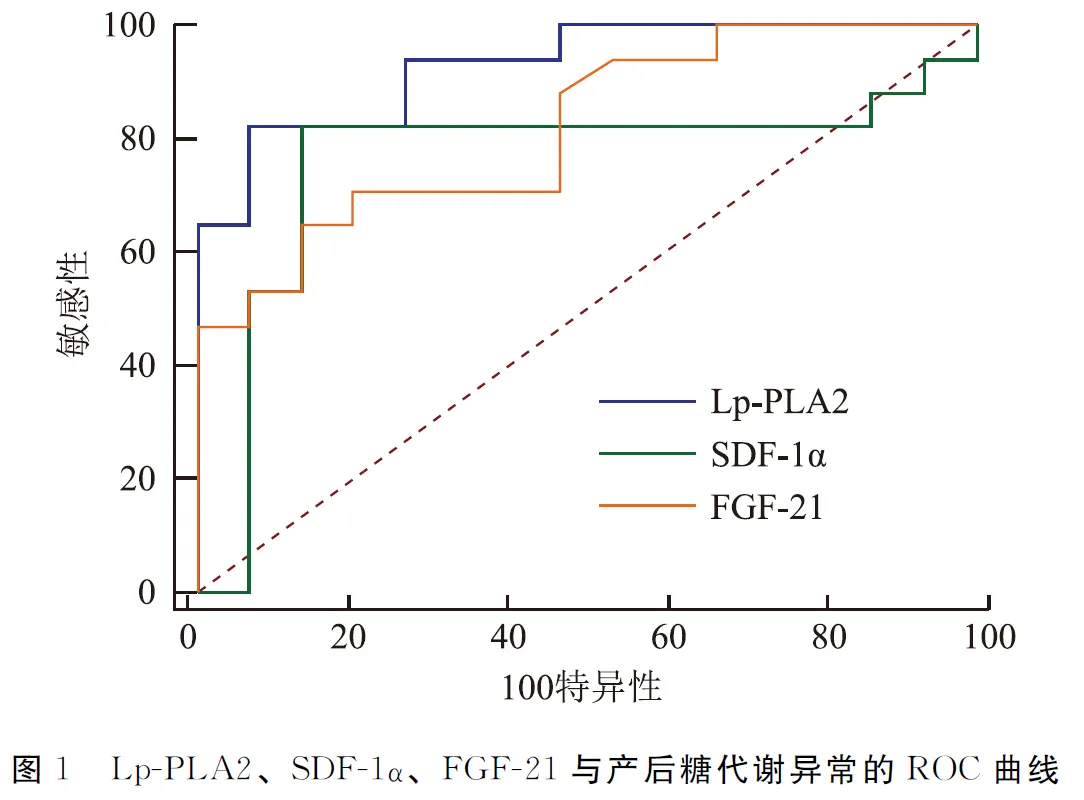
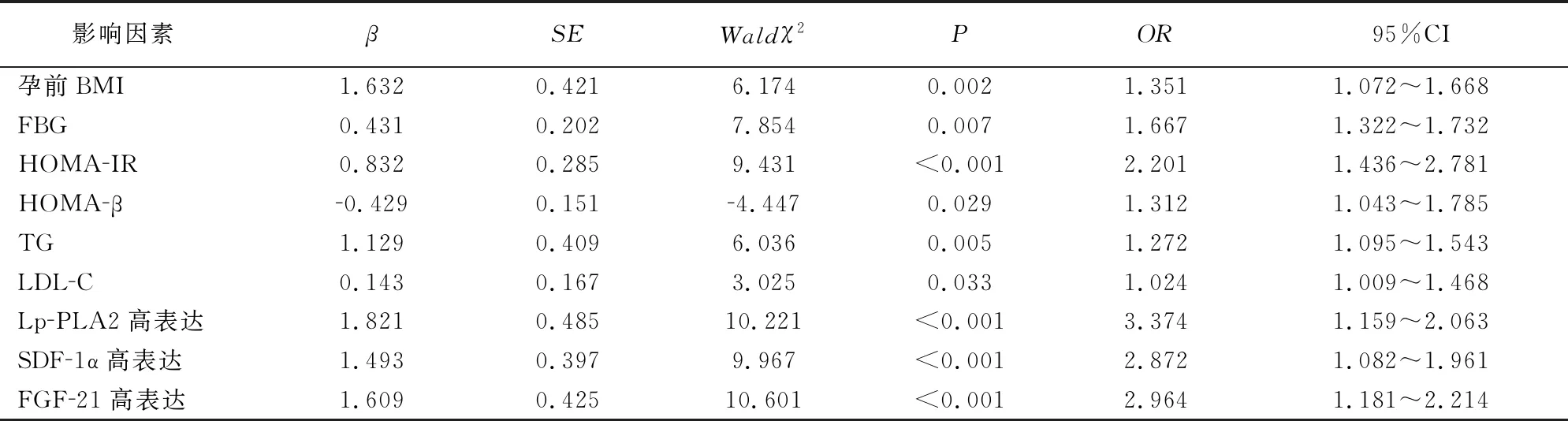
表5 GDM患者产后糖代谢异常影响因素logistic回归分析
3 讨论
GDM病理生理基础与T2DM相似,即在IR基础上伴有胰岛素分泌不足及胰岛β细胞功能受损,远期发展为T2DM的风险较高,故GDM又被认为是T2DM的前期状态[5]。本组95例GDM患者在产后6~12周OGTT筛查时,DM及IGT率分别达20.4%、29.5%,总糖代谢异常率为50.5%,证实GDM患者产后具有较高的糖代谢异常发生风险,产后及时筛查和干预对改善远期糖代谢转归具有重要价值。
本研究GDM患者孕24~28周时糖脂代谢指标与对照组存在差异,且GDM患者具有更高的基础BMI,与既往研究[6]一致。产后6~12周,DM组和IGR组的FBG、2hPG、HOMA-IR、TG、LDL-C、Lp-PLA2、SDF-1α、FGF-21水平均高于NC组和NGT组,HOMA-β、HDL-C均低于NC组和NGT组, NGT组血糖血脂指标与NC组无差异,但HOMA-IR高于NC组、HOMA-β低于NC组。提示GDM患者产后仍存在不同程度的糖脂代谢异常和IR,即便是NGT患者IR仍未恢复,这可能是GDM患者远期T2DM发生风险更高的原因之一。同时也证实单纯OGTT筛查产后糖代谢异常存在一定局限,难以充分鉴别或预测产后糖代谢异常,寻找更理想的糖代谢监测指标非常必要。
近年来,随着脂肪组织分泌功能研究的不断深入,脂肪细胞因子T2DM在GDM发生发展中的作用受到学者重视。FGF-21是一种新型脂肪细胞因子,能不依赖INS而发挥血糖调节作用,可通过改善胰岛β细胞功能,提高脂肪组织的葡萄糖摄取作用,还可减少脂肪细胞的堆积[7]。动物研究表明,FGF-21还可刺激肝脏对INS的敏感性,有效调节糖脂代谢[8]。本研究中,GDM组患者在孕24~28周及产后6~12周,各个亚组的FGF-21均高于NC组,且GM组>IGT组>NGT组,推测FGF-21可能与GDM的发生及产后糖代谢异常有关。相关性分析显示,FGF-21水平与孕前BMI、FBG、2hPG、HOMA-IR、TG、LDL-C呈正相关性,与HOMA-β呈负相关性,考虑与其代偿性作用机制有关。
炎症发病学说认为,慢性低度炎症在T2DM、GDM的发生发展中有重要作用,涉及肥胖及IR的各个病理生理过程,甚至认为慢性低度炎症可能是IR的重要启动及扩大因子[9]。Lp-PLA2是一种新型炎症标志物,可诱导多种促炎细胞因子、趋化因子及血小板活性物质的生成,介导炎症级联效应[10]。同时也是一种脂肪组织炎症标志物,而脂肪细胞因子紊乱及脂肪酸分泌增加是胰岛β细胞功能受损及IR的主要病理生理基础,故推测Lp-PLA2异常表达参与了T2DM的发生发展过程[11]。有研究显示,GDM患者Lp-PLA2水平明显升高,且与IR密切相关[12]。SDF-1α也是一种新型脂肪组织炎症因子,参与肥胖、炎症、IR及DM的发生发展过程[13]。肖维等[14]研究显示,GDM患者血清SDF-1α明显高表达,且与IR呈正相关性。本研究中,GDM患者各亚组在孕24~28周时血清Lp-PLA2及SDF-1α水平已高于NC组,产后6~12周时仍高于NC组。同时,Lp-PLA2及SDF-1α水平与孕前BMI、FBG、2hPG、HOMA-IR、TG、LDL-C呈正相关性,与HOMA-β呈负相关性。推测Lp-PLA2及SDF-1α高表达与IR及GDM的发生发展密切相关。同时,无论是孕24~28周还是产后6~12周,DM组、IGT组、NGT组间Lp-PLA2及SDF-1α水平均存在差异,提示两指标可能对产后糖代谢异常的筛查有一定临床价值。回归分析显示,FGF-21、Lp-PLA2及SDF-1α是GDM产后糖代谢异常的危险因素,与卫华等[15]报道相符。进一步ROC曲线分析显示,以Lp-PLA2、SDF-1α、FGF-21预测产后糖代谢异常的灵敏度与特异度均处于较高水平,提示可用于GDM患者产后糖代谢异常的筛查或预测因子,而早期采取积极干预措施下调FGF-21、Lp-PLA2及SDF-1α表达可能对GDM孕妇产后糖代谢异常的防治有一定价值。
综上所述,GDM孕妇存在血清FGF-21、Lp-PLA2及SDF-1α明显高表达,这3项指标可能参与了GDM的病理生理过程;且与HOMA-IR及HOMA-β密切相关,可能通过介导脂肪炎性改变、血管内皮细胞受损、糖脂代谢紊乱、IR等参与了GDM的发生发展;可作为GDM产后糖代谢异常的高危因素,早期监测对预测与干预有一定临床意义。

