急性冠状动脉综合征患者介入术后急性肾损伤与短期预后的关系
毛 婉,刘文光,唐永祯,马 震,庄晓赛,解慧新
0 引 言
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是急性冠状动脉综合征(acute coronary syndrom,ACS)患者治疗的主要手段,但其中15%~35%的患者术后出现急性肾损伤(acute kidney injury,AKI)[1]。这种损伤通常是轻微、短暂的,但也可能导致持续性的肾功能障碍[1]。目前,ACS患者PCI术后并发AKI的机制尚未完全阐明。以往大多数学者认为,PCI术中使用的含碘造影剂是导致AKI的主要原因,即造影剂肾病(contrast induced nephropathy,CIN)[2]。高渗性的造影剂在体内以原形由肾小球滤过而不被肾小管吸收,脱水时其肾内浓度增高,进而导致肾功能损害。然而近年来的研究表明,出现AKI的原因还与患者血流动力学不稳定和神经-内分泌系统激活有关,上述应激反应过程出现内皮素、血管紧张素等血管活性因子大量释放,引起入球血管收缩和肾髓质缺血、缺氧[2]。以往研究主要关注ACS患者介入术后发生AKI的危险因素[3];而关于AKI与患者预后的关系鲜有报道。鉴于此,本研究回顾性分析行PCI治疗的333例ACS患者临床资料,对比不同AKI情况患者术后不良心血管事件发生率和生存率,旨在探讨PCI术后AKI对ACS患者预后的预测价值。
1 资料与方法
1.1 研究对象及分组回顾性分析我院2017年10月—2018年5月期间接受PCI治疗的333例ACS患者资料,其中男206例、女127例;年龄48~89岁,平均(65.2±9.4)岁。其中急性ST段抬高型心肌梗死(STEMI)患者115例,非ST段抬高型急性冠状动脉综合征(NSTE-ACS)患者218例;急诊PCI 174例、非急诊PCI 159例;前壁心肌梗死179例、右心室及下壁心肌梗死154例。纳入标准:①经病史、临床表现、辅助检查诊断为ACS,诊断标准参照第7版《内科学》;②根据《中国经皮冠状动脉介入治疗指南(2016)》,具有PCI治疗指征[4];③患者及家属签署诊疗同意书。排除标准:①合并心源性休克;②合并需要透析治疗的严重肾功能不全;③无肾功能评估;④肾移植史;⑤术前1周内应用肾毒性药物或造影剂;⑥造影剂过敏;⑦甲状腺功能异常;⑧合并恶性肿瘤;⑨伴有严重的凝血功能异常等介入治疗禁忌。将所有纳入研究患者根据PCI术后第1~3天血清肌酐水平分为AKI组和非AKI组。
1.2PCI手术PCI手术使用常规技术进行,包括经皮冠状动脉球囊血管成形术、冠状动脉支架植入术[5]。所有手术均使用非离子造影剂碘克沙醇注射液(江苏恒瑞医药股份有限公司,国药准字H20301675)。PCI手术具体操作及围手术期抗血小板、水化等处理参照《中华医学会心血管病学分会中国PCI治疗指南(2016)》[6]。
1.3观察指标参照Silvain等[1]方法,AKI定义为PCI术后第1~3天血清肌酐水平较术前升高≥25%。记录患者性别、年龄、疾病史、用药史、造影剂用量、左心室射血分数(left ventricular ejection fraction,LVEF)、病变冠状动脉支数、术前Killip分级及实验室指标等一般临床资料;术前和术后1、2、3 d分别监测患者的血清肌酐水平;术后1年内记录患者不良心血管事件,不良心血管事件具体包括充血性心力衰竭、心绞痛复发、非致死性心肌梗死、严重心律失常、再次血运重建和心源性死亡。充血性心力衰竭定义为LVEF≤45%、利钠肽(BNP/NT-proBNP)水平升高及心脏结构或功能异常的客观证据;心绞痛复发定义为术后再次因冠状动脉供血不足出现的发作性胸痛或胸部不适;非致死性心肌梗死定义为术后出现冠状动脉持续性缺血缺氧引起的非致死性心肌坏死;心源性死亡定义为由于心脏原因导致的死亡;严重心律失常定义为心律失常引起严重的血流动力学改变。肾功能不全定义为基线内生肌酐清除率<60 mL/min[5]。
1.4随访所有患者术后1~3个月以复诊或电话方式进行随访。随访时间从PCI术后开始计算,随访终点为患者死亡,失访、截至末次随访(2019年5月)仍存活以删失数据表示。
1.5统计学分析采用SPSS 21.0软件进行数据分析。计数资料以n(%)表示。AKI组和非AKI组间计数资料比较采用χ2检验;PCI术后发生AKI的危险因素分析采用二分类Logistic回归模型;采用Kaplan-Meier法绘制两组患者的生存曲线,组间总生存率比较采用Log rank检验;PCI术后短期生存的单因素和多因素分析分别采用Kaplan-Meier检验和Cox回归模型。以P≤0.05为差异有统计学意义。
2 结 果
2.1 临床资料比较本组病例最终纳入AKI组38例、非AKI组295例,AKI发生率为11.4%。PCI术后患者AKI发生与年龄、糖尿病、术前肾功能不全、LVEF、造影剂用量、病变冠状动脉支数、术前Killip分级有关(P<0.05),而2组间性别、吸烟、高血压、高脂血症、陈旧性心梗史、服用他汀类药物、服用阿司匹林、服用β-受体阻滞剂、肌酸激酶、术前血红蛋白、急诊PCI、体重指数、LVEDD、LVESD、支架数目、支架直径、病变类型、左主干病变、重度血栓病变和手术前后靶血管TIMI血流分级差异均无统计学意义(P>0.05)。见表1。
2.2PCI术后发生AKI的危险因素分析Logistic回归分析结果显示,年龄、糖尿病、术前肾功能不全、LVEF、造影剂用量及病变冠状动脉支数是PCI术后发生AKI的独立危险因素(P<0.05),见表2。
2.3AKI组和非AKI组术后1年内不良心血管事件发生率比较术后1年内,AKI组和非AKI组不良事件总发生率分别为28.9%和5.8%,差异具有统计学意义(χ2=20.582,P=0.000)。见表3。
表 1 AKI组和非AKI组一般临床资料比较
Table 1 Comparison of clinical data between the two groups
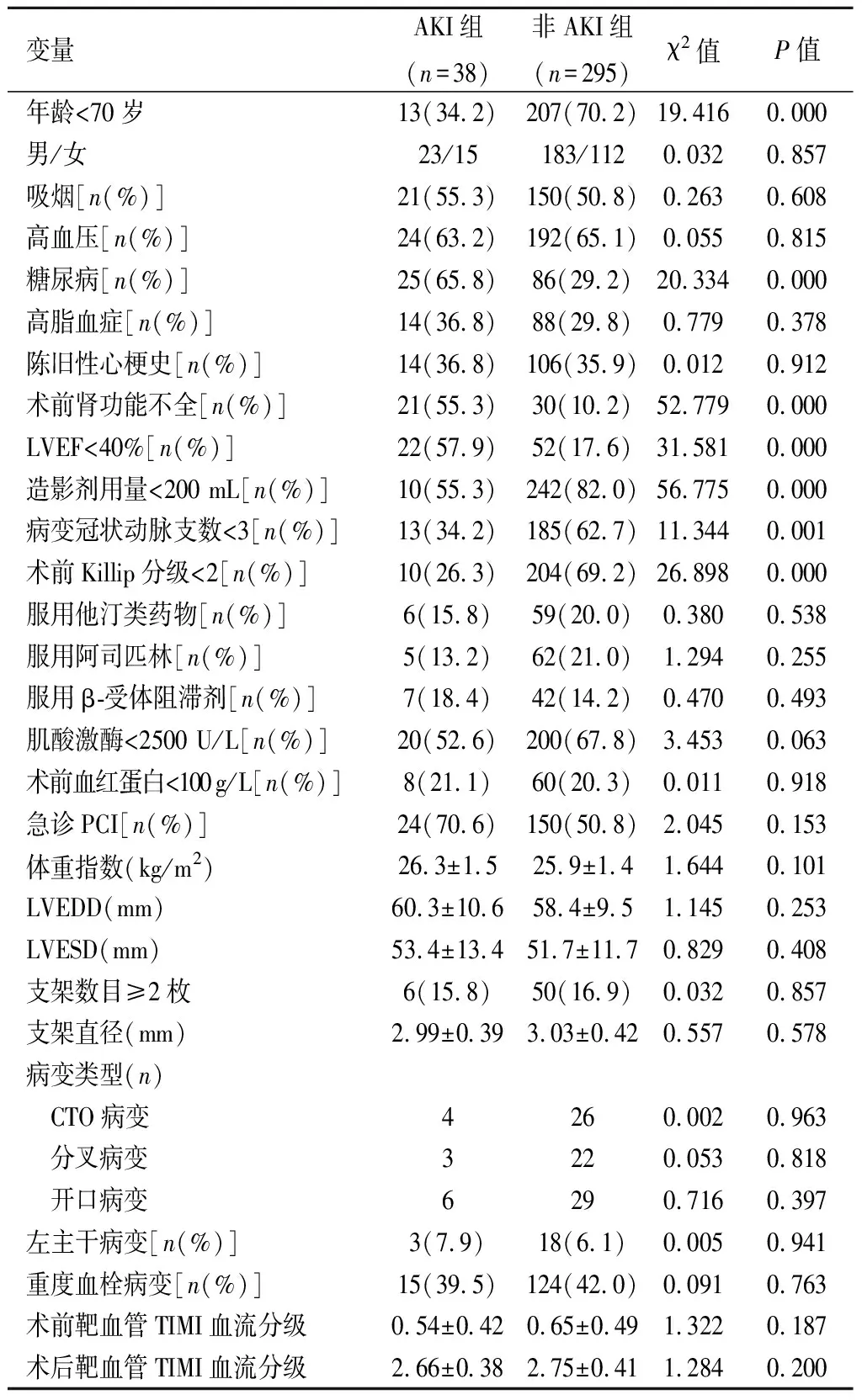
变量AKI组(n=38)非AKI组(n=295)χ2值P值年龄<70岁13(34.2)207(70.2)19.4160.000男/女23/15183/1120.0320.857吸烟[n(%)]21(55.3)150(50.8)0.2630.608高血压[n(%)]24(63.2)192(65.1)0.0550.815糖尿病[n(%)]25(65.8)86(29.2)20.3340.000高脂血症[n(%)]14(36.8)88(29.8)0.7790.378陈旧性心梗史[n(%)]14(36.8)106(35.9)0.0120.912术前肾功能不全[n(%)]21(55.3)30(10.2)52.7790.000LVEF<40%[n(%)]22(57.9)52(17.6)31.5810.000造影剂用量<200 mL[n(%)]10(55.3)242(82.0)56.7750.000病变冠状动脉支数<3[n(%)]13(34.2)185(62.7)11.3440.001术前Killip分级<2[n(%)]10(26.3)204(69.2)26.8980.000服用他汀类药物[n(%)]6(15.8)59(20.0)0.3800.538服用阿司匹林[n(%)]5(13.2)62(21.0)1.2940.255服用β-受体阻滞剂[n(%)]7(18.4)42(14.2)0.4700.493肌酸激酶<2500 U/L[n(%)]20(52.6)200(67.8)3.4530.063术前血红蛋白<100g/L[n(%)]8(21.1)60(20.3)0.0110.918急诊PCI[n(%)]24(70.6)150(50.8)2.0450.153体重指数(kg/m2)26.3±1.525.9±1.41.6440.101LVEDD(mm)60.3±10.658.4±9.51.1450.253LVESD(mm)53.4±13.451.7±11.70.8290.408支架数目≥2枚6(15.8)50(16.9)0.0320.857支架直径(mm)2.99±0.393.03±0.420.5570.578病变类型(n) CTO病变4260.0020.963 分叉病变3220.0530.818 开口病变6290.7160.397左主干病变[n(%)]3(7.9)18(6.1)0.0050.941重度血栓病变[n(%)]15(39.5)124(42.0)0.0910.763术前靶血管TIMI血流分级0.54±0.420.65±0.491.3220.187术后靶血管TIMI血流分级2.66±0.382.75±0.411.2840.200
表 2 PCI术后患者发生AKI危险因素的Logistic回归分析
Table 2 Logistic regression analysis of risk factors in patients with PCI

变量βSEWaldOR值95%CIP值年龄-1.3900.5406.6380.2490.086~0.7170.010糖尿病1.8460.6039.3566.3341.941~20.6720.002术前肾功能不全2.5650.63616.28112.9993.740~45.1850.000LVEF2.0770.57113.2297.9802.606~24.4360.000造影剂用量-3.3100.69122.9630.0370.009~0.1410.000病变冠状动脉支数-1.5620.6445.8870.2100.059~0.7410.015术前Killip分级-0.5510.6120.8110.5760.174~1.9130.368
表 3 AKI组和非AKI组术后1年内心血管不良事件发生情况(n)
Table 3 Adverse events in cardiovascular between the two groups (n)

组别n充血性心力衰竭心绞痛复发非致死性心肌梗死严重心律失常再次血运重建心源性死亡AKI组38113114非AKI组295322334
2.4AKI组和非AKI组术后短期生存率比较全组患者随访时间2.9~17.2个月,中位随访时间8.6个月,失访率为8.4%(28/333)。AKI组和非AKI组术后6个月累积生存率分别为94.1%和99.6%,术后1年累积生存率分别为84.2%和96.1%,两组总生存率差异具有统计学意义(χ2=9.216,P=0.002),见图1。
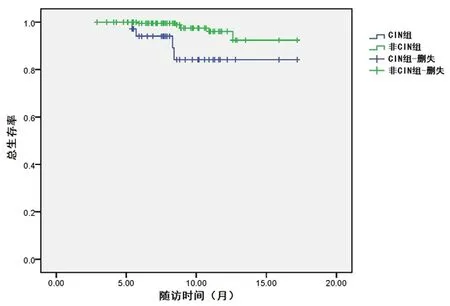
图 1 AKI组和非AKI组术后生存曲线
Figure1PostoporativesurvivalcurvesofAKIandnon-AKIgroups
2.5PCI术后短期生存的单因素和多因素分析Kaplan-Meier单因素分析显示,PCI术后短期生存与AKI(χ2=20.582,P=0.000)、LVEF(χ2=9.055,P=0.003)、病变冠状动脉支数(χ2=5.749,P=0.016)及术前Killip分级(χ2=4.823,P=0.028)有关;Cox多因素分析显示,AKI和LVEF是PCI术后短期生存的独立预测因素(P<0.05)。见表4。
表 4 PCI术后短期生存的Cox多因素分析
Table 4 Cox analysis of survival situation for patients with PCI
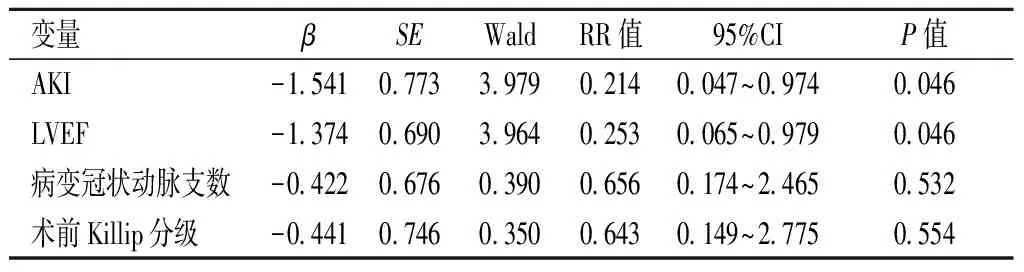
变量βSEWaldRR值95%CIP值AKI-1.5410.7733.9790.2140.047~0.9740.046LVEF-1.3740.6903.9640.2530.065~0.9790.046病变冠状动脉支数-0.4220.6760.3900.6560.174~2.4650.532术前Killip分级-0.4410.7460.3500.6430.149~2.7750.554
3 讨 论
本研究发现,年龄、糖尿病、术前肾功能不全、LVEF、造影剂用量及病变冠状动脉支数是PCI术后发生AKI的独立危险因素(P<0.05)。ACS患者PCI术后并发AKI提示短期预后较差,可作为病情评估和危险分层的重要因素。在临床工作中,对于存在并发AKI高危因素或已经出现AKI的ACS患者,应积极干预并密切随访,以最大程度减少AKI、心血管不良事件及死亡的发生。
Giacoppo等[5]分析9512例ACS患者PCI手术前后的血清肌酐水平,结果显示共有1212例(12.7%)患者出现AKI。本研究中,PCI术后AKI的发生率为11.4%,与既往大多数研究结果基本一致[1,4]。吴娟等[6]研究显示PCI术后AKI的发生率为19.38%,高于本研究结果,原因考虑与该研究受试者平均年龄和术前肾功能不全患者比例较高有关。Pan等[7]研究证实,高龄、合并糖尿病、造影剂用量大的PCI术后患者AKI发生率显著升高(P<0.05)。一项前瞻性、多中心研究也显示LVEF、病变冠状动脉支数增加了PCI术后发生AKI的风险(P<0.05)[8]。Qian等[9]研究认为,术前合并肾功能不全的ACS患者由于肾储备功能有限,故在暴露于具有肾毒性造影剂等药物时更容易出现AKI,本研究结果也支持了这一观点。
既往研究已经证实,PCI术后AKI的发展与冠状动脉并发症以及中风、成人呼吸窘迫综合征、肺栓塞和胃肠道出血等非心脏并发症的发生率较高有关[10]。本研究中,术后1年内,AKI组心血管不良事件总发生率明显高于非AKI组(28.9%vs5.8%,P=0.000)。本研究结果还显示,AKI组累积生存率显著低于非AKI组(P=0.002);Cox多因素分析显示,AKI和LVEF是PCI术后短期生存的独立预测因素(P<0.05)。本研究结果表明PCI术后并发AKI的患者预后明显较无并发AKI的患者更差,出现这种结果的原因可能包括以下原因:①AKI患者内源性NO合成减少,而细胞内氧自由基合成增加,促进了动脉粥样硬化和急性心血管事件的发生、发展;②肾功能损伤导致肾素-血管紧张素-醛固酮系统激活,导致水钠潴留,加重了心脏负荷;③由于肾功能障碍,很多具有肾毒性的心血管药物难以规范应用;④肾功能储备较差的患者往往合并贫血和感染性疾病,加速了心血管疾病的发展。与本研究结果相似,Marenzi等[11]研究纳入了3771例ST段抬高型心肌梗死患者,探讨PCI术后AKI与患者死亡率之间的关系,结果显示,AKI是短期死亡率的独立预测因素(RR=8.3,95%CI 5.1~13.3,P<0.01)。Sun等[12]研究显示,急性心肌梗死PCI术后AKI患者的全因死亡率高于非AKI患者(24%vs3.4%,P<0.001);多变量Cox分析显示,AKI是预后较差的独立预测因子(HR=2.97,95%CI 1.46~6.06,P<0.001)。此外,LVEF降低导致PCI术后预后较差的原因主要是心源性死亡和心肌梗死等风险显著升高。边丽雅等[13]研究发现,LVEF<50%组ACS患者PCI术后2年心脏缺血事件的发生率及生存率均明显较差(P<0.05)。
本研究的局限性:①本研究随访时间有限,PCI术后AKI与ACS患者中远期预后的关系有待进一步观察;②以往有研究表明术前不同肾功能状况与AKI的发生率及预后存在相关,本研究并未根据术前肾功能正常和异常情况进行分层分析,可能对研究结果造成影响;③本研究尚不能证实PCI术后肌酐值升高与短期死亡率增加之间的病因学联系,仍需要前瞻性、多中心、大样本研究深入论证。

