羊口疮病毒F1L融合Fe蛋白的表达与鉴定
邢雪 王元红 李传峰 缪秋红 曹昳 王桂军 刘光清


摘要:本研究克隆了羊口疮病毒安徽分离株的F1L基因,融合Fe蛋白编码基因后,插入载体pET-32a中,构建了重组质粒pET-F1L-Fe。将pET-F1L-Fe转化BL21(DE3)感受态细胞,用IPTG诱导表达重组蛋白F1L-Fe。SDS-PAGE分析结果显示,羊口疮病毒F1L-Fe基因在BL21(DE3)获得了正确表达。将大量表达的F1L-Fe蛋白进行纯化,然后免疫BALB/c鼠,制备了抗F1L蛋白的多克隆抗体。最后,以制备的多克隆抗体对F1L-Fe融合蛋白进行Western-blot检测和分析,结果表明F1L-Fe蛋白能与制备的多克隆抗体发生特异性反应,具有良好的反应原性。本研究结果为进一步研发羊口疮病毒亚单位疫苗提供了物质基础。
关键词:羊口疮病毒;F1L-Fe蛋白;多克隆抗体
中图分类号:S855.3文献标识码:A文章编号:1000-4440(2020)01-0130-06
Abstract:In this study, the F1L gene of orf virus(ORFV) Anhui isolated strain was cloned. After fusing with the coding gene of Fe protein, it was inserted into the expression vector pET-32a to construct recombinant plasmid pET-F1L-Fe. Subsequently, pET-F1L-Fe was transformed into BL21(DE3) competent cells, and the expression of recombinant protein F1L-Fe was induced by IPTG. The results of SDS-PAGE showed that the F1L-Fe gene was successfully expressed in BL21(DE3). Then the F1L-Fe protein was expressed in large quantities and purified. To prepare the polyclonal antibody against F1L protein, BALB/c mice were immunized with the recombinant protein. Western blot results indicated that the F1L-Fe protein reacted specifically with the prepared polyclonal antibody and showed good reactogenicity. In a word, the results of this study provide the material foundation for further developing the subunit vaccine against ORFV.
Key words:orf virus(ORFV);F1L-Fe protein;polyclonal antibody
羊口疮(ORF),即羊传染性脓疱(Contagious secthyma),是一种主要在病畜鼻孔、嘴唇处出现脓疱以及丘疹等病症的流行病,该病主要感染1~3月龄的羔羊[1-2]。中国养羊地域均出现过该病,并且发病率呈显著的上升趋向,危害着中国养羊业的发展,严重阻碍了中国畜牧业的持续发展[3-6]。
羊口疮病毒(ORF virus, ORFV) 为线性双链DNA病毒,属痘病毒科副痘病毒属,基因组大小约134 kb [7]。其中 ORFV 059 基因编码F1L 蛋白,F1L蛋白作为羊口疮的主要免疫原蛋白,能激发机体产生免疫反应,诱发宿主产生中和抗体[8]。因此,F1L蛋白可以作为研发羊口疮新型疫苗的免疫原蛋白之一。
在疫苗开发方面,Fe蛋白作为普遍存在于生物界的铁贮藏蛋白,有自组装形成纳米颗粒的功能,主要技术体现在铁蛋白纳米笼的高度对称和自组装性,形成了一个有效的抗原递送系统,广泛应用于疫苗、药物研发等行业。在已开发研究的疫苗中,铁蛋白作为抗原的理想载体,已成功将来自HIV-1病毒的Tat蛋白和流感病毒的血凝素蛋白分别与幽门螺旋杆菌的铁蛋白融合形成纳米笼,激起体液反应并诱导产生中和抗体,成功地开发了能够有效针对这些病原体的疫苗[9] 。
本研究即在选择ORFV F1L为靶基因,去除其跨膜区后,与铁蛋白基因融合,构建重组质粒pET-F1L-Fe,然后转化感受态细胞BL21(DE3)表达重组融合蛋白F1L-Fe,并制备抗F1L-Fe重组蛋白的多克隆抗体,以便为研发ORFV亚单位疫苗提供物质基础。
1材料与方法
1.1材料
1.1.1病毒、细胞和菌株羊口疮病毒株及其阳性血清、载体pET-32a均由本实验室储藏; DH5α 和BL21(DE3)感受态细胞均来自TransGen Biotech公司。
1.1.2主要試剂LA Taq 聚合酶购自TaKaRa(大连)公司,pMD19T载体、SolutionⅠ连接酶、 EcoR Ⅰ和EcoR V限制性内切酶购自NEB(北京)公司,质粒小提试剂盒来自美国AXYGEN 公司,胶回收试剂盒来自Sangon Biotech公司,兔抗羊IgG-HRP来自CW Bio公司,ECL化学发光试剂盒来自美国 Thermo 公司,其余试剂均为分析纯。
1.1.3试验动物5周龄的BALB/c健康雌鼠来自上海杰思捷实验动物有限公司[许可证号码:SCXX(沪)2018-0004]。
1.2方法
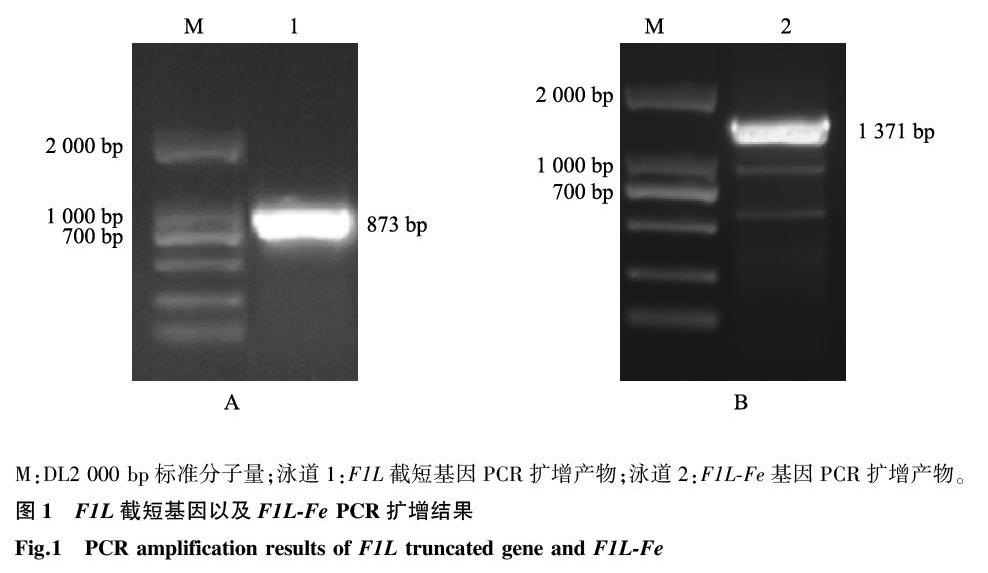
1.2.1重组质粒pET-F1L-Fe的构建据GenBank上已发表的ORFV F1L基因序列,去除其跨膜区(TMH)设计用于扩增F1L截短基因的PCR引物,扩增片段大小为873 bp。并设计融合PCR引物通过linker蛋白(SGG)将F1L与Fe连接起来,上下游引物两端分别添加酶切位点EcoR I和EcoR Ⅴ。引物(由上海擎科公司合成)序列见表1。
先以ORFV基因组为模板以F1L F/F1L R为引物进行PCR扩增,胶回收后连接PMD-19T,转化后获得PMD-19T-F1L,然后将上述重组质粒以引物F1L (TMH)-F/F1L R(TMH)进行PCR扩增,胶回收后加DMT(Dimethyl terephthalate, 对苯二甲酸二甲酯)转化DH5α后,挑取单克隆进行PCR鉴定,鉴定正确后分别以F1L-Fe F1 (EcoR V)/F1L-Fe R2 (EcoR V)为引物扩增F1L(TMH),以F1L-Fe F2/F1L-Fe R1 (EcoRⅠ)为引物扩增Fe蛋白,胶回收后进行融合PCR,第一次反应条件为95 ℃预变性 5 min;94 ℃ 20 s、72 ℃ 90 s ,10个循环;72 ℃延伸 5 min, 第一次反应结束后,取出PCR管加入引物F1L-Fe F1 (EcoR V)、F1L-Fe R1 (EcoRⅠ)。第二次反应条件为95 ℃预变性 5 min;94 ℃ 20 s、56 ℃ 20 s、72 ℃ 40 s,10個循环;72 ℃延伸 5 min。待反应结束后,胶回收 PCR 产物。用EcoR I和EcoR Ⅴ 双酶切后胶回收,然后与经EcoR I和EcoR Ⅴ双酶切的pET-32a载体连接,并转化DH5α,于含AMP (氨苄青霉素,Amoxicillin)的LB平板37 ℃培养。次日挑单克隆并进行PCR鉴定。鉴定正确后进行EcoR I和EcoR Ⅴ双酶切鉴定,将双酶切验证准确的质粒送桑尼(上海)公司测序。
1.2.2F1L-Fe蛋白的诱导表达及SDS-PAGE分析将质粒pET-F1L-Fe转化感受态细胞BL21(DE3),挑取单克隆于含AMP的LB培养液中,37 ℃、220 r/min培养。OD600值为0.6~0.8时,加1 mmol/L的IPTG(异丙基-β-D-硫代半乳糖苷),分别以16 ℃,220 r/min诱导过夜, 37 ℃,220 r/min诱导5 h,取菌液,经12 000 r/min离心1 min,弃上清液。加PBS重悬,与蛋白质上样缓冲液混匀,95 ℃ 10 min后进行SDS- PAGE电泳分析。
1.2.3F1L-Fe蛋白的可溶性分析及纯化取3 ml菌液到300 ml的含AMP的LB培养液中,加入终浓度为1 mmol/L的IPTG,37 ℃,220r/min诱导5 h,将已诱导的菌液4 ℃ 8 000 r/min离心15 min,弃上清液,加入30 ml PBS吹打混匀沉淀,离心,重复上述步骤3次。最后向沉淀加入10 ml PBS后超声裂解,最后4 ℃ 8 000 r/min离心20 min,SDS-PAGE电泳分析沉淀和上清液。结果证明F1L-Fe重组蛋白主要以包涵体的形式存在,收集沉淀,分别加2 mol/L、4 mol/L尿素洗涤沉淀,离心取沉淀,用4 ml 8 mol/L尿素溶解沉淀,离心,将上清液放于透析袋中透析复性,获得目的重组蛋白。
1.2.4F1L-Fe蛋白的透射电镜观察取重组融合蛋白F1L-Fe 4 ℃,8 000 r/min离心10 min,吸取20 μl上清液滴于封口膜,铜网吸附3~5 min,以10 g/L磷钨酸(pH 6.8~7.4)负染1 min,透射电镜(TEM)下观察并拍照。
1.2.5F1L-Fe蛋白的Western-blot鉴定将F1L-Fe蛋白经SDS-PAGE电泳后,半干转法转移至硝酸纤维素滤膜(CN)上,使用含5%脱脂奶粉的TBST 室温封闭2 h。加ORFV阳性血清为一抗,4 ℃孵育12 h,TBST清洗3次。加兔抗羊IgG-HRP为二抗,37 ℃孵育1 h,清洗后ECL显色观察。
1.2.6F1L-Fe蛋白的鼠源多克隆抗体的制备与鉴定将融合蛋白F1L-Fe与弗氏完全佐剂等比例混合,乳化完全后免疫5周龄 BALB/c雌鼠, 每只50 μg皮下注射,7 d后进行第二次免疫,将融合蛋白F1L-Fe与弗氏不完全佐剂等比例乳化后,每只50 μg皮下注射。首次免疫后的第4周和第6周进行第三次和第四次免疫,步骤与第二次免疫相同。第四次免疫后7 d小鼠眼眶处采血,分离血清。以获得的小鼠血清为一抗,以F1L-Fe融合蛋白为抗原,进行Western-blot鉴定分析。
2结果
2.1F1L-Fe基因PCR 扩增
PCR 扩增产物,在700~1 000 bp处有特异性条带,约873 bp,与预期相符合(图1A)。融合PCR扩增产物,在1 000~2 000 bp处有特异性条带,约1 371 bp,与预期相符合(图1B)。
2.2F1L-Fe蛋白的诱导表达及鉴定
将鉴定正确的表达质粒pET-F1L-Fe转入BL21(DE3)进行诱导表达,电泳结果表明,表达质粒PET-F1L-Fe经IPTG诱导后出现了特异性蛋白条带,相对分子质量大小约70 000,与预期相符合,且在37 ℃下诱导的蛋白质产量显著多于其他条件。结果说明,在37 ℃、1 mmol/L IPTG、4 h条件下能够获得正确的蛋白质表达且表达量较大(图2)。
2.3F1L-Fe蛋白的可溶性分析及纯化
SDS-PAGE分析结果表明,融合蛋白F1L-Fe主要出现在沉淀中。说明重组融合蛋白F1L-Fe主要以包涵体的方式存在(图3A)。尿素纯化该包涵体蛋白,纯化后通过SDS-PAGE分析,结果获得了相对单一的目的条带(图3B)。
2.4F1L-Fe蛋白的透射电镜负染观察
透射电镜负染观察可见F1L-Fe蛋白可自组装为球形颗粒,大小均一且结构、形态稳定,直径约100 nm(图4)。
2.5F1L-Fe蛋白的Western-blot 鉴定及其多克隆抗体的制备
使用羊口疮阳性血清对F1L-Fe重组融合蛋白进行Western-blot试验,结果显示在约70 000处有特异性条带,表明重组融合蛋白F1L-Fe已获得准确表达且能够被ORFV 阳性血清特异识别(图5A)。用鉴定正确的重组融合蛋白免疫小鼠,第四次免疫后7 d,采血并分离小鼠血清,将该血清作为一抗,以纯化后的重组融合蛋白F1L-Fe作为抗原,Western-blot 分析鉴定结果表明,获得的鼠源多克隆抗体血清能够与重组融合蛋白F1L-Fe发生特异性反应(图5B)。
3讨论
羊口疮病主要病症是在患病羊的口唇、颚及舌面等大量长出水疱丘疹,水疱部位会出现结痂从而引起患病羊进食困难,消瘦、抵抗力下降甚至死亡 [10]。目前该病在中国养羊区流行普遍,又属于人畜共患病,不仅感染羊,也威胁了养殖人员的健康,因此羊口疮病的暴发与流行对中国养殖业的发展及人类的健康都有严重的威胁。目前,羊口疮病的暴发趋势逐年上升,但对该病的治疗尚无特效方法,国内外在防控方面上主要以接种羊口疮弱毒活疫苗的方法进行预防,但是仍然不能预防和控制该病[11-12]。
据调查,亚单位疫苗的安全性和效率通常需要通过佐剂来改善,在此铁蛋白纳米颗粒疫苗提供了另一种辅佐免疫原的思路[13]。此外还有研究报道,铁蛋白的纳米颗粒疫苗能够有效地改善流感病毒疫苗免疫的效力和广度[14]。据研究,高度有序重复的结构形式可以诱导更强的免疫应答,因此铁蛋白纳米笼可以通过在其外表面上有序地展示多种抗原来增强抗原的免疫原性[15]。
本研究将ORFV F1L蛋白与Fe蛋白融合,但通常2个蛋白质结构域之间可能存在结构的扰动,从而引起融合蛋白质的不稳定性,产生错误折叠成为异构产物,导致生物学活性受损以及表达率下降[16-17]。在此,Linker蛋白可能成为2个蛋白质之间有效的连接工具,可在结构域之间供应适当的间距以降低其干扰,恢复甚至改善折叠,允许体内释放游离蛋白质药物结构域以改善生物活性[18]。本研究选择以Gly和Ser为组合的柔性接头,以及亲水性的氨基酸来提供结构柔性,以此来改善融合蛋白F1L-Fe的表达率和生物学活性。
F1L基因作为ORFV新型疫苗研究中的一个重要免疫原性基因[19],本试验选择F1L基因作为预防羊口疮的候选疫苗,并将铁蛋白作为其免疫佐剂,通过SGG的Linker蛋白联接。在本试验中我们首次将羊口疮F1L蛋白与铁蛋白利用融合PCR进行融合,然后将其与pET-32a载体连接起来,成功构建可表达F1L-Fe融合蛋白的原核表达载体pET-F1L-Fe,SDS-PAGE分析结果表明,pET-F1L-Fe原核表达载体在大肠杆菌感受态细胞中成功且大量表达了F1L-Fe重组融合蛋白, 其中通过SDS-PAGE分析试验可以看出F1L-Fe蛋白的表达量很高,说明铁蛋白可能存在促进F1L蛋白表达的作用,但有待后续研究。最后我们获得了F1L-Fe融合蛋白的多克隆抗体,Western-blot鉴定结果表明其具有良好的反应原性。本研究首次选择了F1L蛋白与铁蛋白通过Linker蛋白进行融合,初步构建了F1L-Fe蛋白纳米颗粒以及获得了其多克隆抗体,为后续羊口疮亚单位疫苗的研发奠定了物质基础。
参考文献:
[1]陳溥言. 兽医传染病学[M]. 北京:中国农业出版社, 2006.
[2]殷震. 动物病毒学[M]. 北京:科学出版社, 1997.
[3]CARGNELUTTI J F, MASUDA E K, MARTINS M, et al. Virological and clinico-pathological Features of ORF virus inFection in experimentally inFected rabbits and mice[J]. Microbial Pathogenesis, 2011, 50(1):56-62.
[4]涂明亮,安维雪,张志丹,等. 羊口疮病毒内蒙株的生物学特性[J]. 中国兽医学报, 2016, 36(8):1349-1353.
[5]王盈盈,贾怀杰,白刚,等. 羊口疮病毒甘肃流行株的分离鉴定及其ORF070基因和ORF109基因的序列分析[J]. 中国兽医科学, 2013(8):782-787.
[6]王晴楠,张凯照,宁章勇. 我国 1984-2014 年羊口疮报道文献的统计分析[J].畜牧与兽医, 2015, 47(9): 111-113.
[7]ZHANG K, LIU Y, KONG H, et al. Comparison and phylogenetic analysis based on the B2L gene[J]. Arch Virol, 2014,159(6):1475-1479.
[8]CZERNY C P, WALDMANN R, SCHEUBECK T. Identification of three distinct antigenic sites in parapoxviruses[J]. Archives of Virology, 1997, 142(4): 807-821.
[9]KARCH C P, BURKHARD P. Vaccine technologies: from whole organisms to rationally designed protein assemblies[J]. Biochem Pharmacol, 2016,120:1-14.
[10]DELHON G, TULMAN E R, AFONSO C L, et al. Genomes of the parapoxviruses ORF virus and bovine papular stomatitis virus[J]. Journal of Virology, 2003, 78(1): 168-177.
[11]SCAGLIARINI A, CIULLI S, BATTILANI M, et al. Characterisation of immunodominant protein encoded by the F1L gene of ORF virus strains isolated in Italy[J]. Archives of Virology, 2002, 147(10): 1989-1995.
[12]CZERNY C P, Waldmann R, Scheubeck T. Identification of three distinct antigenic sites in parapoxviruses[J]. Archives of Virology, 1997, 142(4): 807-821.
[13]KANEKIYO M, WEI C J, YASSINE H M, et al. Self-assembling influenza nanoparticle vaccines elicit broadly neutralizing H1N1 antibodies[J]. Nature ,2013, 499:102-106.
[14]KANEKIYO M, BU W, JOYCE M G, et al. Rational design of an Epstein-Barr virus vaccine targeting the receptor-binding site[J].Cell, 2015, 162:1090-1100.
[15]LI C Q, SOISTMAN E, CARTER D C. Ferritin nanoparticle technology. A new platform for antigen presentation and vaccine development [J]. Ind Biotechnol, 2006,2(2):143-147.
[16]ZHAO H, YAO X, XUE C, et al. Increasing the homogeneity, stability and activity of human serum albumin and interferon-alpha2b fusion protein by linker engineering[J]. Protein Expr Purif, 2008,61:73-77.
[17]BAI Y, SHEN W C. Improving the oral efficacy of recombinant granulocyte colony-stimulating factor and transferrin fusion protein by spacer optimization[J]. Pharm Res, 2006,23:2116-2121.
[18]CHEN X, ZARO J L, SHEN W C. Fusion protein linkers: property, design and functionality[J]. Adv Drug Deliv Rev, 2013,65(10):1357-1369.
[19]PALERMO L M, HAFENSTEIN S L, Parrish C R. Purified feline and canine transferrin receptors reveal complex interactions with the capsids of canine and feline parvoviruses that correspond to their host ranges[J]. Journal of Virology, 2006, 80(17):8482-8492.
(責任编辑:陈海霞)

