CRISPR基因编辑技术及其应用与检测方法
石伟佳 刘芳

摘要:CRISPR/Cas9系统作为一个简单、有效的基因编辑技术,自2012年诞生以来已经成为各个领域的研究热点,被誉为21世纪目前为止生物技术领域的重大突破。本文讨论了CRISPR/Cas9的进展,根据其未来的发展潜力综述了基因编辑技术在植物上的应用前景。
关键词:CRISPR/Cas9;基因编辑;检测方法
中图分类号:S-3 文献标识码:ADOI:10.19754/j.nyyjs.20200229005
收稿日期:2019-12-10
1.1CRISPR/Cas9的发展历程
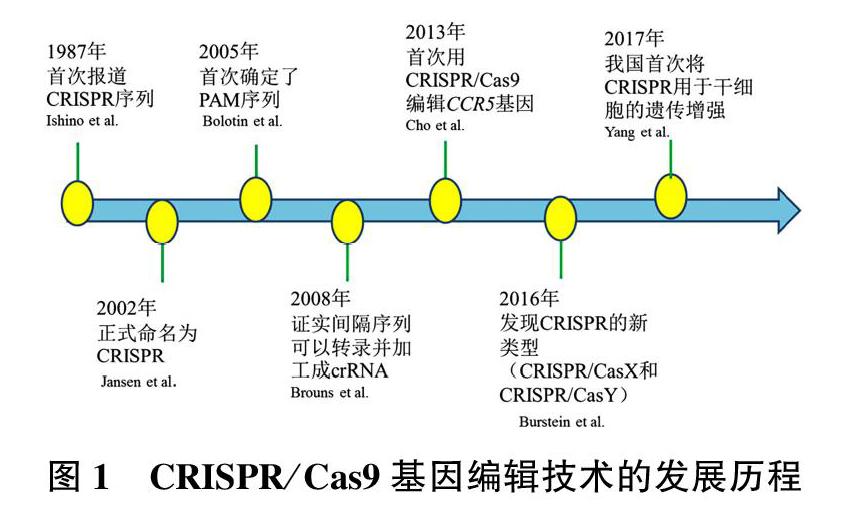
CRISPR/Cas9是一种RNA介导的适应性免疫系统,可以保护细菌和古生菌免受病毒或质粒的侵袭。早在1987年日本研究者在大肠埃希菌编码的碱性磷酸酶基因附近发现了一些短的串联重复序列和间隔序列,但其作用机制还不清楚[1]。随着深入的研究,到2002年,这些特殊的序列被科学家正式命名为CRISPR。发现其可以与附近的Cas蛋白在功能上协同作用[2]。2005年,研究发现成簇间隔的短回文重复序列与免疫功能有关,是细菌在长期进化过程中形成的一种抵御外来DNA入侵的保护机制[3]。随着研究的不断深入,2008年,相关试验证明CRISPR作用在DNA的靶序列上,并证实了间隔序列可以转录加工成为成熟的crRNA [4]。2012年,Jinek等在新型基因编辑技术CRISPR的研究取得巨大进步,其发现了Cas9蛋白,并表示Cas9是TypeⅡ型的标志性蛋白质,由2种RNA指导核酸内切酶对目标DNA结合并进行剪切[5]。2013年,利用CRISPR/Cas9切割人类细胞基因组的CC5基因,并表现出与人工嵌合RNA同样的效果[6]。2016年,在微生物中发现2个新类型的CRISPR-Cas,将其命名为CRISPR/CasX和CRISPR/CasY[7]。2017年,我国科学家首次将基因编辑技术用于干细胞的遗传增强[8]。到目前为止,该技术广泛应用于基因治疗、疾病模型构建、核酸检测、动植物品种培育等领域,CRISPR-Cas9技术的广泛应用证明了这项发明的重要意义。
1.2 CRISPR/Cas9系统的组成与分类
CRISPR/Cas9是由crRNA,反式激活crRNA(trans-activatIngcrRNA, tracrRNA)和Cas蛋白3部分组成,3部分在DNA结构上依次排列并形成tracrRNA,crRNA以及Cas9蛋白形成复合物,使其在特定的靶位点进行切割。Cas9蛋白含有HNH和RuvC功能域,HNH负责剪切与crRNA互补的DNA链,RucV负责剪切双链DNA的另一条链(图3)。由间隔序列相邻基序(protospaceradjacent motIf,PAM)指导Cas9蛋白可以精准的切割外源DNA。PAM位于结合区域的上游并与结合区域相邻,通常是NGG(N为任意核苷酸,G为鸟嘌呤)3个碱基。在实际操作中,为了更加简单的操作,Jinek等通过接头将crRNA和tracrRNA合并成为1条RNA链,从而形成单一指导RNA(single-guideRNA,sgRNA)。人工设计gRNA时,结合的区域也就是20nt,其位于gRNA的5'末端,作为指导序列靶序列互补配对。简单来说,改造后的CRISPR/Cas9系统仅需要在sgRNA指导下,就能完成Cas9蛋白对特定位点的剪切。
CRISPR/Cas9系统可以分为3类,分别是TypeⅠ、TypeⅡ、TypeⅢ,TypeⅠ类型普遍存在于Cas3蛋白,Cas3是一种解旋酶/核酸酶,但是与DNA核酸酶和解旋酶活性不同。TypeⅡ类型是Cas9蛋白所必需的,其包含Ruvc结构域和HNH结构域,这2个结构域对Cas9内切酶活性至关重要。TypeⅢ类型需要大量的RAMP蛋白、Cas6和Cas9蛋白参与到crRNA对目标DNA的切割。TypeⅢ类型不需要识别外源DNA序列上的PAM序列,但仍有降解外源DNA的能力,从而使其成为一个非特异性系统。
1.3CRISPR/Cas9系统作用原理
CRISPR/Cas9可以产生与目标序列互补的RNA序列,并通过碱基互补配对的方式形成RNA-DNA结构,之后,使Cas9核酸内切酶对靶DNA剪切形成双链断裂的DNA(double strand break, DSB)。产生的DSB可以通过同源定向修复(homology-directed repair, HDR)途径修复,也可以通过非同源末端链接(nonhomologous end-joining, NHEJ)途径修复。CRISPR/Cas9系统的作用机制可以总结为以下3步。
1.3.1第1步
外源DNA的入侵,外来的DNA首先被Cas蛋白识别,并随后整合到CRISPR位点的2个相邻的重复序列之间的间隔。
1.3.2第2步
CRISPR-RNA的产生,当外源物质再次入侵时,整合了外源DNA片段的CRISPR基因座转录生成pre-crRNA和tracrRNA,pre-crRNA被核酸酶Ⅲ与tracrRNA切割形成成熟的cr-RNA[9]。
1.3.3第3步
CRISPR/Cas9系统剪接,pre-crRNA和crRNAs形成复合物,通过碱基互补配對原则特异性识别外来的DNA(或RNA),这种复合物降解外来DNA并维持噬菌体的免疫,此外,Cas9蛋白还可以与复合物形成结合,识别外来DNA序列上的PAM序列,行驶剪接功能(图2)。
2CRISPR/Cas9在植物中的应用
2.1基因敲除
CRISPR/Cas9导致特定基因下调或破坏目标基因的表达,在很多植物中成功应用。如在玉米上,美国杜邦公司利用CRISPR/Cas9技术成功敲除玉米中编码淀粉合成酶的糯质基因Wx1,从而培育出新的糯玉米品种[11]。在水稻上,CRISPR/Cas9诱导水稻转录因子编码基因OsERF922的靶向突变,从而增强其对稻瘟病真菌病原体的抗性[10]。利用水稻密码子优化Cas9基因,采用水稻U3启动子启动sgRNA转录,对水稻中的PDS基因定点突变,获得了纯合的基因敲除突变体[6]。在番茄上,用CRISPR/Cas9技术敲除番茄slmapk3基因,相对于野生型植株,突变体表现出严重的叶片枯萎和弯曲,因此可以更深入地了解SlMAPK3基因介导的干旱调控机制[12]。
2.2同时编辑多个基因座
随着CRISPR/Cas9系统的在植物中不断的应用,其可以实现对多个基因同时编辑。该作用的发挥需要Cas9与多种不同的sgRNA融合来实现。如,嵌合导向RNA(cgRNA)可以靶向小麦中2种不同的基因肌醇加氧酶(inositol oxygenase, inox)和八氢番茄红素去饱和酶(phytoene desaturase, pds)基因[13] 。
2.3基因置换
利用CRISPR/Cas9技术可以实现靶基因置换或敲入,将外源DNA整合到基因组中所需的位点。如,将潮霉素磷酸转移酶基因(hygromycin phosphotransferase,HPT)通过同源重组的方法成功整合到大豆的第4条染色体上[14]。基因置换可以通过Cas9-sgRNA载体共转化实现,或者通过合成含有供体序列或与单一供体序列的Cas9-sgRNA的表达盒。
2.4产生无标记的转基因植物
转基因可以将外源基因随机的整合到染色体上,还可以通过水平基因转移到同一物种的非转基因植物或者其它物种的植物上。然而,CRISPR/Cas9基因編辑系统可以避免这种现象发生,sgRNA与Cas9形成复合体,指导Cas9对特定序列进行精确突变,其作用对象不是整条染色体。CRISPR/Cas9复合体会在细胞内降解,不会遗传给下一代。已经在小麦中利用CRISPR/Cas9引入DNA或RNA,并通过瞬时转化愈伤组织细胞的方法,可以得到无转基因的、纯合的T0代小麦突变体[15]。
3基因编辑与传统转基因技术的比较
转基因技术(Transgentic Technology)是指从植物中分离得到或经过修饰的目的基因导入到植物体内,使其在植物体内稳定表达和遗传。简单说,转基因是将外源DNA随机整合到染色体上,所以,转基因技术无论是在过程中还是在最后得到的植株中都会涉及外源DNA的导入。利用CRISPR/Cas9在最后得到的植株中不存在外源DNA,是将DNA序列插入到染色体的特定位置上与传统的育种方式得到的植株无法区分,所以,基因编辑技术相对更容易被接受且更安全。美国农业部宣布,利用CRISPR/Cas9基因编辑技术的到的蘑菇和玉米不属于转基因监管的范围[16];利用CRISPR/Cas9基因编辑技术可以精确目标位点,使基因型与表型联系起来,减少了筛选转基因植株导致的DNA随机插入的样本数量,从而可以确切的判断基因的功能,使研发时间和成本有所下降。总之,利用基因编辑得到植物中不含有转基因成分,相比之下,更容易被人们接受。
4基因编辑植物检测方法
利用CRISPR/Cas9系统剪切的DNA双链,经过细胞的自我修复,将DNA双链连接起来,没有涉及到外源基因的加入,获得的植物中不带任何标记,与经过基因突变的植物并无明显区别。
目前对基因编辑植物检测最常用的方法是PCR/RE。利用该方法需要满足的条件是gRNA靶序列内存在限制性酶切位点。经基因编辑得到的阳性植株靶序列的酶切位点突变,而不能被内切酶识别,而野生型植株中存在酶切位点可以被相应的酶识别。该方法可以检测单等位基因和双等位基因突变,但是不能区分双等位基因纯合子或杂合突变体[17]。
还有一种检测方法-Sanger测序法,该方法在检测植物编辑中也较为常用。但是该方法只能确定靶序列是否发生突变,不能对突变类型进一步确定。PCR-Sequencing最终也是利用Sanger法,该技术通过对PCR产物测序,对测序结果的峰值进行比较,确定基因组位点是否发生突变[18],虽然这种方法确定突变位点较为精确,但是此方法费时、费力,只适用于对少量的靶位点进行分析,对于公司或者大批量检测基因编辑来说效率不高。
CRISPR/Cas9作为第3代基因编辑系统,近几年的迅速发展和应用领域的拓展,其在基因编辑的精确性和高效性方面已经不可替代,受到科研人员的重视和关注。利用基因编辑技术得到的植物新品种中不存在外源DNA,可以使植物的培育过程更加安全。开发出一个省时、省力、高效的方法来检测基因编辑的植物,这也使科研人员所面临更大的挑战。
5展望
CRISPR/Cas9作为一种操作简单、有效、精确度高的基因编辑技术,广泛应用于各个领域。尽管CRISPR/Cas9被成功用于植物基因组编辑,但也存在很多风险。如,最小化脱靶机制,并阐述这种机制,如何对CRISPR/Cas9系统进行优化,以及开发出一种对植物基因组编辑检测的有效方法。这需要对CRISPR/Cas9系统进行更加深入的研究,以促进CRISPR/Cas9基因编辑技术在未来会创造更大的价值。
参考文献
[1] Ishino Y, Shinagawa H, Makino K, et al. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product [J]. Journal of Bacteriology, 1987, 169(12):5429-5433.
[2] Jansen R, Embden J D, Gaastra W, et al. Identification of genes that are associated with DNA repeats in prokaryotes [J]. Molecular Microbiology, 2002, 43(6):1565-1575.
[3] Bolotin A, Quinqusis B, Sorokin A, et al. Clustered regularly interspaced short palindrome repeats (CRISPRs) have spacers of extrachromosomal origin [J]. Microbiology, 2005, 151(8): 2551-2561.
[4] Brouns S, Jore M, Lundgren M, et al. Small CRISPR RNAs Guide Antiviral Defense in Prokaryotes [J]. Science, 2008, 321(5891): 960-964.
[5] Jinek M, Chylinski K, Fonfara I, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity [J]. Science, 2012, 337(6096): 816-821.
[6] Shan Q, Wang Y, Li J, et al. Targeted genome modification of crop plants using a CRISPR-Cas system [J]. Nature Biotechnology, 2013, 31(8):686-688.
[7] Burstein D, Harrington L, Strutt S,et al. New CRISPR-Cas systems from uncultivated microbes [J]. Nature, 2017, 542(7640): 237-241.
[8] Yang J, Li J, Suzuki K, et al. Genetic enhancement in cultured human adult stem cells conferred by a single nucleotide recoding [J]. Cell research, 2017, 27(9): 1178-1181.
[9] Lander ES. The Heroes of CRISPR [J]. Cell, 2016,164(1-2):18-28.
[10]Wang F, Wang C, Liu P, et al. Enhanced Rice Blast Resistance by CRISPR/Cas9-Targeted Mutagenesis of the ERF Transcription Factor Gene OsERF922 [J]. PLoS One, 2016, 11(4): e0154027.
[11]Chilcoat D, Liu Z B, Sander J . Use of CRISPR/Cas9 for Crop Improvement in Maize and Soybean [J]. Progress in molecular biology and translational science, 2017(149):27-46.
[12]Wang L, Chen L, Li R, et al. Reduced drought tolerance by CRISPR/Cas9-mediated SlMAPK3 mutagenesis in tomato plants [J]. Journal of Agriculture Food Chemistry, 2017, 65(39): 8674-8682.
[13]Upadhyay SK, Kumar J, Alok A, et al. RNA-Guided Genome Editing for Target Gene Mutations in Wheat [J]. G3: Genes|Genomes|Genetics, 2013, 3(12): 2233-8.
[14] Li Z, Liu ZB, Xing A, et al. Cas9-Guide RNA Directed Genome Editing in Soybean [J]. Plant physiology, 2015, 169(2): 960-970.
[15]Zhang Y, Liang Z, Zong Y, et al. Efficient and transgene-free genome editing in wheat through transient expression of CRISPR/Cas9 DNA or RNA [J]. Nature communications, 2016(7):12617.
[16] Peng J, Wang Y, Jiang J, et al. Production of Human Albumin in Pigs Through CRISPR/Cas9-Mediated Knock in of Human cDNA into Swine Albumin Locus in the Zygotes [J]. Scientific Reports, 2015(5):16705.
[17] L Y, Zhu, JK. Precise Editing of a Target Base in the Rice Senome Using a Modified CRISPR/Cas9 System [J]. Molecular Plant, 2017, 10(3): 523-525.
[18] Gao Y, Zhang Y, Zhang D, et al. Auxin binding protein 1 (ABP1) is not required for either auxin signaling or Arabidopsis development [J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(7): 2275-2280.

