g-C3N4/Ti-MOF复合材料的合成及其光催化性能
陈 颖, 翟勃银, 梁宇宁, 梁宏宝
(1.东北石油大学 化学化工学院 石油与天然气化工省重点实验室,黑龙江 大庆 163318; 2.东北石油大学 机械科学与工程学院,黑龙江 大庆 163318)
近年来,天然水体中的有毒重金属离子对环境造成严重的污染已逐渐引起人们的重视。其中从电镀、鞣革、印刷、颜料和金属加工等行业中排放出来的六价铬(Cr(Ⅵ))是地表水和地下水中常见的重金属污染物,其具有高毒性、致癌性和高溶解特性,会对人类健康构成巨大威胁[1]。因此人们使用膜分离、离子交换、化学沉淀、电还原、吸附等多种技术来除去废水中的Cr(Ⅵ)[2-3]。由于三价铬 (Cr(Ⅲ)) 对植物和人类无害,且在中性或碱性溶液中以较为稳定的Cr(OH)3形式存在,因此将 Cr(Ⅵ) 还原成Cr(Ⅲ)被视为对其有效去除措施[4]。
半导体光催化剂还原Cr(Ⅵ)是一种经济有效的方法,且受到广泛关注。金属有机骨架(MOF)是一类由金属离子与有机配体自组装形成的高度多孔晶体材料[5],具有较高比表面积、晶体开放结构、可调节孔径和多功能性等优点,可用于H2储存、CO2捕获催化,制备光学材料等[6];同时,MOF在光诱导催化、CO2还原、有机污染物降解和有机化合物转化等方面有独特应用[7]。MIL-125(Ti) 是一种钛基MOF,由Ti8O8(OH)4-(O2C-C6H5-CO2)6基本单位组成,具有多孔三维准立方四方结构。其光捕获能力差,光催化效果较低。因此,研制优异的可见光响应型钛基MOF材料具有十分重要的意义[8]。研究表明,利用贵金属沉积[9]、无机半导体耦合[10],以及在有机配体中引入有机发色团等手段可提高MIL-125(Ti)光催化效率[11]。其中NH2-MIL-53(Fe)显示了可见光响应下光催化还原Cr(Ⅵ)和分解有机污染物的优异性能[12];六角微米棒MIL-88A对甲基蓝染料(MB)具有足够的稳定性和有效的脱色效果[13];同时一些Zr-MOF也显示出具有降解有机污染物和降低Cr(Ⅵ)浓度的可见光响应光催化作用[14]。
近年来,g-C3N4以其可见光响应能力、易合成、高的化学稳定性和低的经济成本被许多研究者研究[15]。g-C3N4中的C和N原子轨道sp2杂化,垂直于杂化轨道的p轨道内有未成对的单电子,p轨道发生重叠形成π共轭结构。在可见光照射下,带隙较窄的g-C3N4吸收可见光能量形成π→π*跃迁,g-C3N4价带上的电子被激发到导带,同时在价带上留下空穴;但由于其带隙较窄,光生电子-空穴很容易发生复合,导致光生载流子的利用率不高[16]。g-C3N4的带隙约为2.7 eV,可用于水裂解、CO2还原和水中污染物降解等。同时g-C3N4的比表面积相对较低,为10~70 m2/g(具体大小取决于合成方法)[17]。若具有较高的孔隙率和比表面积,则会对污染物的吸附能力增强,从而有利于光催化反应。
笔者采用一种快速微波合成法制备了 g-C3N4/Ti-MOF 纳米复合光催化材料。利用MOF材料的高比表面积和g-C3N4的光响应能力进行互补,以抑制电子-空穴高的复合速率,缩短反应周期。在可见光照射下,对Cr(Ⅵ)在g-C3N4、Ti-MOF 和g-C3N4/Ti-MOF复合材料上进行光催化还原及重复实验,并提出该催化剂光催化还原Cr(Ⅵ)的可能机理。
1 实验部分
1.1 试剂与仪器
钛酸异丙酯、对苯二甲酸、N,N-二甲基甲酰胺(DMF)、甲醇、尿素、K2Cr2O7、二苯基碳酰二肼(DPC)、HCl、H2SO4,均为分析纯,国药集团化学试剂有限公司产品。
SEM/EDS,SIGMA 500(德国卡尔公司产品);X射线衍射仪,D/MAX-2200(日本理学公司产品);傅里叶变换红外光谱仪,Tensor27(德国BRUKER公司产品);孔径比表面积分析仪,SSA-4300(北京彼奥德电子仪器公司产品);紫外可见漫反射,UV-2550(岛津公司产品);紫外-可见分光光度计,UV-2550(上海奥普勒仪器有限公司产品);微波化学反应器,MCR-3(巩义市予华仪器有限公司产品)。
1.2 催化剂的制备
1.2.1 g-C3N4的制备
为防止尿素的升华,采用尿素溶液加热法合成 g-C3N4纳米片[18]。10 g尿素溶于15 mL H2O中,用HCl调节尿素溶液pH值为4~5,将尿素溶液在60 ℃下干燥12 h,然后转至马弗炉中加热至550 ℃,加热速率为10 ℃/min,保持2 h,最后得到超细化的g-C3N4纳米片。
1.2.2 g-C3N4/Ti-MOF的制备
用微波法合成g-C3N4/Ti-MOF。称取一定量的g-C3N4纳米片于20 mL DMF/甲醇体积比为1的混合溶液中,在微波化学反应器中超声分散,将钛酸异丙酯(0.6 mL)、1,4-苯二甲酸(0.3323 g)混合液加入蒸馏烧瓶中搅拌0.5 h,形成均一溶液。再将其置于微波化学反应器中,微波辐射时间和温度分别为40 min和120 ℃。所得的凝胶状沉淀物用DMF多次离心洗涤,为除去多余溶剂,将其置于175 ℃下干燥,最终得到淡黄色产物即为g-C3N4/Ti-MOF。不加 g-C3N4,在相同条件下合成Ti-MOF[19]。
1.3 表征及光催化实验
将制备的Ti-MOF、g-C3N4、g-C3N4/Ti-MOF样品采用SEM/EDS、XRD、FI-IR、BET、UV-Vis-DRS 等手段进行表征。根据文献[20],用硫酸调节Cr(Ⅵ)溶液pH值为2~3,采用1,5-二苯基卡巴肼法(DPC法)测定Cr(Ⅵ)质量浓度(Cr(Ⅵ)还原为Cr(Ⅲ)),对上述反应的光催化效率进行评价。光催化实验如下:取50 mg催化剂样品,将其分散于50 mL质量浓度为10 mg/L的Cr(Ⅵ)溶液中,在黑暗中搅拌2 h,以确保Cr(Ⅵ)在催化剂表面达到吸附-解吸平衡。将混合溶液置于500 W的氙灯下进行可见光降解,同时定时收集适量溶液离心分离,利用二苯碳酰二肼法(DPC)分光光度法在最大吸收波长540 nm处检测Cr(Ⅵ)质量浓度。根据公式(1)计算出Cr(Ⅵ)的去除率(η):
(1)
式中,C0和Ct分别为吸附平衡后(即反应起始时间,t=0)和t时的Cr(Ⅵ)的质量浓度,mg/L。
此外,测试g-C3N4/Ti-MOF复合材料的可循环使用性。该过程与前面提到的可见光活性测试类似。每次光催化剂循环使用后,分离并进行洗涤,以达到去除残留Cr(Ⅵ)的目的,然后在80 ℃下干燥10 h后,可继续进行下一步的测试。
2 结果与讨论
2.1 复合材料的物性表征
2.1.1 晶相结构
图1为Ti-MOF、g-C3N4和g-C3N4/Ti-MOF复合样品的XRD图谱。由图1可见,Ti-MOF和 g-C3N4的衍射峰与文献[21-22]报道的Ti-MOF和g-C3N4的衍射峰完全一致,表明成功合成了单一光催化剂。在g-C3N4样品(JCPDS No.87-1526)中,13.06°和27.47°处的衍射峰对应于(100)和(002)晶面。这是由于芳香烃段的面内结构堆积和层间堆积
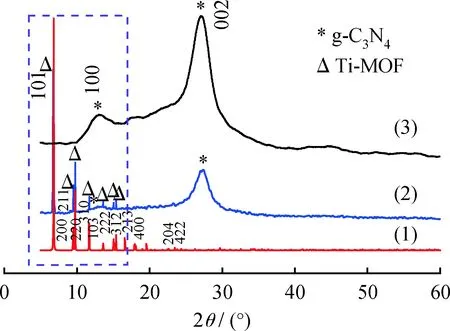
图1 Ti-MOF、g-C3N4/Ti-MOF及g-C3N4样品的XRD谱图Fig.1 XRD patterns of Ti-MOF, g-C3N4/Ti-MOF andg-C3N4 samples(1) Ti-MOF; (2) g-C3N4/Ti-MOF; (3) g-C3N4
所造成的[23]。在Ti-MOF样品谱图中,位于6.80°、9.48°、11.66°的衍射峰归属于Ti-MOF[24]的特征峰。g-C3N4/Ti-MOF样品的XRD谱图中存在纯 Ti-MOF 和g-C3N4的特征峰,说明引入g-C3N4纳米薄层后,Ti-MOF的晶体结构并没有发生较大变化,表明成功制备了g-C3N4/Ti-MOF复合材料。
2.1.2 粒子形貌
图2为Ti-MOF、g-C3N4和g-C3N4/Ti-MOF样品的形貌图和g-C3N4/Ti-MOF样品的EDS谱图。由图2(a)可知: Ti-MOF样品呈不规则块状粒子,与文献[21]报道的Ti-MOF的形貌是一致的;由图2(b)可以看出,g-C3N4呈现出清晰的二维薄片状结构;由图2(c)可以看出,薄层状g-C3N4的引入导致Ti-MOF的结构更趋向于不规则,并清晰观察到其表面有粗糙片状g-C3N4的存在,最终形成g-C3N4/Ti-MOF不规则块状产物。复合材料的微观区域元素分布是通过EDS测试的,结果如图2(d)所示。EDS谱图中存在O、C、N和Ti元素的强信号,不存在杂质峰,表明样品中只含有Ti、O、C和N等元素,结合XRD和SEM,可知g-C3N4/Ti-MOF复合材料的形成。
2.1.3 红外谱图
图3中给出了Ti-MOF、g-C3N4和g-C3N4/Ti-MOF样品的红外光谱图。由图3可见,对于Ti-MOF,以3300 cm-1为中心的大宽峰归属于吸附孔内的自由溶剂分子;在1662和1408 cm-1处的强峰属于骨架的伸缩振动,证实了Ti-MOF骨架中存在二羧酸键;1013和740 cm-1处的峰归属于苯环的伸缩振动。图3曲线(1)和(2)中,400~800 cm-1归属于O—Ti—O的伸缩振动[25]。对于g-C3N4,可以清楚地观察到3个主要吸收区,3000~3500 cm-1的宽峰是由尿素的不完全缩聚与吸附在g-C3N4表面的水分子所产生的N—H和O—H伸缩振动引起;在1662、1408和1245 cm-1附近的特征峰为碳氮化物杂环的伸缩振动。在图3曲线(1)和(3)中,809 cm-1处观察到的尖峰属于三嗪环[26]的弯曲振动模式。此外,对于g-C3N4/Ti-MOF,可以清楚地观察到Ti-MOF光谱中的主要特征峰。同时Ti-MOF中1000~1200 cm-1处的原始特征峰弱化,在g-C3N4/Ti-MOF中形成宽带。这表明Ti-MOF和 g-C3N4之间存在相互作用力。因此,变化的FT-IR峰值证实了g-C3N4与Ti-MOF的成功整合,为后续研究提供理论基础。

图2 Ti-MOF、g-C3N4、g-C3N4/Ti-MOF的SEM照片和g-C3N4/Ti-MOF的EDS谱图Fig.2 SEM images of Ti-MOF, g-C3N4, g-C3N4/Ti-MOF and EDS spectrum of g-C3N4/Ti-MOFSEM: (a) Ti-MOF; (b) g-C3N4; (c) g-C3N4/Ti-MOF;(d) EDS spectrum of g-C3N4/Ti-MOF
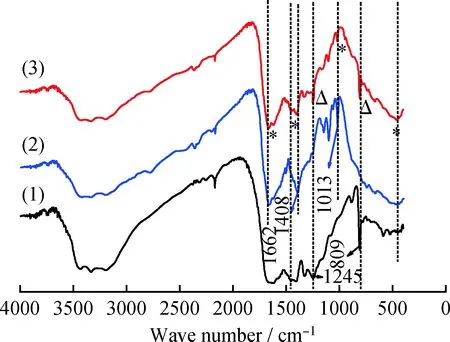
图3 g-C3N4、Ti-MOF及g-C3N4/Ti-MOF复合材料的FI-IR谱图Fig.3 FT-IR spectra of g-C3N4, Ti-MOF andg-C3N4/Ti-MOF composite materials(1) g-C3N4; (2) Ti-MOF; (3) g-C3N4/Ti-MOF
2.1.4 比表面积和孔径分布
表1为不同样品的比表面积、孔径和孔体积。Ti-MOF、g-C3N4和g-C3N4/Ti-MOF样品的N2吸附-脱附分析如图4所示。光催化剂较高的比表面积有利于光催化反应。Ti-MOF的BET比表面积为445 m2/g,且为第Ⅳ型等温吸附曲线,说明其为介孔材料。g-C3N4/Ti-MOF的比表面积为301 m2/g,低于Ti-MOF而高于g-C3N4;g-C3N4/Ti-MOF的平均孔径为3.62 nm,较于Ti-MOF(3.74 nm)的平均孔径小。这可能是部分MOF孔隙被g-C3N4堵塞导致,也可能是在MOF合成的前驱物中引入g-C3N4并不能阻止或影响 Ti-MOF 晶体的形成[27]。同时复合催化剂的比表面积远大于g-C3N4,表示复合催化剂在光催化过程中能够提供更多的反应活性位点,有效加快光催化反应过程,提高反应速率[28]。
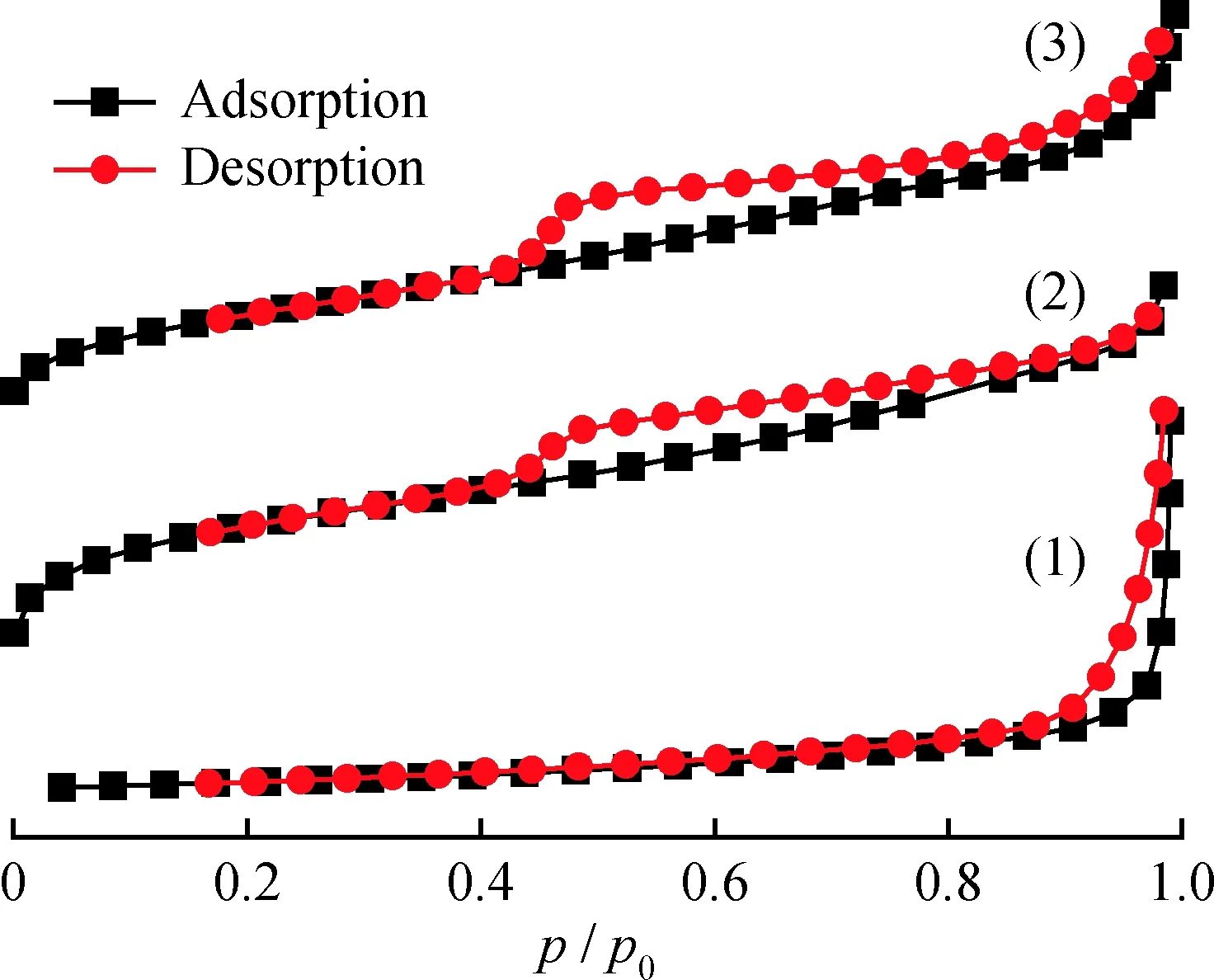
图4 Ti-MOF、g-C3N4及g-C3N4/Ti-MOF复合材料的N2吸附-脱附等温线Fig.4 Nitrogen adsorption-desorption isotherms of Ti-MOF,g-C3N4 and g-C3N4/Ti-MOF composite materials(1) g-C3N4; (2) Ti-MOF; (3) g-C3N4/Ti-MOF
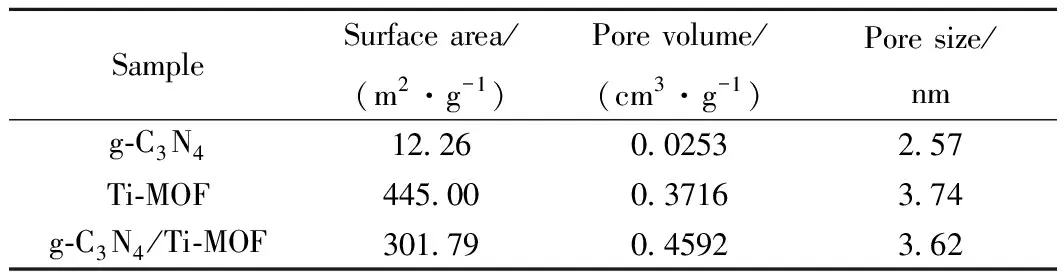
表1 不同样品的比表面积、孔径和孔体积Table 1 Specific surface area, pore size distribution andpore volume of different samples
2.1.5 光吸收性质
图5为Ti-MOF、g-C3N4和g-C3N4/Ti-MOF样品的紫外-可见漫反射光谱(UV-Vis DRS)图。由图5可知,Ti-MOF和g-C3N4的吸收波长为 400 nm 和 436 nm,而g-C3N4/Ti-MOF复合材料对光的吸收能力明显高于纯Ti-MOF和g-C3N4。利用αhν=k(hν-Eg)1/n估算了光催化剂的能隙(Eg)[29],其中α、h、ν、Eg和k分别表示吸收系数、Plank常数、光频率、能隙和k常数;n的值由半导体的光跃迁类型决定,在间接过渡半导体的情况下,取n值为2。Ti-MOF、g-C3N4和g-C3N4/Ti-MOF光催化剂的能隙分别为3.10、2.84和2.71 eV。图5表明,引入g-C3N4后,Ti-MOF的能隙趋于变窄,光吸收强度增大,表明复合材料的光响应范围有所扩大,且对可见光的利用率有所提高,从而有效改善Ti-MOF和 g-C3N4的光催化性能[30]。
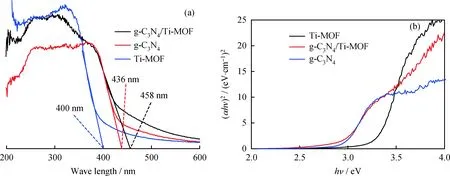
图5 g-C3N4、Ti-MOF及g-C3N4/Ti-MOF复合材料的紫外可见漫反射光谱图和(αhν)2与光子能量(hν)之间的关系图Fig.5 UV-Vis diffuse reflectance absorption spectra of g-C3N4, Ti-MOF and g-C3N4/Ti-MOFcomposite materials and relationship between (αhν)2 and photo energy (hν)(a) UV-Vis DRS spectra; (b) (αhν)2 vs hν
2.2 光催化活性评价
2.2.1 不同催化剂对光催化还原Cr(Ⅵ)性能的影响
用光催化还原Cr(Ⅵ)实验评价了g-C3N4、Ti-MOF、g-C3N4/Ti-MOF的光催化性能,结果如图6所示。由图6(a)可见,g-C3N4/Ti-MOF复合材料在150 min内,Cr(Ⅵ)的去除率(η)达92%,具有较好的光催化活性,其可能原因是光生载流子的迅速转移和光吸收能力的增强所致。采用伪一阶法对催化剂的光催化性能进行量化及研究Cr(Ⅵ)降解的一级动力学,见图6(b)。ln(C0/Ct)=Kt(其中K表示时间t时的伪一级速率常数)为还原Cr(Ⅵ)的伪一阶模型。在相同条件下,Cr(Ⅵ)在g-C3N4/Ti-MOF的伪一阶动力学速率常数为0.0143,分别是纯Ti-MOF(K=0.00092)和g-C3N4(K=0.0057)的15倍和2.5倍。显然,与Ti-MOF和g-C3N4相比,g-C3N4/Ti-MOF具有更好的还原性能。这表明有效的电子转移可以降低电子空穴对的复合,使得电子迁移效率得以提高,同时对光催化效率起着重要的作用。
2.2.2 g-C3N4/Ti-MOF光催化还原不同水体中Cr(Ⅵ)的性能
为了探究g-C3N4/Ti-MOF复合材料的实际应用性能,以某工厂废水作为处理对象,采用GB 7466—87《水质总铬的测定》法测定废水的总Cr(Ⅵ)质量浓度为1.78 mg/L。使用超纯水和K2Cr2O7制备与废水含Cr(Ⅵ)质量浓度相同的模拟废水,在同一条件下测定,以探究废水中其他金属粒子或COD(化学需氧量)等对光催化还原的影响,结果见图7。投加0.02 g g-C3N4/Ti-MOF样品,测定方法与光催化还原Cr(Ⅵ)实验步骤相同。由图7可知:在150 min内,g-C3N4/Ti-MOF对真实废水中Cr(Ⅵ)的去除率(η)低于对模拟废水中Cr(Ⅵ)的去除率,但具有较好的光催化活性。其可能原因是工业废水中常见的Cu2+、Ni2+等离子具有未充满的d轨道,形成空穴,具有得电子的能力,为Cr(Ⅵ)传递光生电子提供了桥梁,促进Cr(Ⅵ)的还原,但由于有机物含量高或难以氧化,空穴和电子均参与有机物的氧化反应,抑制了Cr(Ⅵ)的还原,若有机物对Cr(Ⅵ)还原的抑制作用大于水体中离子对Cr(Ⅵ)还原的促进作用,则使得真实废水中Cr(Ⅵ)的去除率低于模拟废水中的。但最终得到的废水中Cr(Ⅵ)质量浓度均小于0.5 mg/L,符合《国家工业废水排放标准》。综上所述,g-C3N4/Ti-MOF复合材料在处理真实废水方面仍有较好的光催化效率,具有一定的实用性。

图6 可见光下不同催化剂还原Cr(Ⅵ)光催化活性的比较和相应的伪一阶动力学模型Fig.6 The comparison of the photocatalytic reduction Cr(Ⅵ) activity of the different samples under thevisible light irradiation and the corresponding pseudo first-order kinetic modelm(Catalyst)=0.05 g;Reduction temperature of 25 ℃;Light source is visible light.(a) Photocatalytic reduction Cr(Ⅵ) activity; (b) Pseudo first-order kinetic model

图7 可见光下g-C3N4/Ti-MOF光催化还原不同含Cr(Ⅵ)废水的性能比较Fig.7 Performance comparison of photocatalytic reduction ofdifferent wastewater containing different Cr(Ⅵ) content byg-C3N4/Ti-MOF under the visible lightm(Catalyst)=0.02 g;Reduction temperature of 25 ℃;Light source is visible light.
2.3 光催化剂g-C3N4/Ti-MOF的再生和可重用性
为了评价该催化剂的实际应用价值,考察了g-C3N4/Ti-MOF材料的重复使用性能,结果如表2所示。由表2可见,当4次循环还原Cr(Ⅵ)后,光催化剂的催化性能微弱下降,可能是因为在每次反应后对催化剂都会进行清洗和离心回收,从而造成损失,也可能是循环使用后的催化剂表面结构或者孔结构破坏等原因导致的循环后催化效率有所降低,但其仍能保持较高的光催化活性。综上说明,g-C3N4/Ti-MOF 复合催化剂是一种可循环利用的催化剂。

表2 可见光下g-C3N4/Ti-MOF光催化还原Cr(Ⅵ)的使用寿命Table 2 Operating life of photocatalytic reduction Cr(Ⅵ) ofg-C3N4/Ti-MOF under the visible light
2.4 g-C3N4/Ti-MOF光催化反应机理初探
根据以上动力学分析以及相关文献,推测可能的g-C3N4/Ti-MOF光催化反应机理如图8所示。在光照射下,g-C3N4价带(VB)中的电子很容易被光激发到导带(CB)上,留下空穴(h+)。根据文献[31],Ti-MOF的导带值约为-0.43 eV(vs NHE)(其中NHE代表标准氢电极),低于g-C3N4(-1.13 eV vs NHE)[32]。因此光生电子能从g-C3N4的CB转移到Ti-MOF中。并且,光生电子可以在Ti-MOF的钛氧簇中迁移到Ti4+上,从而使Ti4+还原为Ti3+。MOF中钛氧团簇中的Ti3+-Ti4+间的电子转移已被先前的报道所证实[33]。由于Ti3+具有很强的还原电位,导致Cr(Ⅵ)在酸性介质下还原为Cr(Ⅲ)。光生电子具有较强的还原能力(ECB=-0.52 eV)(ECB为导带电势),它能还原吸附在催化剂表面的Cr(Ⅵ)(ECr(Ⅵ)/Cr(Ⅲ)=+0.57 eV vs NHE,ECr(Ⅵ)/Cr(Ⅲ)为Cr(Ⅵ)的还原电势)[34]。同时,水分子可以被空穴氧化,并不需要额外的捕获剂[35-36]。因此g-C3N4/Ti-MOF催化剂中的光生载流子得以有效分离,大大增强光催化活性。
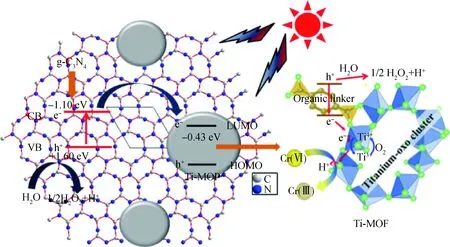
图8 可见光照射下g-C3N4/Ti-MOF纳米复合材料还原Cr(Ⅵ)的示意图Fig.8 A schematic illustration of the reduction of Cr(Ⅵ) over g-C3N4/Ti-MOF nanocomposite under the visible light irradiationCB—Conduction band; VB—Valence band
3 结 论
采用快速微波合成法制备了一种可见光响应光催化剂g-C3N4/Ti-MOF。通过一系列表征得知其为不规则块状颗粒,具有较大的比表面积,与Ti-MOF和g-C3N4相比较,其在可见光下150 min内能还原92%的Cr(Ⅵ)。同时,其光催化性能得到提高。这可能归因于Ti-MOF具有大的比表面积,使Cr(Ⅵ)能在较大程度上吸附在复合催化剂上,利于光催化还原过程。此外,g-C3N4与Ti-MOF之间的协同效应增强了光的吸收和光生载流子的有效分离,从而加快了Cr(Ⅵ)的光催化还原效率。循环实验结果表明,g-C3N4/Ti-MOF光催化剂具有良好的可重用性。这些发现为进一步开发涉及高效率无金属半导体/MOF光催化剂提供了参考。

