利用Ce2S3对70Li2S-30P2S5玻璃陶瓷态电解质掺杂改性的研究
张 楠,钟学奇,丁 飞,赵旭升,刘兴江,徐 强
(1.天津大学 化工学院,天津 300072;2.中国电子科技集团公司第十八研究所物理与化学电源国防重点实验室,天津 300384;3.青海民族大学 化学化工学院,青海 西宁 810007)
1 前 言
由于具有能量密度较高和循环寿命较长等优点,锂离子电池已经发展成为当今日常生活中的一种重要储能器件。同时,随着新能源汽车和大型储能装置等领域的快速发展,锂离子动力电池将会得到更加广阔的应用空间[1]。传统的锂离子电池使用有机电解液,具有易燃、易爆和易腐蚀等风险,并且很难采用锂金属作为负极,限制能量密度的进一步提高。而使用固体电解质替代有机电解液的全固态锂电池则有希望解决上述的问题[2-3]。固体电解质是全固态锂电池的关键材料,同时起到传导锂离子和防止短路的作用。目前,固体电解质主要包括聚合物固体电解质、无机固体电解质和复合固体电解质3大类。其中,无机固体电解质又可以分为氧化物体系和硫化物体系,由于硫化物固体电解质具有极高的离子电导率,因此受到国内外研究者的极大关注[4-6]。
硫化物固体电解质主要包括3种类型,即2种晶态体系——硫代锂超离子导体(thio-LISICON)和硫银锗矿型Li6PS5X(X=Cl,Br,I)电解质,以及另一种玻璃陶瓷态体系——Li2S-P2S5基电解质[7]。与前2种晶态硫化物固体电解质相比,Li2S-P2S5基玻璃陶瓷态电解质的制备条件更加温和,并且具有较好的机械性能和较小的晶界电阻[8-11]。ZHANG等[12]研究了xLi2S-(100-x)P2S5(65≤x≤75)玻璃陶瓷态电解质x值对离子电导率的影响,研究发现70Li2S-30P2S5玻璃陶瓷态电解质可以表现出最高的离子电导率。SEINO等[13]研究发现,热压致密的70Li2S-30P2S5玻璃陶瓷态电解质的离子电导率甚至可以达到1.7×10-2S⋅cm-1。然而,二元体系的Li2S-P2S5玻璃陶瓷态电解质在冷压条件下的离子电导率仍然有待提高。许多研究结果表明,掺杂改性是一种提高硫化物固体电解质离子电导率的有效方法。在Li2S-P2S5体系的玻璃陶瓷态电解质中掺杂离子半径较大的元素化合物后,可以使这种材料产生晶格畸变,增加锂离子传输通道。目前,已有文献报道的掺杂化合物包括 Li3PO4[14],Li2ZrO3[15],Li3N[16],LiX(X=F,Cl,Br,I)[17],P2O5[18],Sb2O5[19],ZnO[20]和 MoS2[21]等。
稀土元素的原子半径较大,并且少量稀土元素的加入可以极大改善材料的性能,在很多工业领域得到广泛的应用,被称为“工业味精”[22]。为了进一步提高70Li2S-30P2S5玻璃陶瓷态电解质的电化学性能,寻找更加优异的掺杂化合物,本文选择Ce2S3作为掺杂组分,对70Li2S-30P2S5玻璃陶瓷态电解质进行改性研究。通过高能球磨法结合热处理工艺制备了一系列不同掺杂比例的 Li2S-P2S5基玻璃陶瓷态电解质,并且对这一系列材料进行了系统的理化表征。比较了改性前后的Li2S-P2S5基玻璃陶瓷态电解质的离子电导率及其组装成全固态锂电池后的放电性能。
2 实验部分
2.1 Li2S-P2S5基玻璃陶瓷态电解质的制备
将 Li2S,P2S5和 Ce2S3作为原材料,按照一定的摩尔比例在球磨罐中混合均匀。在球磨罐中加入的总物料为2 g,球料比约为15:1。将球磨罐固定在高能球磨机(Fritsch Pulverisette 5)上进行球磨,转速设定为300 r⋅min-1,球磨时间为35 h。球磨结束后,将材料取出并研磨,形成比较均匀的无定形(玻璃态)粉末。将粉末压片后放置在坩埚中,在微型箱式炉中恒温热处理一段时间,等炉温降至室温后,取出片状的电解质材料,研磨成粉末并装瓶。最终制备得到一系列组分为70Li2S-(30-x)P2S5-xCe2S3(x=0,0.5,1,2,3)的玻璃陶瓷态电解质材料。上述所有操作均在充满氩气的手套箱(H2O<0.1×10-6,O2<0.1×10-6)中进行。
2.2 Li2S-P2S5基固体电解质的表征
采用差示扫描量热仪( SETARAM,SETSYS Evolution TG/DSC 16,DSC)测得不同组分的玻璃态电解质粉末的DSC曲线,分析不同组分的玻璃态电解质样品的晶化温度,从而确定出最佳的热处理温度。在手套箱中将适量样品密封在铝坩埚里,拿出手套箱立即进行测试。在氮气保护下从室温升至350 ℃,升温速率为 5 ℃⋅min-1。
使用X射线衍射仪( Rigaku,TTRIII,XRD)分析不同组分的玻璃陶瓷态电解质的晶相结构。在手套箱中制好样品后,将载玻片压在上面并放入密封袋中,拿出手套箱立即进行测试。靶材采用铜靶,扫描范围 2θ为 10°~60°,扫描速度为 5 °⋅min-1。
采用拉曼光谱分析仪( LabRAM HR Evolution,HORIBA)测得不同组分的玻璃陶瓷态电解质的拉曼谱图,分析不同组分的玻璃陶瓷态电解质的分子结构。在手套箱中将样品密封在2块载玻片之间,拿出手套箱立即进行测试。选用的激光波长为532 nm。
利用扫描电子显微镜(HITACHI,S-4800,SEM)观察不同组分的玻璃态和玻璃陶瓷态电解质的表面形貌。在手套箱中将样品粉末固定在粘有导电胶的SEM测试专用台上,放入密封袋中,拿出手套箱立即进行测试。
通过电化学工作站(PARSTAT 2273)测得室温下不同组分的玻璃陶瓷态电解质的电化学阻抗谱(EIS)。在特定模具中将电解质粉末冷压成直径为10 mm,厚度约为1 mm的电解质片,两边贴合的不锈钢片作为阻塞电极,测试频率范围为1 MHz~10 Hz,正弦波振幅为10 mV。根据谱图和公式计算样品的离子电导率,计算公式如下:

2.3 全固态锂电池的组装与测试
在研钵中分别加入质量比为8:3的钴酸锂和Li2S-P2S5基玻璃陶瓷态电解质,研磨约0.5 h后得到复合正极材料。负极材料采用锂铟合金,其中锂的质量比约为5%。在组装全固态锂电池时,先将100 mg玻璃陶瓷态电解质倒入特定模具中,在油压机上加压为240 MPa,保压3 min,再将3~5 mg复合正极材料均匀铺在电解质的一端,用不锈钢片作为集流体,在240 MPa下保压3 min,最后将锂铟合金放置在电解质的另一端,同样采用不锈钢片作为集流体,在240 MPa下保压5 min,将特定模具用4根螺丝固定后得到组装完成的全固态锂电池。
全固态锂电池的充放电测试在蓝电电池测试系统(CT2001A)中进行,在室温条件下,充放电电压范围为2.0 ~3.8 V,充放电倍率为0.1C(充放电电流/额定容量)。通过电化学工作站(PARSTAT 2273)测试不同全固态锂电池循环50圈后的电化学阻抗谱,测试频率范围为1 MHz~0.1 Hz,正弦波振幅为10 mV。
3 结果与讨论
3.1 热处理工艺的优化
图1 是 70Li2S-(30-x)P2S5-xCe2S3(x=0,0.5,1,2,3)玻璃态电解质的DSC曲线。从图1中可以看出,每条曲线上都有2个放热峰,第1个峰对应晶体成核的放热效应,第2个峰对应晶体生长的放热效应[11]。此外,掺杂 Ce2S3后的 Li2S-P2S5基玻璃态电解质的晶化温度向高温方向偏移,这表明掺杂Ce2S3会影响 Li2S-P2S5基玻璃态电解质的晶化过程。为了使Li2S-P2S5基玻璃态电解质的晶化过程进行得更加完全,本实验将DSC曲线第2个放热峰结束时的温度确定为最佳的热处理温度。因此,70Li2S-30P2S5玻璃态电解质的热处理温度为260 ℃,而掺杂不同比例Ce2S3的Li2S-P2S5基玻璃态电解质的热处理温度为280 ℃。
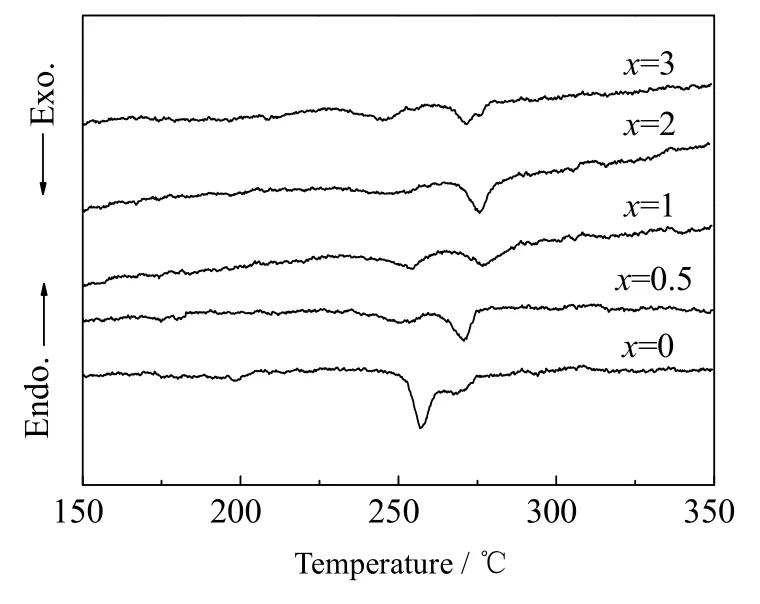
图1 70Li2S-(30-x)P2S5-xCe2S3 (x=0,0.5,1,2,3)玻璃态电解质的DSC曲线Fig.1 DSC curves of 70Li2S-(30-x)P2S5-xCe2S3(x=0,0.5,1,2,3) glass electrolytes
图2是经过不同热处理时间得到的70Li2S-30P2S5固体电解质的EIS谱图,根据EIS谱线与横轴的交点坐标可以确定70Li2S-30P2S5固体电解质的电阻。由图2可知,经过合适的热处理时间形成的玻璃陶瓷态电解质的电阻明显小于未经过热处理的玻璃态电解质的电阻,其中热处理1 h得到的玻璃陶瓷态电解质的电阻最小。根据离子电导率公式计算可得,未经过热处理的玻璃态电解质的离子电导率为0.13×10-3S⋅cm-1,热处理 0.5 h得到的玻璃陶瓷态电解质的离子电导率为0.45×10-3S⋅cm-1,热处理1 h得到的玻璃陶瓷态电解质的离子电导率为0.81×10-3S⋅cm-1,热处理2 h得到的玻璃陶瓷态电解质的离子电导率为0.21×10-3S⋅cm-1,热处理3 h得到的玻璃陶瓷态电解质的离子电导率为0.10×10-3S⋅cm-1。70Li2S-30P2S5固体电解质的离子电导率与热处理时间的关系如图3所示。这些结果表明,合适的热处理时间可以明显提高玻璃态电解质的离子电导率。这主要是因为70Li2S-30P2S5玻璃态电解质在热处理过程中会形成Li7P3S11快离子导体,降低了锂离子跃迁的活化能,提高了锂离子的运动性[9]。值得注意的是,当热处理时间大于1 h时,玻璃陶瓷态电解质的离子电导率会逐渐减小,甚至会小于未经过热处理的玻璃态电解质的离子电导率。这是由于超过一定时间的热处理会导致材料中高温不稳定的 Li7P3S11快离子导体发生分解,生成稳定的高温不导电相Li4P2S6,并且这种不导电相的含量随着热处理时间的延长而增加,导致玻璃陶瓷态电解质的离子电导率逐渐降低[15]。因此,Li2S-P2S5基玻璃态电解质的最佳热处理时间为1 h。
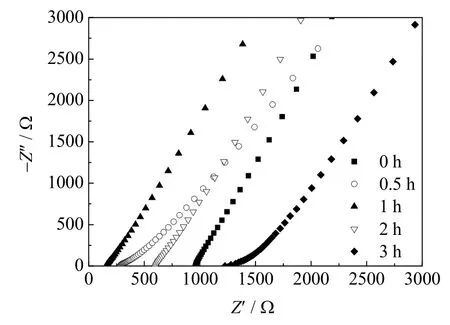
图2 不同热处理时间的70Li2S-30P2S5固体电解质的EIS谱图Fig.2 EIS results of 70Li2S-30P2S5 solid electrolytes with different heat-treatment times

图3 70Li2S-30P2S5固体电解质的离子电导率与热处理时间的关系图Fig.3 The relationship between ionic conductivities and heat-treatment time of 70Li2S-30P2S5 solid electrolytes

图4 70Li2S-(30-x)P2S5-xCe2S3 (x=0,0.5,1,2,3)玻璃陶瓷态电解质的XRD谱图Fig.4 XRD patterns of 70Li2S-(30-x)P2S5-xCe2S3 (x=0,0.5,1,2,3)glass-ceramic electrolytes
3.2 Li2S-P2S5基固体电解质的表征结果
图4 是 70Li2S-(30-x)P2S5-xCe2S3(x=0,0.5,1,2,3)玻璃陶瓷态电解质的XRD谱图。由图4可知,当x=0时,XRD谱线的特征峰与 Li7P3S11快离子导体的特征峰基本一致。表明经过热处理后,在70Li2S-30P2S5玻璃态电解质中形成了 Li7P3S11快离子导体[8]。随着x值的增大,XRD谱线在保持原有 Li7P3S11的特征峰的基础上,逐渐出现了一些Ce2S3的特征峰,说明经过高能球磨和热处理后,Ce2S3已经被成功地掺杂入70Li2S-30P2S5玻璃陶瓷态电解质基体中。当x=3时,Ce2S3的特征峰强度达到最大,而Li7P3S11的特征峰发生了少许偏移,表明掺杂过多的 Ce2S3会使70Li2S-30P2S5玻璃陶瓷态电解质材料产生较大的晶格畸变。

图5 70Li2S-(30-x)P2S5-xCe2S3 (x=0,0.5,1,2,3)玻璃陶瓷态电解质的拉曼光谱图Fig.5 Raman spectra of 70Li2S-(30-x)P2S5-xCe2S3(x=0,0.5,1,2,3) glass-ceramic electrolytes
图5 是 70Li2S-(30-x)P2S5-xCe2S3(x=0,0.5,1,2,3)玻璃陶瓷态电解质的拉曼光谱图。由图5可知,这一系列玻璃陶瓷态电解质均主要包含P2S74-,PS43-和P2S64-离子[21],出峰位置分别在406、423和387 cm-1。值得注意的是,随着x值的增加,P2S74-离子的峰强逐渐减弱,PS43-离子的峰强逐渐增强,这表明Ce2S3的掺杂会导致材料的分子结构发生变化,过量掺杂Ce2S3会使材料倾向于形成更多的PS43-离子,而使Li7P3S11快离子导体的分子结构发生严重的变化。产生这种情况的原因是Ce2S3对P2S5的取代掺杂并不是化学计量比对等的,会使材料中出现硫缺陷,适量的硫缺陷对于离子电导率的提高是有利的[23],但是过量掺杂 Ce2S3会导致材料中出现较多的硫缺陷,使得材料的分子结构从以P2S74-离子为主,转变为以PS43-离子为主,这种转变同时会降低材料的离子电导率。而P2S64-离子的存在则是由于材料中少量残留的Li4P2S6晶体造成的。
图6展示了不同组分的Li2S-P2S5基玻璃态和玻璃陶瓷态电解质的表面形貌。从图6中可以发现,热处理之前的 Li2S-P2S5基玻璃态电解质的表面比较光滑,呈现无定形态。而经过热处理之后的 Li2S-P2S5基玻璃陶瓷态电解质的表面则粗糙不平,出现大小不一的晶粒和微孔,尺寸约为几微米。这表明经过热处理后,Li2S-P2S5基玻璃态电解质内部发生了相变,即由玻璃态向玻璃陶瓷态转变的晶化过程。另外,掺杂 1% Ce2S3改性前后的 Li2S-P2S5基固体电解质的表面形貌类似,说明少量 Ce2S3的引入不会对Li2S-P2S5基固体电解质的表面形貌造成明显改变。

图6 70Li2S-30P2S5和70Li2S-29P2S5-1Ce2S3的玻璃态与玻璃陶瓷态电解质的SEM图Fig.6 SEM images of 70Li2S-30P2S5 and 70Li2S-29P2S5-1Ce2S3 glass and glass-ceramic electrolytes
图7 是 70Li2S-(30-x)P2S5-xCe2S3(x=0,0.5,1,2,3)玻璃陶瓷态电解质的EIS谱图。由图7可知,x=1的电解质的电阻最小,而x=3的电解质的电阻最大。根据离子电导率公式计算可得,x=0的电解质的离子电导率为 0.81×10-3S⋅cm-1,x=0.5 的电解质的离子电导率为 0.99×10-3S⋅cm-1,x=1的电解质的离子电导率为1.52×10-3S⋅cm-1,x=2的电解质的离子电导率为0.90×10-3S⋅cm-1,x=3的电解质的离子电导率为 0.57×10-3S⋅cm-1。这些结果表明掺杂适量的Ce2S3可以明显提高 70Li2S-30P2S5玻璃陶瓷态电解质的离子电导率。根据取代掺杂的机理,主要是因为Ce的离子半径大于P的离子半径,Ce取代P可以增大材料中快离子导体的晶格畸变,拓宽锂离子的传导通道,降低锂离子传递的活化能[4],同时Ce2S3的掺杂还会在Li2S-P2S5基玻璃陶瓷态电解质中产生硫缺陷,进一步提高离子电导率[23]。值得注意的是,当Ce2S3的含量大于1%时,形成的Li2S-P2S5基玻璃陶瓷态电解质的离子电导率会随着x值的增加而逐渐下降,x=3的电解质的离子电导率甚至低于未掺杂Ce2S3的玻璃陶瓷态电解质的离子电导率。这是由于过量的掺杂会破坏快离子导体的结构,导致其结构不稳定的缘故[15]。因此,掺杂Ce2S3的最佳含量为1%,此时形成的70Li2S-29P2S5-1Ce2S3玻璃陶瓷态电解质的离子电导率最高。
3.3 全固态锂电池的测试结果
为了便于对比分析,本文应用70Li2S-30P2S5和70Li2S-29P2S5-1Ce2S32种玻璃陶瓷态电解质分别组装成全固态锂电池,并进行了测试研究。2种全固态锂电池分别表示为 LiCoO2/70Li2S-30P2S5/Li-In和LiCoO2/70Li2S-29P2S5-1Ce2S3/Li-In,它们的首圈充放电曲线如图8所示。由图8可知,2种全固态锂电池的充放电电压平台基本一致,充放电过程均比较稳定。LiCoO2/70Li2S-29P2S5-1Ce2S3/Li-In的首圈充放电比容量较高,分别为125.0 和105.3 mAh⋅g-1。而LiCoO2/70Li2S-30P2S5/Li-In的首圈充放电比容量较低,分别为 118.9 和 101.5 mAh g-1。图 9是这 2种全固态锂电池的循环性能图。由图 9可知,LiCoO2/70Li2S-29P2S5-1Ce2S3/Li-In的循环性能较好,循环50圈后的放电比容量为91.8 mAh⋅g-1,容量保持率为87.2%。而LiCoO2/70Li2S-30P2S5/Li-In的循环性能较差,循环50圈后的放电比容量为56.6 mAh⋅g-1,容量保持率仅为 55.8%。上述实验结果表明,70Li2S-29P2S5-1Ce2S3玻璃陶瓷态电解质比70Li2S-30P2S5玻璃陶瓷态电解质具有更加优异的电化学性能。图10是这2种全固态锂电池循环50圈后的EIS谱图。从图10中可以看出,2个EIS谱线都包含一个高频到中频区的半圆和一条低频区的直线。图10中插入的图片是 EIS谱图的等效电路,其中Rb为固体电解质的本体电阻,Rct为电荷转移电阻,Rif为正极材料和固体电解质之间的界面电阻,Wo为扩散阻抗[21,24]。值得关注的是,LiCoO2/70Li2S-30P2S5/Li-In 循环50圈后的Rb为110 Ω,Rct+Rif为3 140 Ω,而LiCoO2/70Li2S-29P2S5-1Ce2S3/Li-In循环50圈后的Rb为116 Ω,Rct+Rif为 1 412 Ω。可以发现,2种全固态锂电池的电解质本体电阻相差不大,但是相对于LiCoO2/70Li2S-29P2S5-1Ce2S3/Li-In而言,LiCoO2/70Li2S-30P2S5/Li-In循环后的电荷转移电阻与界面电阻却明显增大。这是由于掺杂稀土离子可以稳定正极材料和固体电解质的界面结构,抑制 O2-或 O22-的形成,减弱了界面元素扩散和空间电荷层效应,从而降低了电荷转移电阻和界面电阻的缘故[22,25]。上述 2种全固态锂电池的电化学测试结果表明,在70Li2S-30P2S5玻璃陶瓷态电解质中掺杂1%的Ce2S3,一方面能够提高固体电解质的离子电导率,另一方面可以减小固体电解质与正极材料之间的界面电阻。这2种掺杂效果均会降低电池内阻,从而提高了全固态锂电池的放电性能。

图8 分别应用70Li2S-30P2S5和70Li2S-29P2S5-1Ce2S3玻璃陶瓷态电解质组装的全固态锂电池的首圈充放电曲线Fig.8 The initial charge-discharge curves of all-solid-state lithium batteries assembled with 70Li2S-30P2S5 and 70Li2S-29P2S5-1Ce2S3 glass-ceramic electrolytes

图9 分别应用70Li2S-30P2S5和70Li2S-29P2S5-1Ce2S3玻璃陶瓷态电解质组装的全固态锂电池的循环性能图Fig.9 Cycling performances of all-solid-state lithium batteries assembled with 70Li2S-30P2S5 and 70Li2S-29P2S5-1Ce2S3 glass-ceramic electrolytes

图10 分别应用70Li2S-30P2S5和70Li2S-29P2S5-1Ce2S3玻璃陶瓷态电解质组装的全固态锂电池循环50圈后的EIS谱图Fig.10 EIS results of all-solid-state lithium batteries assembled with 70Li2S-30P2S5 and 70Li2S-29P2S5-1Ce2S3 glass-ceramic electrolytes after 50 cycles
4 结 论
本文通过高能球磨结合热处理的方法制备了一系列组分为70Li2S-(30-x)P2S5-xCe2S3(x=0,0.5,1,2,3)的玻璃陶瓷态电解质,考察了掺杂Ce2S3对70Li2S-30P2S5固体电解质的改性效果。实验结果表明,在最佳的热处理温度和时间下,掺杂1% Ce2S3的Li2S-P2S5基玻璃陶瓷态电解质表现出最高的室温离子电导率(1.52×10-3S⋅cm-1),明显高于70Li2S-30P2S5玻璃陶瓷态电解质的室温离子电导率。分别应用70Li2S-30P2S5和 70Li2S-29P2S5-1Ce2S32种玻璃陶瓷态电解质组装成全固态锂电池进行电化学测试研究。LiCoO2/70Li2S-29P2S5-1Ce2S3/Li-In在室温下0.1C时的初始放电比容量为105.3 mAh⋅g-1,循环50圈后的放电比容量为91.8 mAh⋅g-1,容量保持率为87.2%。对比结果说明,应用70Li2S-29P2S5-1Ce2S3玻璃陶瓷态电解质组装的全固态锂电池的电化学性能明显较好。由于70Li2S-29P2S5-1Ce2S3玻璃陶瓷态电解质具有较高的离子电导率,同时与正极材料之间的界面电阻较小,使得这种掺杂Ce2S3改性后的Li2S-P2S5基玻璃陶瓷态电解质在全固态锂电池中具有很好的应用前景。
符号说明:


